Для кого эта статья:
- ученики 11 классов, готовящиеся к ЕГЭ по химии
- родители, желающие помочь своим детям в подготовке к экзамену
- преподаватели химии, ищущие методические материалы для подготовки учеников
Как проходит ЕГЭ по химии в 2026 году
На ЕГЭ по химии, как и в случае с большинством других предметов, ученик 11 класса должен будет справиться с 2 частями экзамена:
-
1-я часть: 28 заданий с кратким ответом;
-
2-я часть: 6 заданий с развернутым ответом.
Чтобы решить все 34 задания единого государственного экзамена, у ученика будет 210 минут. За это время нужно будет успеть ответить на вопросы обеих частей, подготовить полное решение для задач 2-й части и перенести ответы в бланк.
Кстати, в отличие от ОГЭ, на ЕГЭ по химии не будет задания-эксперимента. Только обычные химические задания разной сложности. В таблице ниже можно посмотреть, сколько будет легких, средних и сложных вопросов.
| Уровень сложности заданий на ЕГЭ по химии | |
|---|---|
| Базовая | 15 |
| Повышенная | 13 |
| Высокая | 6 |
Если вы хотите больше узнать об особенностях экзамена и подготовки к нему, советуем заглянуть в раздел «Демоверсии, спецификации, кодификаторы» сайта ФИПИ. Там вы найдете всю актуальную информацию о ЕГЭ по химии и методические рекомендации. Все это поможет распланировать подготовку к экзамену так, чтобы сдать его на 100 баллов.
Изменения в ЕГЭ по химии
По сравнению с 2025 годом экзамен по химии не изменится, поэтому можно смело использовать материалы прошлого года при подготовке.

Как хорошо сдать ЕГЭ по химии: разбор сложных задач
Как мы узнали из таблицы в предыдущем разделе, экзамен по химии — один из самых сложных. На 34 задания в нем приходится целых 13 повышенной сложности и 6 — высокой. Но если вы хотите поступить в вуз мечты, советуем научиться их решать так, чтобы не упустить ни одного балла. А потому предлагаем начать подготовку прямо сейчас и вместе разобрать несколько таких задач.
Задание 7
Это задание проверяет буквально все ваши знания в области неорганической химии. Здесь нужно знать как химические свойства простых соединений, так и химические свойства сложных соединений. Давайте разберем одно из таких заданий, чтобы понять, как их решать, чтобы сдать ЕГЭ по химии.
Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Вещество | Реагенты |
|---|---|
| А) S | 1) AgNO3, K3PO4, Cl2 |
| Б) SO3 | 2) BaO, NaOH, H2O |
| В) Zn(OH)2 | 3) H2, Cl2, O2 |
| Г) ZnBr2 | 4) HBr, LiOH, CH3COOH (p-p) |
| 5) H3PO4 (p-p), BaCl2, CuO |
Решение:
-
Вариант под буквой А — простое вещество, сера. Как правило, простые вещества взаимодействуют с другими простыми веществами, значительно реже со сложными веществами. Под это описание подходит вариант № 3.
-
Вещество под буквой Б — кислотный оксид. Кислотные оксиды не реагируют с кислотами, поэтому смело вычеркиваем варианты, где присутствует хоть одна кислота. Остаются варианты № 1–3. Реагенты под цифрой 3 тоже можем вычеркнуть, так как кислотный оксид уже в своей максимальной степени окисления и дальше взаимодействовать с кислородом не может. Остаются варианты № 1 и № 2. Оксид серы (VI) может реагировать с основным оксидом с образованием соли, со щелочью с образованием соли и воды, и с водой, при этом образуя кислоту. Выбираем № 2.
-
Амфотерный нерастворимый в воде гидроксид цинка может взаимодействовать только с теми, что способны его растворить. Единственно верный вариант под № 4, где указаны кислоты и щелочь.
-
При взаимодействии соли с другими сложными веществами надо помнить про три признака протекания химической реакции: выпадения осадка, выделение газа и образование малодиссоциирующего вещества — воды. Под это описание подходит вариант под № 1. Но как же хлор? Дело в том, что вышестоящие в группе галогены способны вытеснить нижестоящие из их солей.
Ответ: 3241.
Задание 15
Это задание Единого государственного экзамена проверит ваши знания химических свойств органических соединений. Чтобы справиться с ним, нужно по записанным словами реагирующим веществам составить уравнение реакции и выбрать из перечня один из получившихся продуктов. Давайте рассмотрим на примере, как решать такую задачу.
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| Реагирующие вещества | Продукт взаимодействия |
|---|---|
| А) уксусная кислота и сульфид калия | пропионат калия |
| Б) муравьиная кислота и гидроксид калия | этилат калия |
| В) муравьиный альдегид и гидроксид меди (II) при нагревании | формиат меди (II) |
| Г) этанол и калий | формиат калия |
| ацетат калия | |
| углекислый газ |
Решение:
-
Органические кислоты могут реагировать с солями, если те имеют летучий анион. В результате взаимодействия образуется соль уксусной кислоты и сероводород (летучее соединение). Соль, которая образована в таких условиях, — ацетат калия. Это вещество № 5.
-
Муравьиная кислота проявляет свойства неорганической кислоты и может взаимодействовать с щелочами с образованием соли и воды. Соль муравьиной кислоты — формиат. Правильный ответ № 4.
-
Под буквой В описана качественная реакция на альдегиды с образованием соответствующей кислоты, оксида меди (I) и воды. Исключение — муравьиный альдегид. Он окисляется до углекислого газа, а остальные продукты реакции те же. Соответственно, правильный ответ № 6.
-
Калий как активный металл может замещать протон водорода в гидроксогруппе у спиртов с образованием алкоголята. Правильный ответ: № 2.
Ответ: 5462.
Задание 16
Это задание всё так же проверяет ваши знания по химическим свойствам и, как следствие, умение записывать превращения в рамках органической химии. Однако оно усложняется тем, что теперь вам самим нужно подобрать такой реактив, чтобы произошло уже известное превращение. Давайте попробуем решить один из вариантов такой задачи вместе — это повысит ваши шансы сдать ЕГЭ на 100 баллов.
Задана схема превращений веществ:
Определите, какие из указанных веществ являются веществами х и у:
-
2-бромбутан;
-
этаналь;
-
этен;
-
метилпропан;
-
хлорэтан.
Решение:
Посмотрим, что случилось с известными нам веществами.
-
У спирта исчезла ОН-группа, затем что-то произошло, и углеродная цепочка увеличилась вдвое. Мы помним, что когда цепочка увеличивается вдвое, то, скорее всего, это реакция Вюрца. А в неё вступают только галогеналканы. Ищем нужный нам вариант. Он находится под номером 5. Первое вещество найдено.
-
Бутан подвергают нагреванию с использованием катализатора. Нужно помнить, что в таких условиях проводится изомеризация алканов. Из бутана получается метилпропан. Ответ: № 4.
Ответ: 54.
Задание 26
Теперь разберем задачи, которые заканчивают тестовую часть ЕГЭ по химии. Рассмотрим условие одной из них на нахождение массы соли, которую необходимо добавить для получения раствора с новой заданной массовой долей.
Вычислите массу нитрата калия (в граммах), которую следует растворить в 160 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%. Ответ округлите до десятых.
Чтобы решить эту задачу, вспомним основную формулу нахождения массовой доли:
-
Найдем массу изначально растворенного нитрата калия в растворе, выразив из формулы выше:
подставим значения:
-
Чтобы увеличить массовую долю соли в растворе, необходимо ее добавить еще. Но мы не знаем сколько, поэтому примем массу добавляемой соли за Х и подставим в исходную формулу нахождения массовой доли с учетом новых значений:
-
Далее в дело вступает чистая математика. Разделим обе части уравнения на 100%:
-
По пропорции перемножим крест-накрест:
0,12 * (160 + X) = 16 + X.
-
Раскроем скобки:
19,2 + 0,12Х = 16 + Х.
-
Приведем подобные: с Х в одну сторону, без Х — в другую:
3,2 = 0,88Х.
-
Найдем Х:
Масса нитрата калия, которую необходимо добавить для увеличения массовой доли раствора до 12%, равна 3,6 граммам.
Ответ: 3,6.
Задание 28
Эта задача может встретиться на экзамене в нескольких вариантах. Давайте разберем один из них — задание на нахождение доли выхода продукта реакции.
В результате реакции тримеризации ацетилена объемом 26,88 л (н.у) получили 24,96 г бензола. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
Решение:
-
Для начала напишем формулу, по которой считается доля выхода продукта:
Как определить, какая масса практическая, а какая — теоретическая? Значения, которые даются после слова «получили», — это практическая масса. Та, которая получилась в результате проведения химической реакции в реальных условиях. Масса теоретическая — та, которую рассчитывают из уравнения реакции, зная массу исходных реагентов.
-
Напишем уравнение химической реакции тримеризации ацетилена:
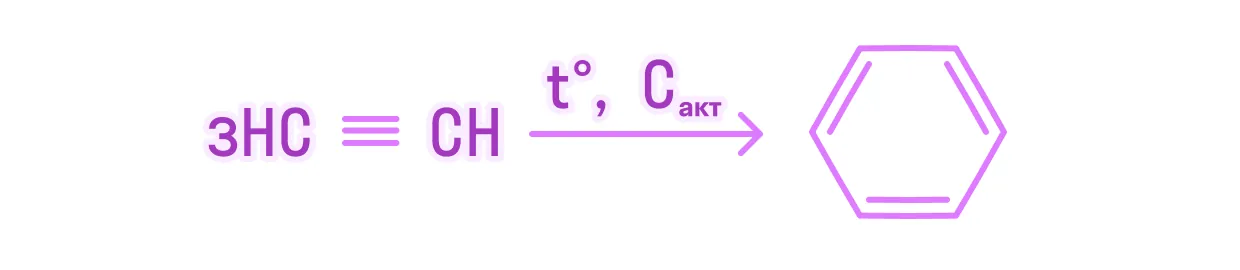
-
Найдем количество вещества ацетилена:
подставим значения:
-
Перейдем на количество вещества бензола, получаемого из ацетилена:
-
Зная количество вещества бензола, найдем его массу:
подставим значения:
m = 0,4 * 78 = 31,2 грамма.
-
Масса, рассчитываемая по уравнению реакции, является теоретической. Масса практическая дана нам по условию. Подставим полученные данные по массам в формулу для нахождения доли выхода продукта реакции:
Доля выхода бензола из данного объема ацетилена составляет 80%.
Ответ: 80.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Как оценивают готовые работы на ЕГЭ по химии
1-я часть
В 1-й части Единого государственного экзамена по химии задания 1–5, 9–13, 16–21, 25–28 оценивают 1 баллом, если вы запишете верный ответ по эталону. При этом в заданиях 1, 3, 4, 11, 12, 13, 17 и 18 ответ — это ряд цифр. То, в каком порядке вы их запишете, не влияет на оценку. Например, если в задании верны варианты под номерами 1 и 4, их можно записать как 14 или как 41. И в обоих случаях ответ засчитают как верный.
За правильные ответы в заданиях 6, 7, 8, 14, 15, 22, 23 и 24 можно получить по 2 балла. Если ваш ответ отличается от эталона на один символ, его оценят в 1 балл. Во всех остальных случаях задание считают выполненным неверно и ставят 0 баллов.
2-я часть
В этой части нужно записать не только ответ, но и решение. А значит, и оценивать такие задания будут сразу по нескольким критериям. Зато за верный ответ в некоторых вопросах можно получить больше баллов, чем за любое задание 1-й части. Максимум — 5 баллов. А теперь давайте разберемся, как именно их будут оценивать.
| Задание № 29 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества и записал уравнение химической реакции, составил электронный баланс, указал окислитель и восстановитель | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 30 | Баллы |
|---|---|
| Ответ верный и полный: ученик выбрал вещества, записал все нужные уравнения реакции | 2 |
| Есть только один верный элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 2 |
| Задание № 31 | Баллы |
|---|---|
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 4 |
| Задание № 32 | Баллы |
|---|---|
| Правильно записаны 5 уравнений реакции | 5 |
| Правильно записаны 4 уравнения реакции | 4 |
| Правильно записаны 3 уравнения реакции | 3 |
| Правильно записаны 2 уравнения реакции | 2 |
| Правильно записано 1 уравнение реакции | 1 |
| Все уравнения реакции записаны неверно | 0 |
| Максимальный балл | 5 |
| Задание № 33 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 3 элемента | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 3 |
| Задание № 34 | Баллы |
|---|---|
| Ответ верный и полный, записаны все 4 элемента | 4 |
| Правильно записаны только 3 элемента ответа | 3 |
| Правильно записаны только 2 элемента ответа | 2 |
| Правильно записан только 1 элемент ответа | 1 |
| Все элемента ответа записаны неверно | 0 |
| Максимальный балл | 4 |
Как сдать ЕГЭ по химии на 3, 4 и 5
Мы уже познакомились с критериями, по которым будут оценивать работы на ЕГЭ. А теперь давайте разберемся, сколько баллов нужно получить для оценок 3, 4 или 5. Официально ЕГЭ не оценивают по пятибалльной системе с 2008 года. Если вам так проще оценить свои знания, их можно перевести. Но это будет лишь примерный перевод.
Будьте внимательны: баллы из таблиц выше — первичные, а требования к абитуриентам на поступление выражены в тестовых. Чтобы понять, сколько заданий точно нужно решить, чтобы поступить, надо перевести баллы из одной системы в другую. Это можно сделать по таблице ниже.
| Первичные баллы | Тестовые баллы | Оценка |
|---|---|---|
| <11 | <36 | 2 |
| 11–25 | 36–55 | 3 |
| 26–38 | 56–72 | 4 |
| 39–56 | 73–100 | 5 |
6 рекомендаций, как подготовиться к ЕГЭ по химии
Единый государственный экзамен — это ответственная задача, от результатов подготовки к которой иногда многое зависит. Чтобы немного облегчить для вас этот путь, мы собрали 6 простых, но рабочих советов от наших преподавателей. Следуйте им и тогда сможете подготовиться к экзамену по химии как можно лучше.
-
Узнайте все о структуре ЕГЭ и научитесь работать с КИМами.
-
Начинайте готовиться заранее. Но если получилось так, что осталось мало времени, составьте новый экспресс-план с помощью вашего преподавателя.
-
Ведите календарь подготовки к экзамену. Отмечайте на нем запланированные темы, разные методики, занятия у репетитора, пробные ЕГЭ и самоподготовку.
-
Распределяйте время на темы, исходя из ваших знаний. Больше учите то, что «западает», остальное — повторяйте.
-
Советуйтесь с учителем. Это может быть ваш преподаватель по химии или репетитор. Круто, если он сможет поделиться с вами опытом подготовки к ЕГЭ.
-
Заботьтесь о своем здоровье, не забывайте отдыхать, не лишайте себя живого общения. Все это может сказаться на вашем самочувствии, а значит, и баллах тоже.
Если вы хотите сдать ЕГЭ по химии на 100 баллов, советуем тщательно продумать, как вы будете готовиться к нему. Лучший из них — совмещать самостоятельную работу и дополнительные занятия.
На курсах подготовки к ЕГЭ по химии в Skysmart школьники отрабатывают все типы задач и разбирают критерии оценок. Для каждого из них мы составляем индивидуальный план, который приведет к нужным баллам. Он учитывает уровень знаний ученика и время до экзамена, что позволяет «выжать» максимум из подготовки. А еще мы рассказываем о ЕГЭ без «страшилок» и прикрас, чтобы школьник точно знал, что его ждет на экзамене. Ждем на первом бесплатном занятии!



















