Для кого эта статья:
- Студенты и школьники, изучающие химию
- Преподаватели и учителя химии
- Любители науки, интересующиеся качественными реакциями в химии
Что такое качественная реакция
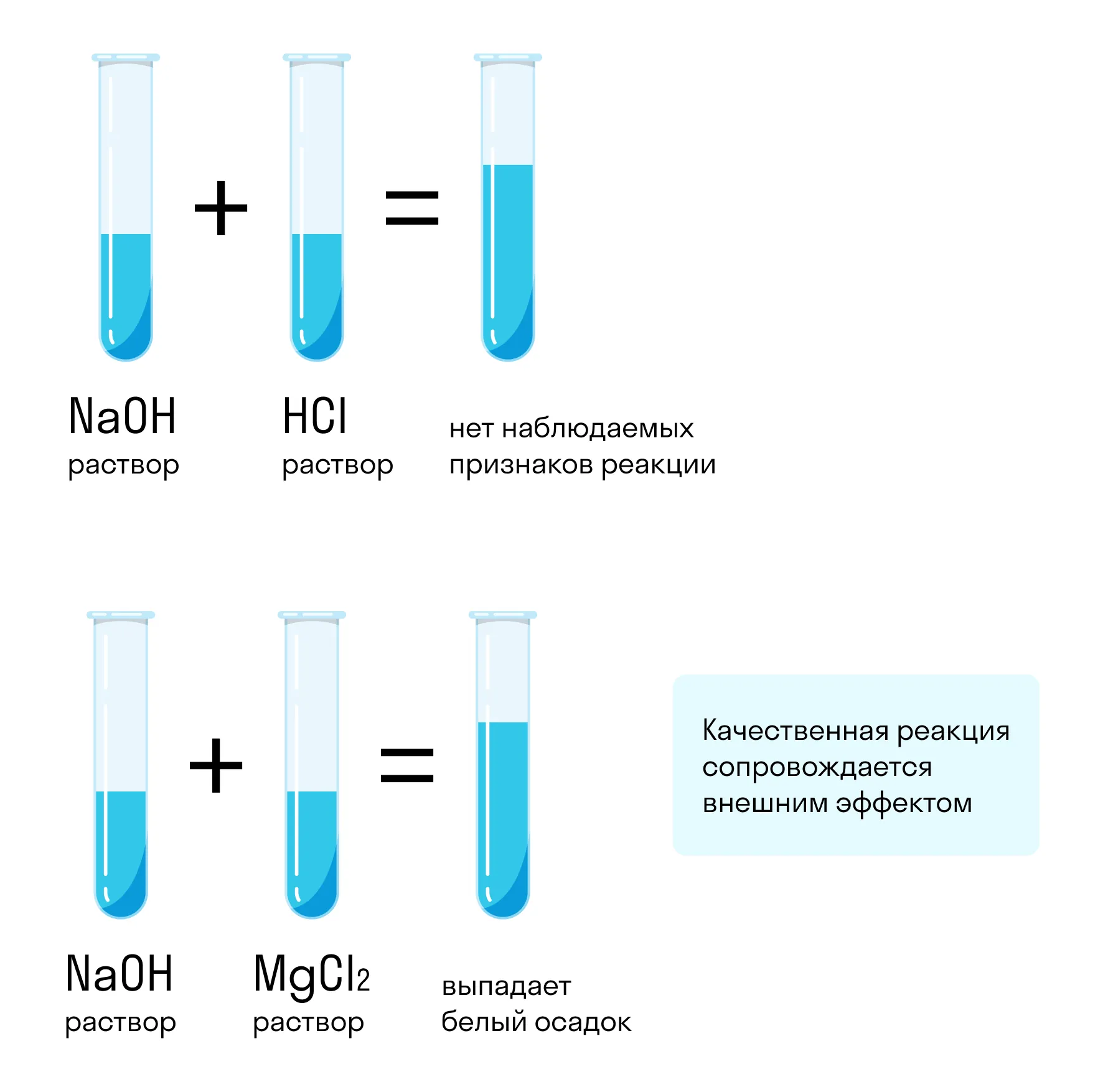
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.

Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Правила растворимости химических соединений
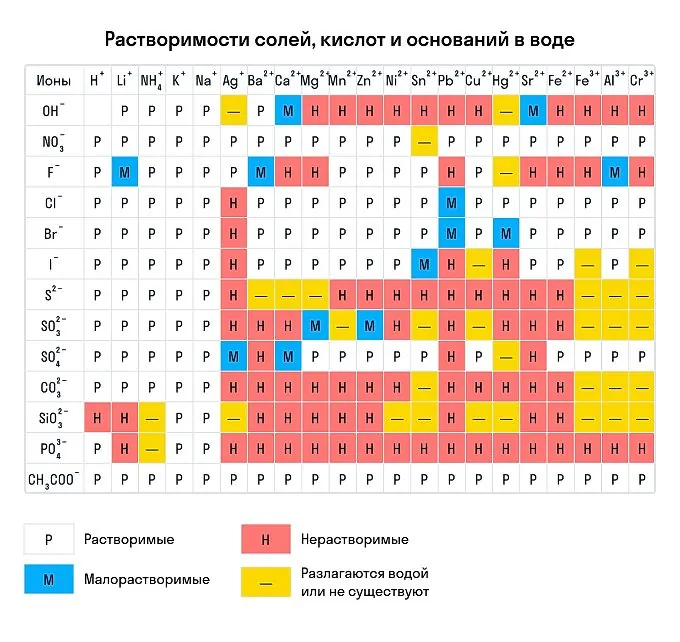
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
любые карбонаты, фосфаты и сульфиты, кроме K2CO3, K2SO3, K3PO4, Na2CO3, Na2SO3, Na3PO4, (NH4)2CO3, (NH4)2SO3, (NH4)3PO4.
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
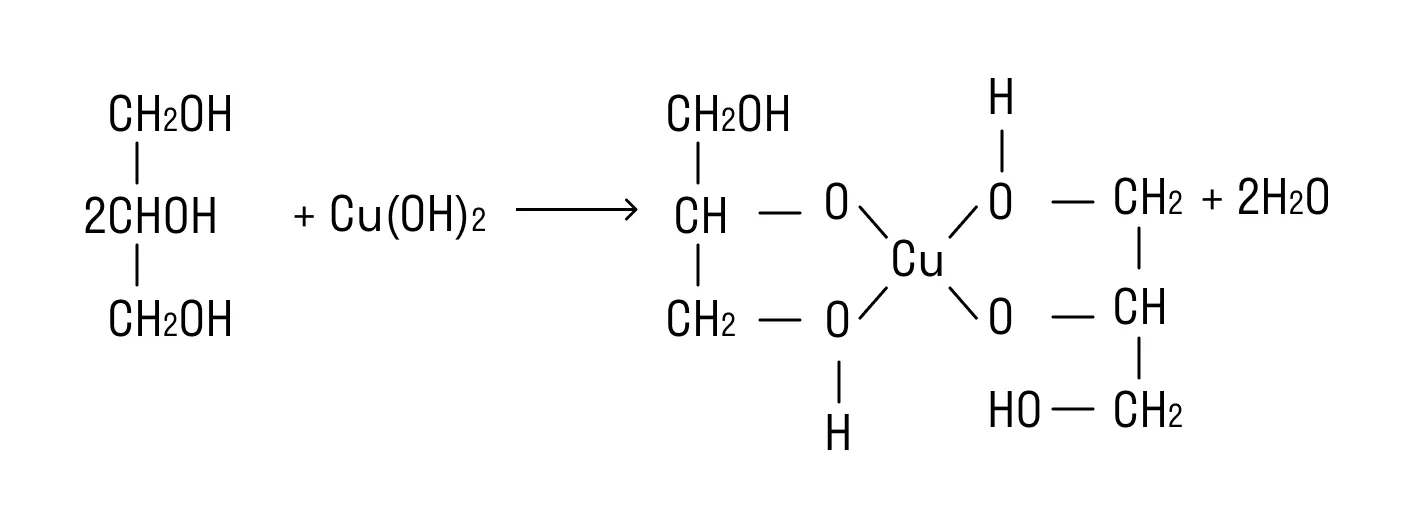
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
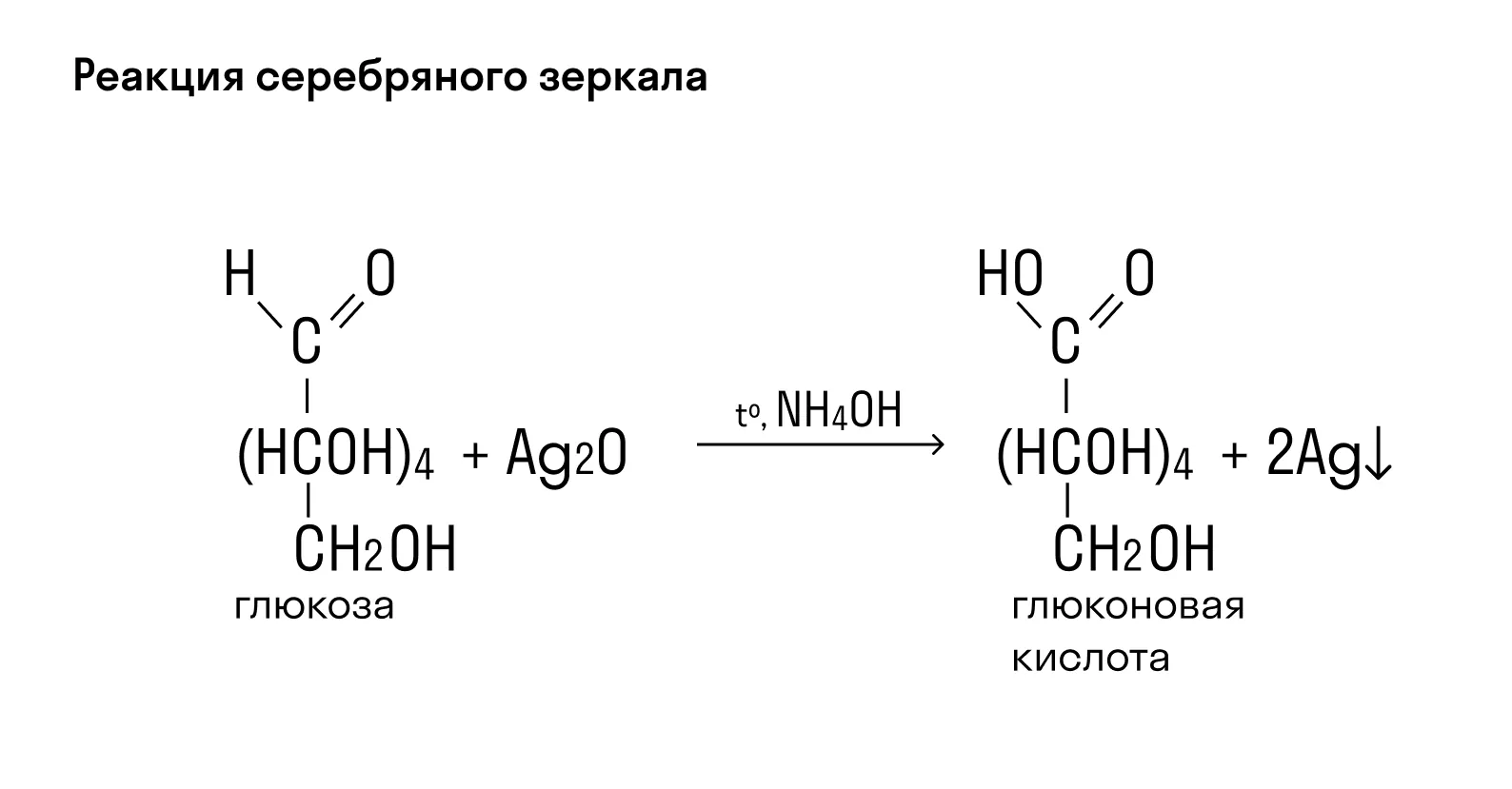
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
Одной из важных составляющих качественных реакций в неорганической химии является определение функциональных групп веществ. Например, при рассмотрении химических свойств спиртов важно учитывать их формулы и методы получения, подробно описанные в статье «Формула многоатомных спиртов».
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
C6H5OH + 2Br2 ⇒ C6H2Br3OH + 3HBr — реакция с бромной водой.
3C6H5OH + FeCl3 ⇒ (C6H5O)3Fe + 3HCl — реакция с хлоридом железа (III).
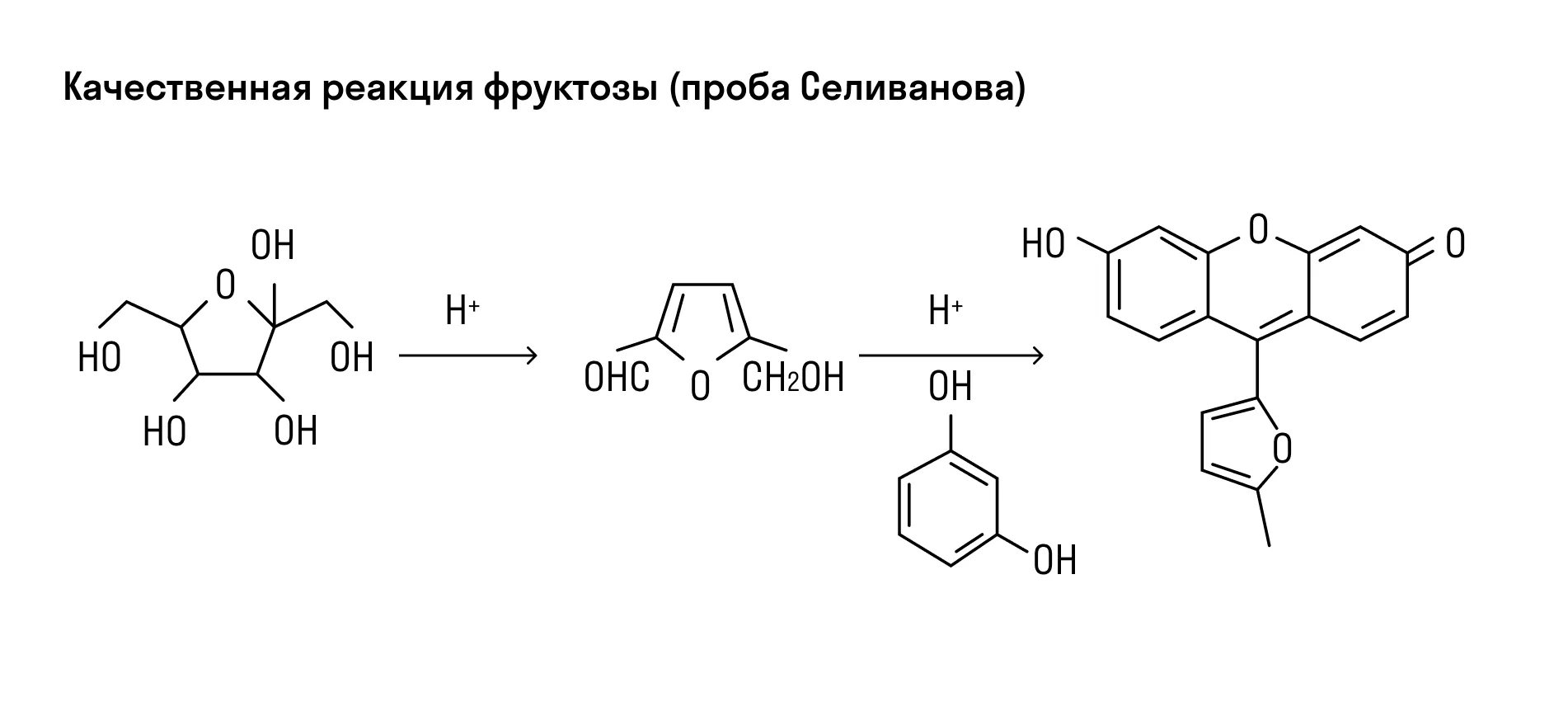
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
I2 + (C6H10O5)n ⇒ I2(C6H10O5)n— качественная реакция крахмала с йодом.
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Органическое соединение | Реактив | Уравнение реакции | Признак реакции |
|---|---|---|---|
Непредельные углеводороды (алкены, алкины, диены) | KMnO4 | 3СН2=СН2 + 4Н2О + 2КMnO4 → 2КОН + 2MnO2↓ + 3СН2(ОН)—СН2(ОН) | Раствор обесцвечивается |
I2 | СН2=СН—CН3 + I2 → СН2(I)—СН(I)—CH3 | ||
Br2 | СН2=СН2 + Br2 → СН2(Br)—СН2(Br) | ||
Ацетилен | аммиачный раствор Ag2O | CH≡СН + 2[Ag(NH3)2]OH → AgC≡CAg↓ + 4NH3↑ + 2H2O | Образуется белый осадок |
|
Бензол |
HNO3 + H2SO4 |
t°C, H2SO4(конц.) |
Раствор желтого цвета с запахом миндаля |
|
Толуол |
KMnO4 |
5C6Н5—СН3 + 6KMnO4 + 9H2SO4 → 5C6Н5—COOH + 14H2O + 3K2SO4 + 6MnSO4 |
Раствор обесцвечивается |
|
Фенол (карболовая кислота) |
FeCl3 |
3C6Н5OH + FeCl3 → (C6Н5O)3Fe + 3HCl |
Раствор приобретает фиолетовый цвет |
|
Br2 (бромная вода) |
C6Н5OH + 2Br2 → C6Н2Br3OH↓ + 3HBr |
Белый осадок и резкий запах |
|
|
Анилин (аминобензол) |
CaOCl2 |
C6Н5NH2 + 3CaOCl2 → C6H5NO2 + H2O + 3CaCl2 |
Раствор приобретает фиолетовый цвет |
|
Этанол |
I2 + NaOH |
C2H5OH + 4I2 + NaOH → CHI3↓ + HCOONa + 5HI |
Желтый кристаллический осадок, резкий запах |
|
CuO (медная проволока) |
C2H5OH + CuO → Cu↓ + CH3—CHO + H2O |
Образование медного осадка, характерный запах |
|
|
Гидроксогруппа (спирты, фенол, гидроксикислоты) |
Металлический Na |
2R—OH + 2Na → 2R—O-Na+ + H2↑ |
Гелеобразная масса с газовыми пузырьками |
|
Эфиры |
Н2О в присутствии NaOH (нагревание) |
CH3—C(O)—O—C2H5 + H2O ↔ CH3COOH + C2H5OH |
Характерный запах |
|
Многоатомные спирты, глюкоза |
Свежеосажденный гидроксид меди (II) в сильно щелочной среде |
|
Раствор синеет |
|
Карбонильная группа – СНО (альдегиды, глюкоза) |
Аммиачный раствор Ag2O |
R—CHO + 2[Ag(NH3)2]OH → R—COOH + 2Ag↓ + 4NH3↑ + H2O |
Образование тонкого слоя Ag на стенках пробирки (эффект «серебряного зеркала») |
|
Свежеосажденный Сu(OH)2 |
R—CHO + 2Cu(OH)2 → R—COOH + Cu2O↓ + 2H2O |
Красный осадок |
|
|
Карбоновые кислоты |
лакмус |
— |
Раствор становится розовым |
|
раствор Na2CO3 |
2R—COOH + Na2CO3 → 2R—COO-Na+ + H2O + CO2↑ |
Выделение газа |
|
|
спирт +H2SO4 (конц.) |
R—COOH + HO—R1 ↔ RC(O)OR1 + H2O |
Характерный запах |
|
|
Муравьиная кислота |
Свежеосажденный Сu(OH)2 |
HCOOH + 2Cu(OH)2 → Cu2O↓ + 3H2O + CO2↑ |
Красный осадок и выделение газа |
|
Аммиачный раствор Ag2O |
HCOOH + 2[Ag(NH3)2]OH → (NH4)2CO3 + 2Ag + 2NH3 + H2O |
Образование тонкого слоя Ag на стенках пробирки (эффект «серебряного зеркала») |
|
|
Олеиновая кислота |
KMnO4 или I2 или Br2 |
C17H33COOH + I2 → C8H17—CH(I)—CH(I)—(CH2)7—COOH |
Раствор теряет цвет |
|
Ацетаты |
FeCl3 |
3CH3COONa + FeCl3 → (CH3COO)3Fe + 3NaCl |
Раствор становится бурым |
|
Стеарат натрия |
Н2О + фенолфталеин |
C17H35COONa + H2O ↔ C17H35OOH↓ + NaOH |
Малиновый раствор |
|
Раствор соли кальция |
2C17H35COONa + Ca2+ ↔ (C17H35COO)2Ca↓ + 2Na+ |
Образование серого осадка |
|
|
Концентрированная неорганическая кислота |
C17H35COONa + H+ ↔ C17H355COOH↓ + Na+ |
Образование белого осадка |
|
|
Белок |
Огонь |
Реакция горения |
Запах жженой шерсти |
|
НNO3 (конц.) при нагревании |
Ксантопротеиновая реакция |
Раствор приобретает желтый цвет, желтый осадок |
|
|
Свежеосажденный Сu(OH)2 |
Биуретовая реакция |
Раствор становится фиолетово-синим |
Качественные реакции на неорганические вещества и ионы
В неорганической химии класс соединения, наличие тех или иных молекул или ионов также можно определить с помощью качественных реакций. При взаимодействии с определенным реагентом катионы или анионы неорганических соединений провоцируют внешние эффекты — выпадение осадка, окрашивание раствора, выделение газа и т. д.
Например, анион хлора с катионом серебра дает белый творожистый осадок, а если с тем же катионом серебра соединить анион брома — появится светло-желтый осадок. Катион железа в щелочной среде дает бурый осадок. Словом, в неорганике качественные реакции служат таким же полезным инструментом для идентификация химических веществ, как и в органике.
Качественные реакции играют важную роль в различных областях науки и промышленности. Например, понимание функций белков в организме может быть полезным при изучении биохимических процессов. Подробнее о функциях белка можно узнать из другой нашей статьи.
Качественные реакции на катионы
|
Катион |
Реактив |
Характерный признак |
|---|---|---|
|
Ba2+ |
SO42- |
Образование белого осадка: |
|
NH4+ |
OH- |
Резкий запах: Синий цвет влажной фенолфталеиновой или лакмусовой бумажки. |
|
H+ |
Лакмус |
Окрашивается в красный. |
|
Al3+ |
Щелочь |
Образование гелеобразного белого осадка, если в раствор добавлено небольшое количество щелочи: При дальнейшем добавлении щелочи белый осадок растворяется: |
|
Cu2+ |
OH- S2- |
Образование голубого осадка: Образование черного осадка: |
|
Fe3+ |
OH- K4[Fe(CN)6] NH4SCN |
Осадок бурого цвета: Синий осадок: Окрашивание раствора в ярко-красный цвет: |
|
Ag+ |
Cl- Br- I- |
Белый творожистый осадок: Желто-белый осадок: Желтый осадок: |
|
Pb+ |
I- |
Образование ярко-желтого осадка: |
Качественные реакции на катионы щелочных металлов
Почти все соли щелочных металлов обладают высокой растворимостью, поэтому качественный анализ проводят сухим пирохимическим способом — с помощью горелки. Проба соли, внесенная на платиновой или нихромовой проволоке в пламя горелки, меняет его цвет. По этому признаку можно судить о присутствии катионов того или иного щелочного металла. Это самые простые и быстрые качественные реакции в неорганической химии.
Li+ — придает темно-розовый, карминовый цвет;
Na+ — делает пламя желтым;
K+ — окрашивает в фиолетовый цвет;
Rb+ — придает буро-красный оттенок;
Cs+ — дает голубой или фиолетово-красный цвет.

Качественные реакции на анионы
|
Анион |
Реактив |
Характерный признак |
|---|---|---|
|
SO42- |
Ba2+ |
Белый осадок: |
|
NO3− |
H2SO4 (конц.) и Cu с нагреванием раствора |
Выделение бурого газа: |
|
PO43- |
Ag+ |
Светло-желтый осадок: |
|
CrO42- |
Ba2+ |
Желтый осадок: |
|
S2- |
Pb2+ |
Черный осадок: |
|
CO32- |
Ca2+ H+ |
Белый осадок: Выделение газа без цвета и запаха, эффект вскипания раствора: |
|
CO2 |
Ca(OH)2 |
Белый осадок: Растворение осадка при дальнейшем добавлении CO2: |
|
SO32- |
H+ |
Выделение газа с сильным запахом: |
|
F− |
Ca2+ |
Белый осадок: |
|
Cl− |
Ag+ |
Белый творожистый осадок: |
|
Br− |
Ag+ |
Желтый осадок, который становится темнее под действием света: |
|
I− |
Ag+ |
Желтый, постепенно темнеющий под действием света осадок: |
|
OH− |
Лакмусовая бумага Фенолфталеин |
Окрашивается в синий. Окрашивается в малиновый. |
|
Вещество |
Реактив |
Реакция |
Характерные признаки |
|---|---|---|---|
|
Н2 |
О2 |
2Н2 + О2 = 2Н2О |
Образование конденсата на холодных поверхностях |
|
О2 |
Зажженная лучина |
С + О2 = СО2 |
Лучина ярко разгорается |
|
Сl2 |
Бумага, смоченная клейстером и раствором иодида калия |
2KI + Cl2 = 2KCl + I2↓ |
Окрашивается в синий цвет |
|
I2 |
Клейстер |
— |
Окрашивается в синий цвет |
|
СО2 |
Известковая вода |
Са(ОН)2 + СО2 = СаСО3↓ + Н2О |
Раствор мутнеет |
|
NH3 |
Хлороводород |
NH3 + HCl = NH4Cl |
Образование белого газообразного вещества с характерным запахом |
Цвета осадков в химии
Как видите, многие качественные реакции проходят с образованием осадков. Для того, чтобы проще было определить, какие соединения вступили в реакцию, можно воспользоваться таблицей цветов осадков. Она поможет в том случае, когда мы наблюдаем внешний эффект реакции, но можем лишь предполагать, какие химические вещества в ней участвовали.
|
Цвет осадка |
Качественная реакция |
|---|---|
|
Белый творожистый
|
Ag+ + Cl— → AgCl↓ соли серебра хлорид-ионы |
|
Белый осадок
|
Ba2+ + SO4-2 → BaSO4↓ соли бария сульфат-ионы |
|
Белый осадок
|
Сa(OH)2 + SO2 = CaSO3↓ + H2O
|
|
Белый осадок
|
Al3+ + 3OH— = Al(OH)3↓
|
|
Белый осадок
|
Сa(OH)2 + CO2 = CaCO3↓ + H2O
|
|
Светло-желтый осадок
|
Ag+ + Br— → AgBr↓ бромид-ионы соли серебра |
|
Желтый осадок
|
Ag+ + I— → AgJ↓ иодид-ионы соли серебра |
|
Желтый осадок
|
3Ag+ + PO43- → Ag3PO4↓ |
|
Бурый осадок
|
Fe3+ +3OH— → Fe(OH)3↓ соли железа |
|
Зеленый осадок |
Fe2+ + 2OH— → Fe(OH)2↓ |
|
Голубой осадок
|
Cu2+ + 2OH— → Cu(OH)2↓ соли меди (II) |
|
Синий осадок
|
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ 4Fe3+ + 3[Fe(CN)6]-4 → Fe4[Fe(CN)6]3↓ |
|
Черный осадок
|
Fe2+ + S2- → FeS↓ Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ |