Для кого эта статья:
- Студенты и специалисты в области химии
- Исследователи, работающие в области материаловедения и экологии
- Преподаватели и учебные заведения, занимающиеся углубленным изучением химии
Амины
Амины — это органические производные аммиака, где один, два или все три атома водорода замещены углеводородными радикалами.
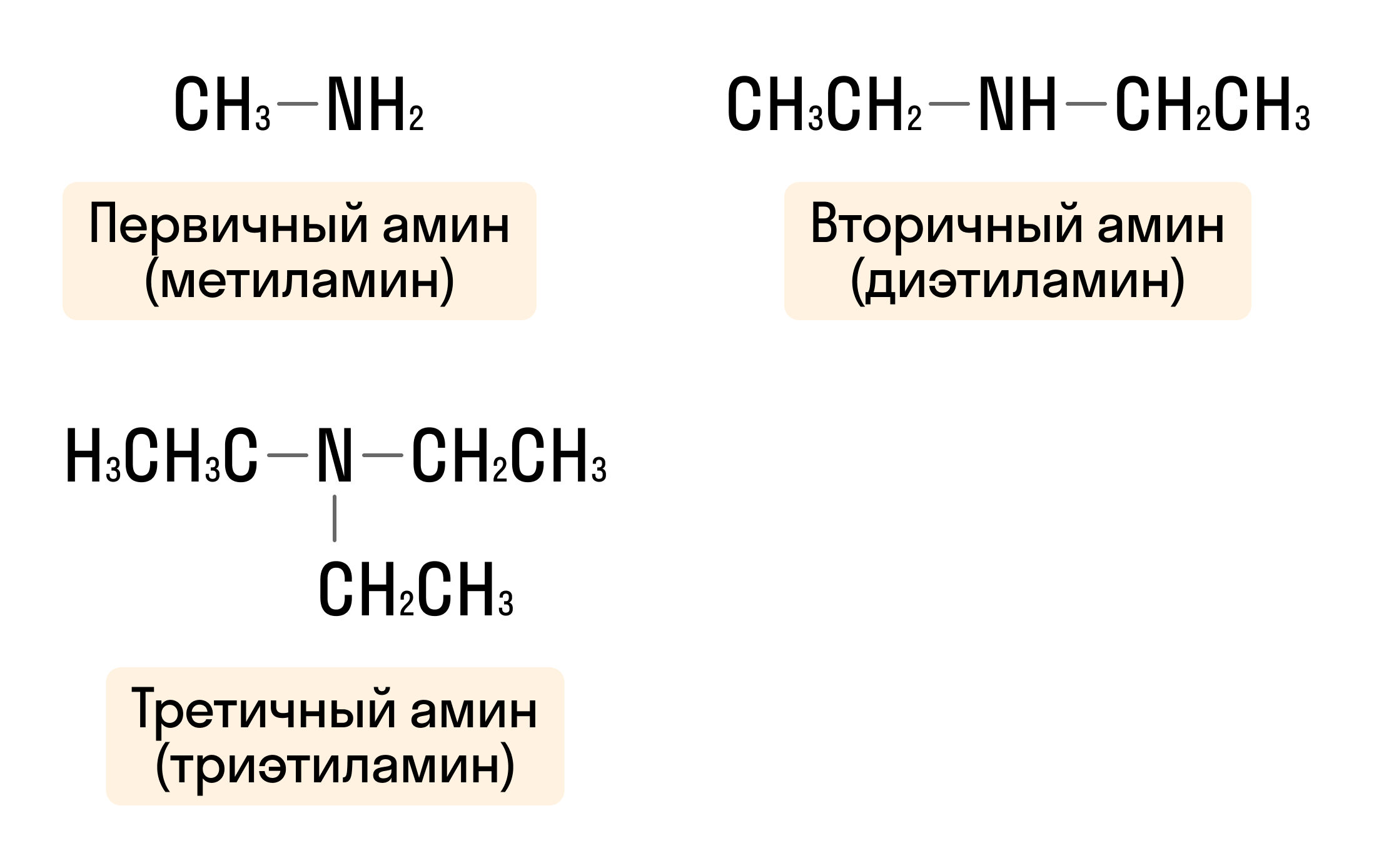
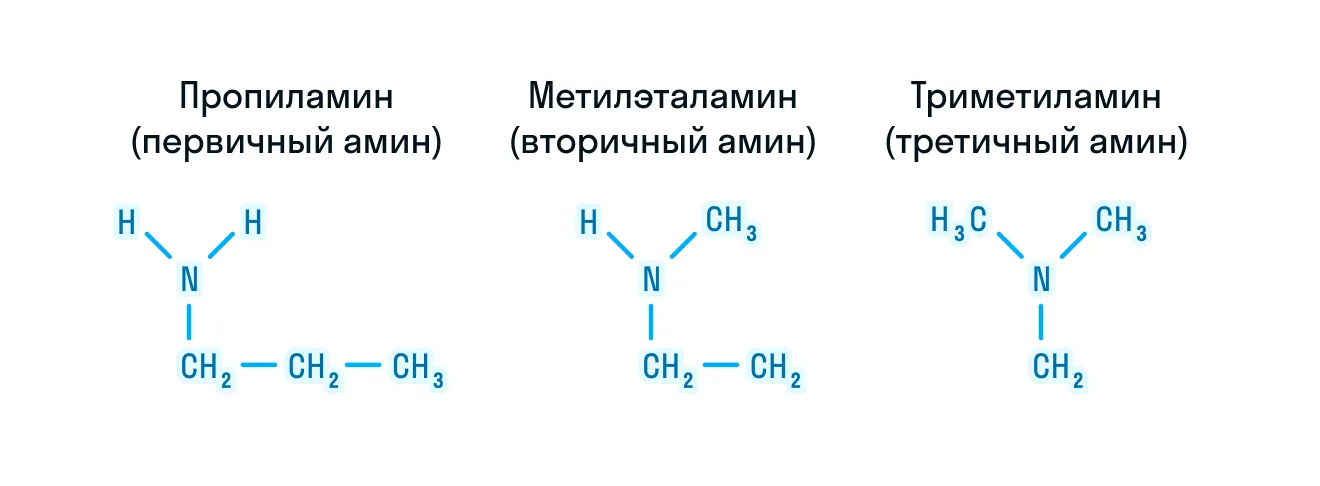
Один или несколько атомов водорода (H) при азоте могут быть замещены на другие радикалы. По этому признаку амины делятся на 3 категории: первичные амины, вторичные и третичные.
А вот в зависимости от структуры углеродного скелета выделяют предельные, непредельные, циклические и ароматические амины. В этом разделе мы подробно рассмотрим предельные (насыщенные) амины.
Итак, насыщенные амины не имеют кратных связей в углеводородном радикале. Общая формула CnH2n+1NH2. Функциональная группа ーNH2 называется аминогруппой.
Физические свойства
Физические свойства предельных аминов отличаются, исходя из длины углеводородной цепи:
- Низшие амины (С1 и С2) — это газы, хорошо растворимые в воде.
- Амины с углеводородным радикалом С3 по С10 — это жидкие вещества.
- Высшие амины С10 по Сn — твёрдые нерастворимые вещества.
Изомерия
Для аминов характерна структурная изомерия:
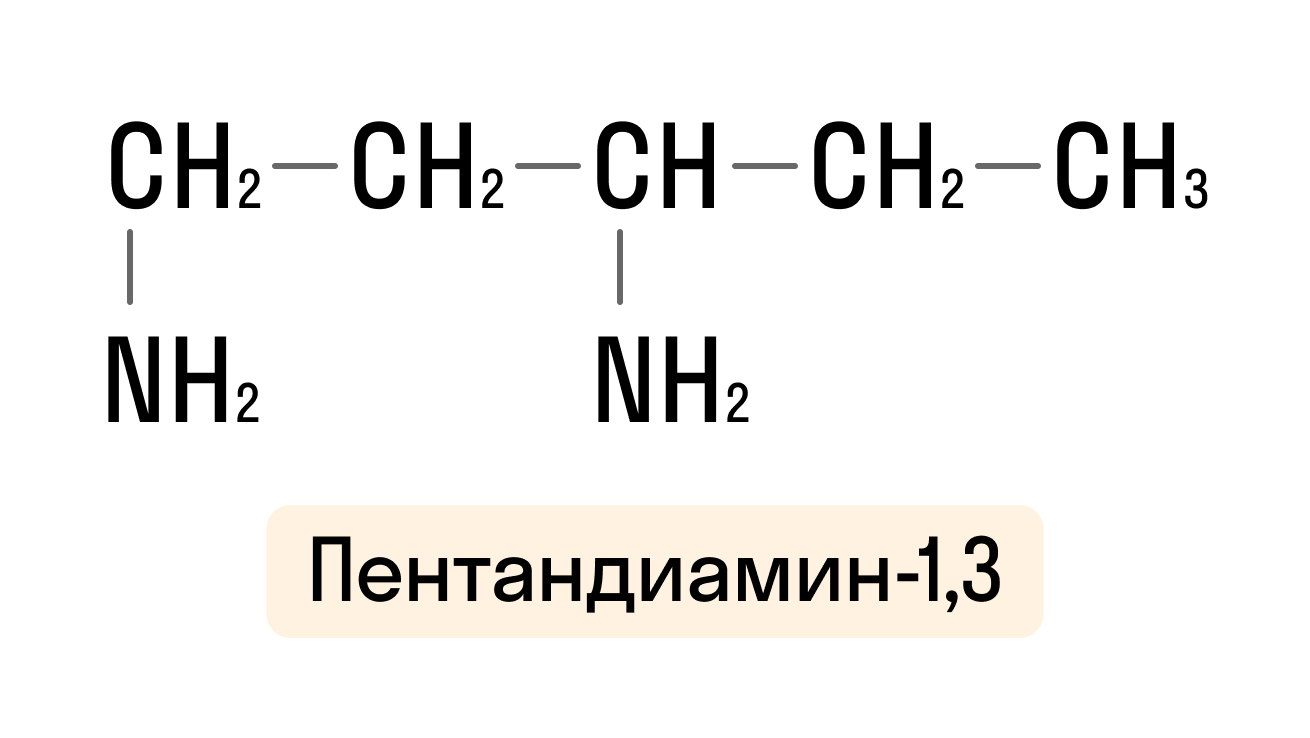
- Изомерия углеродной цепи:
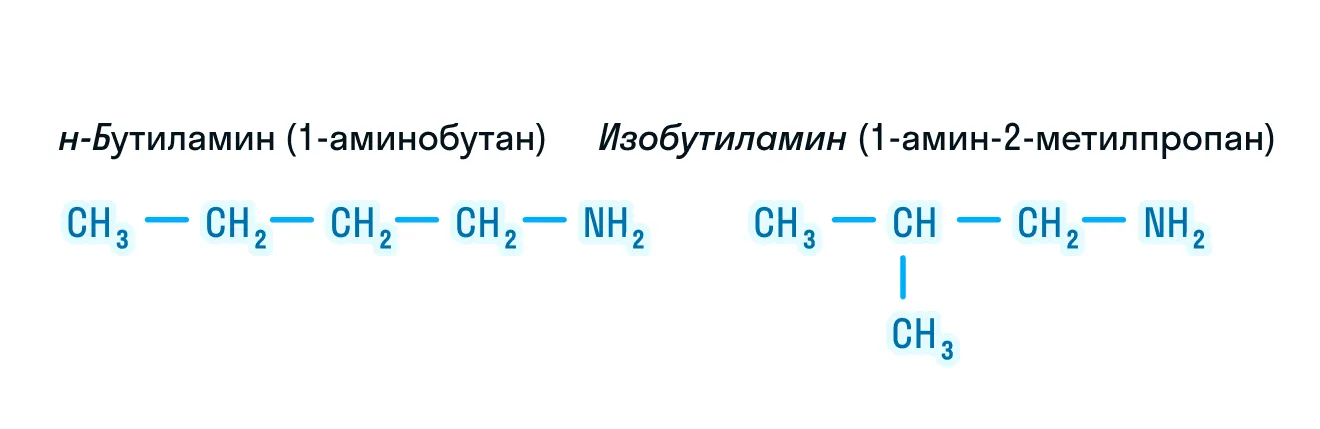
- Изомерия положения группы ーNH2. Благодаря данному типу изомерии можно сделать вывод о том, что первичные, вторичные и третичные амины являются друг для друга изомерами:
Номенклатура
Дать название первичным аминам можно по схеме:
Углеводородный радикал + суффикс «амин»
Например: CH3—CH2—NH2 — этиламин.
Названия вторичных и третичных аминов образуются так:
Углеводородный радикал + суффикс «амин» + положение аминогруппы
Получение аминов
Получают амины несколькими способами:
Обработка спиртов аммиаком:
CH3OH + NH3 → CH3ーNH2 + H2O
Обработка галогеналканов аммиаком:
CH3ーCH2ーCl + NH3 → CH3ーCH2ーNH2 + HCl
В обоих случаях полученный первичный амин может и дальше взаимодействовать с исходными реагентами и таким образом можно получить вторичный, а затем и третичный амин.
Гидрирование нитросоединений:
CH3ーCH2ーNO2 + 3H2 → CH3ーCH2ーNH2 + 2H2O
Гидрирование нитрилов:
CH3ーCH2ーC☰N+ 2H2 → CH3ーCH2ーCH2ーNH2
Химические свойства
Амины проявляют слабые основные свойства.
- Растворение в воде с образованием катиона аммония:
- CH3ーNH2 + H2O → (CH3ーNH3)+ + OH−
- Взаимодействие с неорганическими кислотами:
- CH3ーNH2 + H2SO4 = (CH3ーNH3)HSO4 — кислая соль — гидросульфат метиламмония.
- 2CH3ーNH2 + H2SO4 = (CH3ーNH3)2SO4 — средняя соль — сульфат метиламмония.
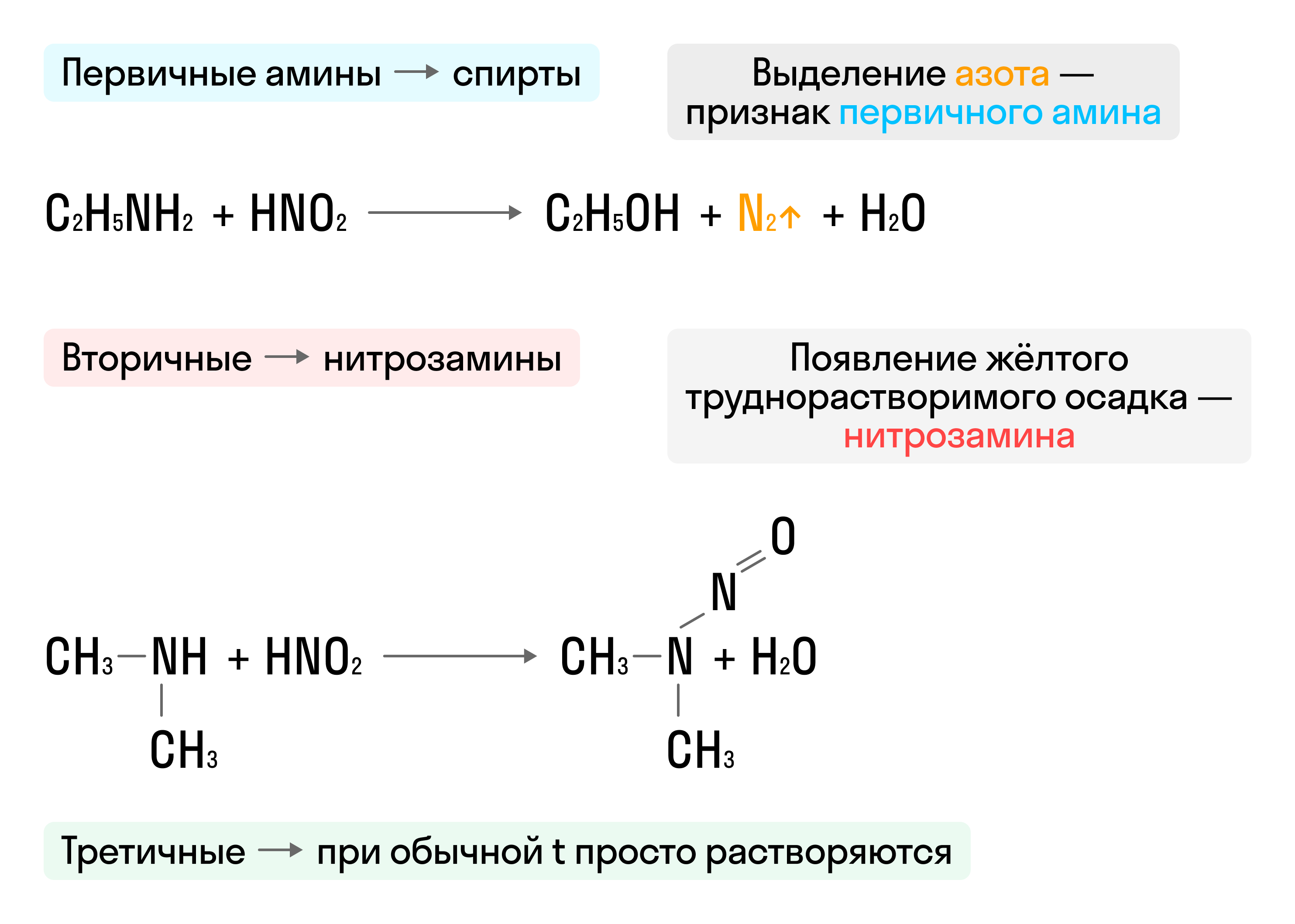
- Взаимодействие с азотистой кислотой (HNO2) — качественная реакция:
- Взаимодействие с карбоновыми кислотами и их производными с образованием амидов:
- CH3—NH2 + CH3—COOH → CH3—NH—C(O)—CH3 + H2O
- CH3—NH2 + CH3—COCl → CH3—NH—C(O)—CH3 + HCl
- Алкилирование галогеналканами:
- Первичный амин
- Первичный амин
- Алкилирование спиртами:
- Первичный амин
- Первичный амин
- Горение:
- 4C2H5—NH2 + 15O2 → 8CO2↑ + 14H2O + 2N2↑

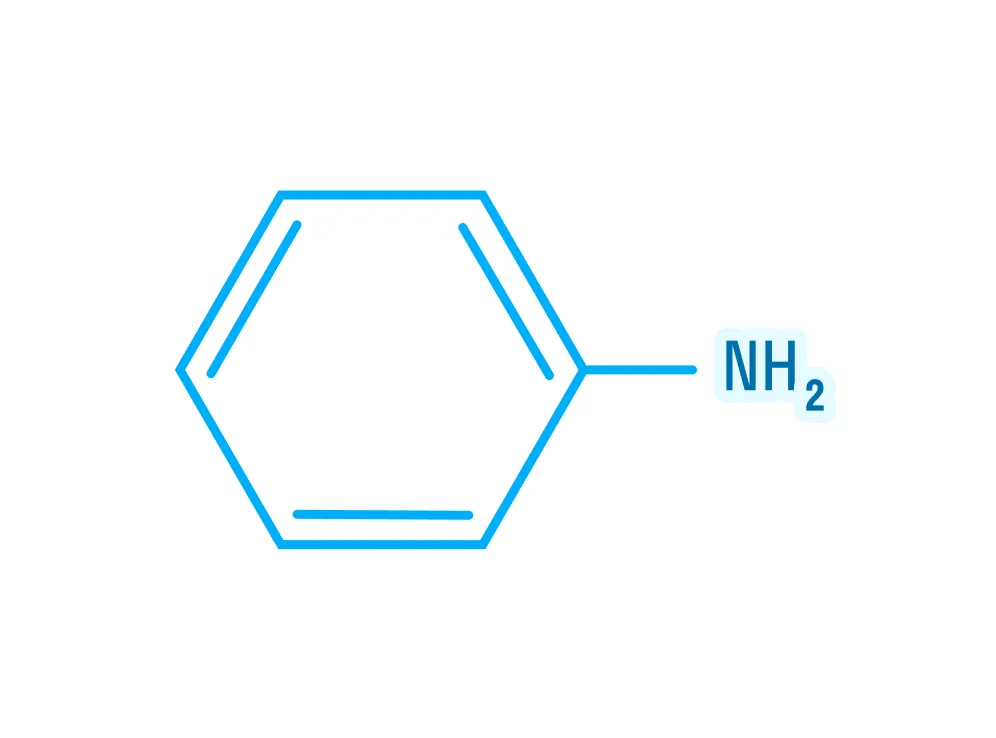
Ароматические амины — анилин
Ароматические амины имеют в составе бензольное кольцо. Простейшим представителем является анилин:
Впервые анилин был получен в 1842 году Н. Н. Зининым, и реакция эта именная — реакция Зинина:
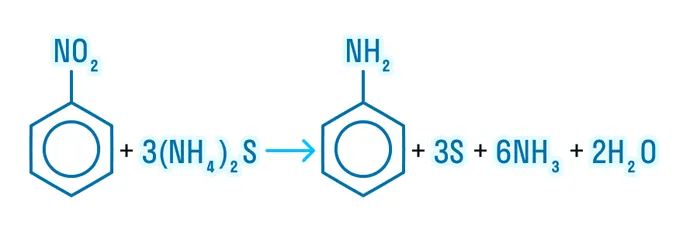
Физические свойства
Анилин является масляной жидкостью, не имеющей цвета, но обладающей характерным запахом. Не растворим в воде. Если долго хранить анилин на воздухе, то он будет окисляться с приобретением красно-бурой окраски.
Химические свойства
За счёт наличия бензольного кольца анилин проявляет менее выраженные основные свойства, нежели другие амины. Для него характерны реакции, протекающие как по аминогруппе, так и по ароматическому кольцу:
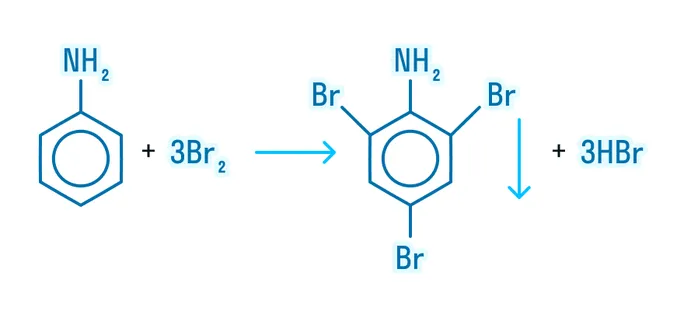
- Взаимодействие с бромной водой — качественная реакция:
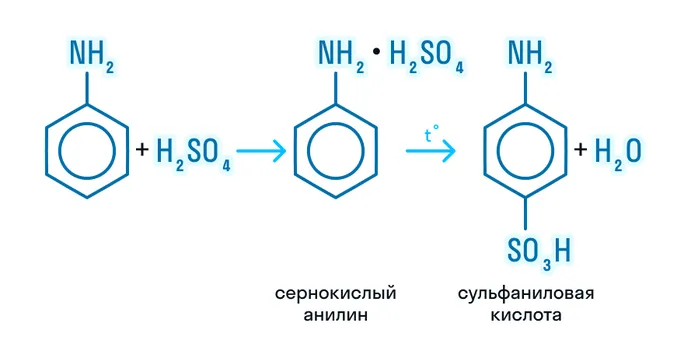
- Сульфирование:
Способы применения всех типов аминов достаточно разнообразны. Амины используются для производства красителей, пластмасс, лекарственных средств, взрывчатых веществ, а также в качестве антиоксидантов и пестицидов.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Аминокислоты
Физические свойства
Аминокислоты — это амфотерные соединения, имеющие в составе как амино-, так и карбоксильную группу.
Обычно они твёрдые, бесцветные и имеют высокие температуры плавления.
Номенклатура
Рассмотрим в таблице, как обычно классифицируют аминокислоты.
|
Признак |
Номенклатура |
Пример |
|
|---|---|---|---|
|
По числу функциональных групп ーNH2 и ーCOOH |
Моноаминокарбоновые |
Систематическая: Положение ーNH2 группы + «амино-» + название углеводородного радикала + «-овая» кислота |
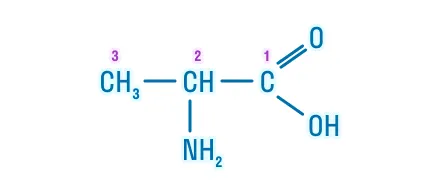 2-аминопропановая кислота |
|
Диаминокарбоновые |
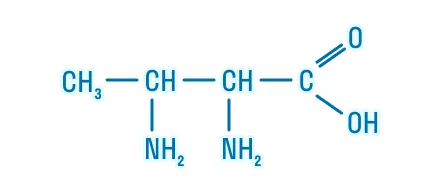 2,3-диаминобутановая кислота |
||
|
Моноаминодикарбоновые |
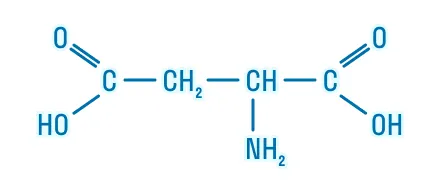 2-аминобутандиовая кислота |
||
|
По положению аминогруппы ーNH2 |
α-аминокислоты |
Рациональная: α/β-атом углерода + «амино-» + углеводородный радикал + «-овая» кислота |
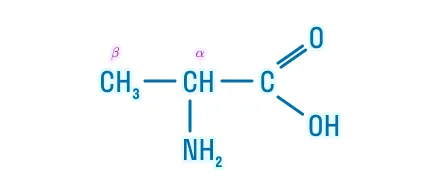 α-аминопропановая кислота |
|
β-аминокислоты |
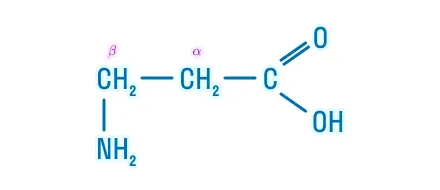 β-аминопропановая кислота |
||
|
По строению углеводородного радикала |
Предельные |
Тривиальная |
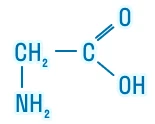 Глицин |
|
Ароматические |
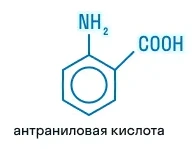 Антраниловая кислота |
||
Важнейшие α-аминокислоты имеют тривиальные названия:
| Формула | Название | Обозначение |
|---|---|---|
| H2N—CH2—COOH | Глицин | Gly (Гли) |
| CH3—CH(NH2)—COOH | Аланин | Ala (Ала) |
| C6H5CH2—CH(NH2)—COOH | Фенилаланин | Phe (Фен) |
| (CH3)2CH—CH(NH2)—COOH | Валин | Val (Вал) |
| (CH3)2CH—CH2—CH(NH2)—COOH | Лейцин | Leu (Лей) |
| HOCH2—CH(NH2)—COOH | Серин | Ser (Сер) |
| H2N—CO—CH2—CH(NH2)—COOH | Аспарагин | Asn (Асн) |
Химические свойства
Из-за наличия двух кардинально разных функциональных групп аминокислоты способны проявлять как основные, так и кислотные свойства. Так ーCOOH группа отвечает за кислотные свойства, а ーNH2 за основные.
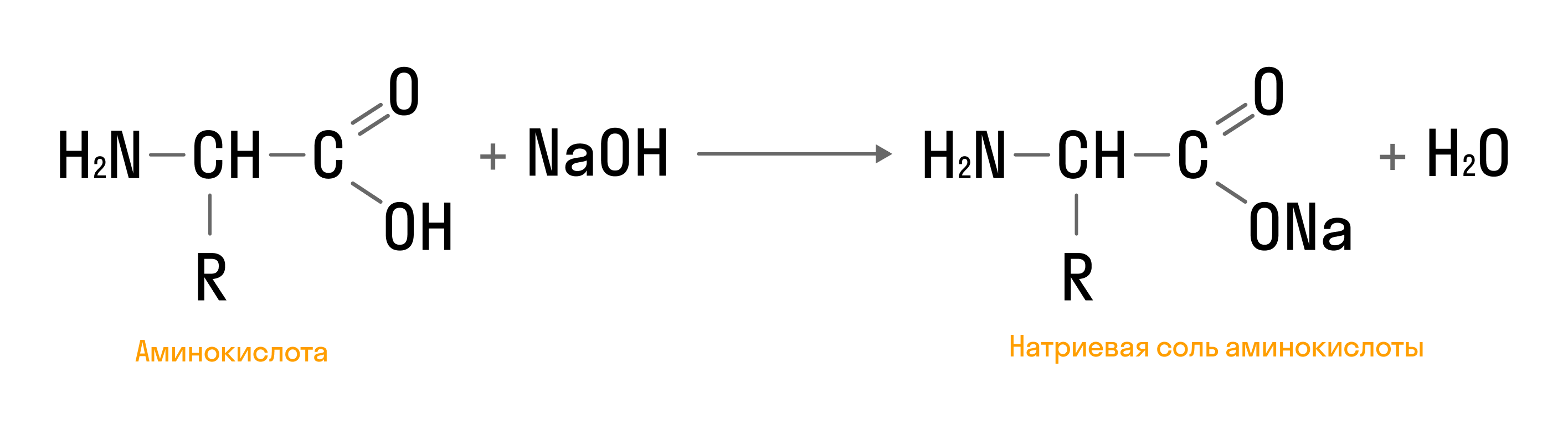
Кислотные свойства
- Взаимодействие с основаниями:
Реакция декарбоксилирования:
H2N—CH(R)—COOH + Ca(OH)2 → H2N—CH2—R + CaCO3 + H2O
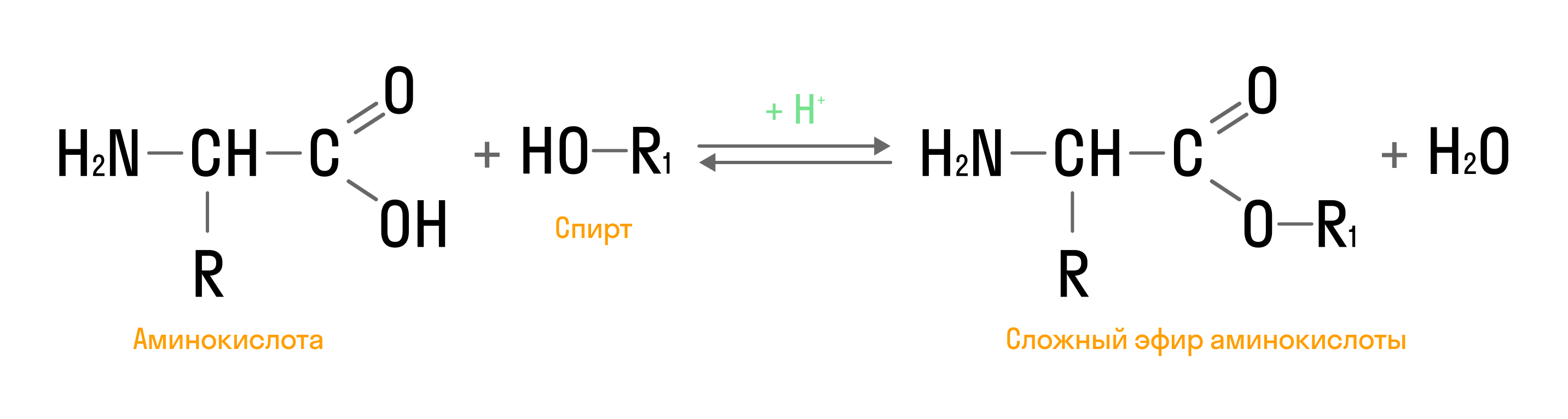
- Реакция этерификации:
Основные свойства
- Взаимодействие с кислотами:
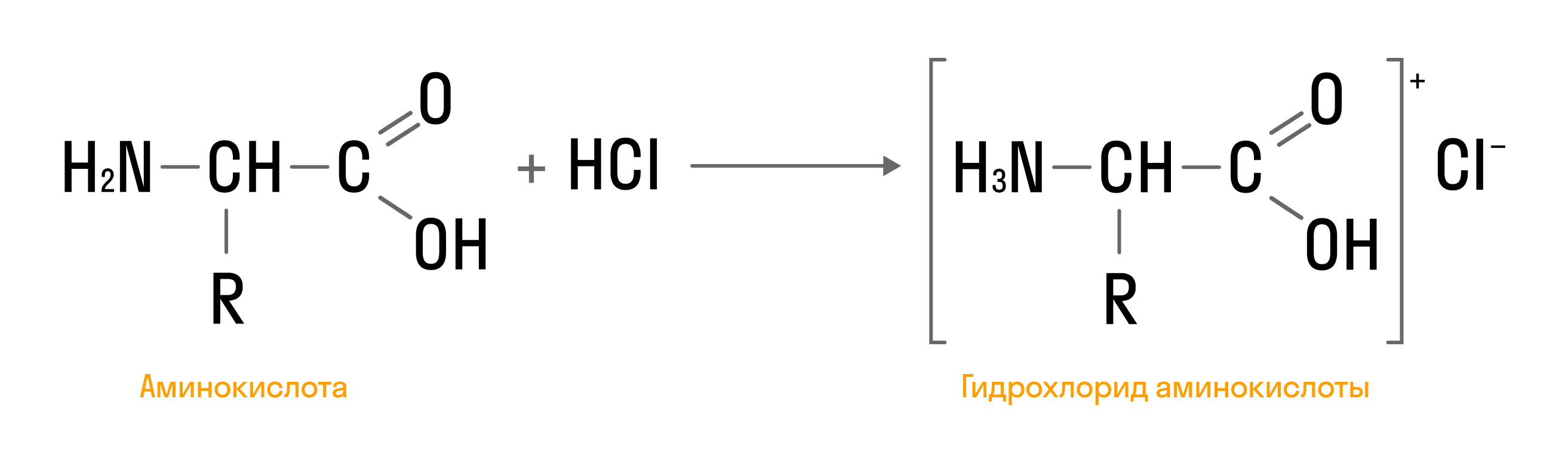
Взаимодействие с азотистой кислотой:
H2N—CH(R)—COOH + HNO2 → HO—CH(R)—COOH + N2 + H2O
Образование пептидов
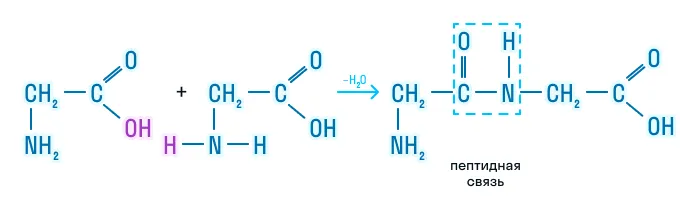
Аминокислоты используются для производства лекарственных препаратов, ПАВов, полиамидных волокон и пищевых добавок. Кроме того, они являются веществами, жизненно необходимыми животным организмам, так как входят в состав белков. В связи с этим незаменимые аминокислоты обязательно должны поступать с пищей.
Белки
Белок — это высокомолекулярный биополимер, мономерами которого являются аминокислоты, образованный за счёт пептидной связи.
Эти молекулы являются жизненно важными для любого животного организма.
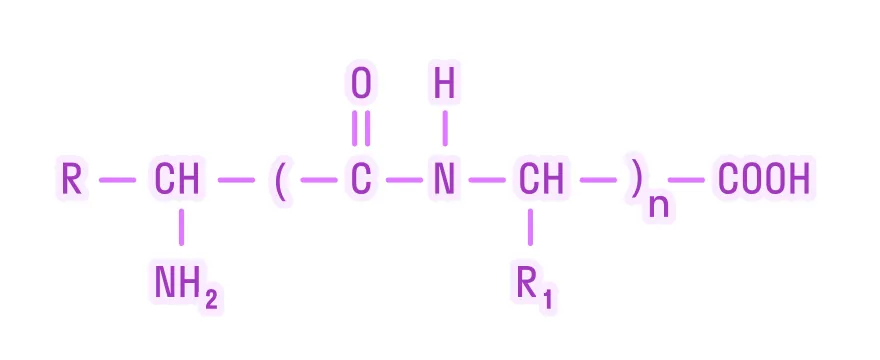
Белки разделяют на 2 группы:
- протеины — простые белки, состоящие исключительно из остатков α-аминокислот;
- протеиды — сложные белки, образующие комплексные соединения с другими органическими молекулами, либо имеющие в своем составе ионы металлов.
Молекулы белков могут быть либо глобулярной (альбумин), либо фибриллярной формы (коллаген). Различают 4 структуры белка, рассмотрим их в таблице.
|
Первичная |
Последовательность аминокислотных остатков, где реализуются пептидные связи |
 |
|---|---|---|
|
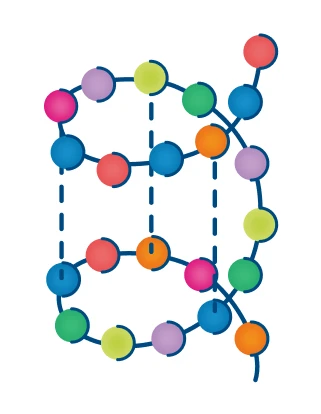
Вторичная |
Спираль, образованная водородными связями между витками |
 |
|
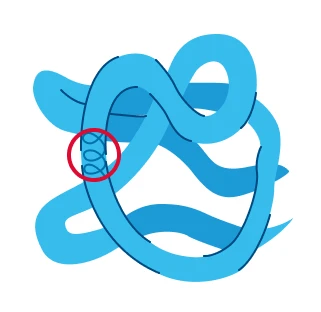
Третичная |
Клубок с реализованными сложноэфирными связями |
 |
|
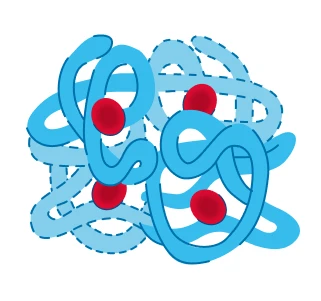
Четвертичная |
Полипептидные цепочки располагаются в пространстве определенным образом, реализованы силы межмолекулярного взаимодействия |
 |
Химические свойства
Химические свойства белков основаны на их амфотерности. Как и аминокислоты, белки содержат 2 функциональные группы: ーNH2 и ーCOOH.
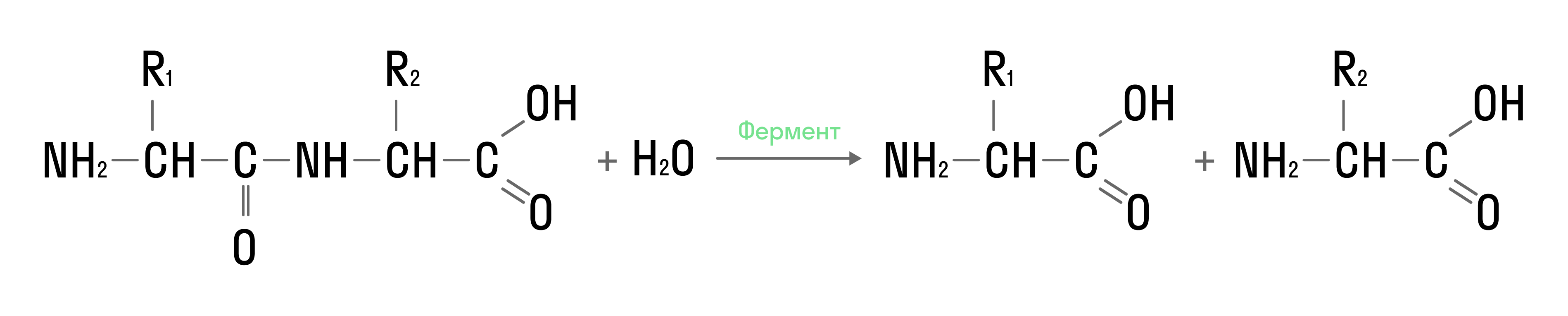
Гидролиз белков
В щелочной или кислой среде белки распадаются на аминокислоты:
Денатурация белка
Разрушение вторичной и третичной структуры под воздействием кислот, щелочей, солей тяжёлых металлов, температуры или радиации.
-
- Биуретова реакция (на пептидную связь);
- Ксантопротеиновая реакция (на бензольное кольцо);
- Цистеиновая реакция (на серосодержащие аминокислоты).
Значение белков сложно переоценить, так как функции их многообразны. Так, белки-ферменты выступают в роли катализаторов обмена веществ, мышечных сокращений. Структурные белки являются основной составляющей соединительной и костной тканей. Белки-переносчики транспортируют липиды, ионы и сахара. В полной мере функции белков описаны в соответствующей статье.
Азотсодержащие гетероциклы
Гетероциклические соединения — это огромный пласт веществ в органике. Обычно циклы включают от 3 до 6 атомов углерода и гетероатомы — кислород, серу или азот. Наиболее часто встречаются циклы, содержащие азот, и они же имеют большое значение для живых организмов.
В молекулах азотсодержащих гетероциклов атом азота связан с атомами углерода аналогично тому, как это происходит в аминах.
Пиридин
Замена одного атома углерода на атом азота в молекуле бензола приводит к образованию молекулы пиридина — ароматического гетероцикла:
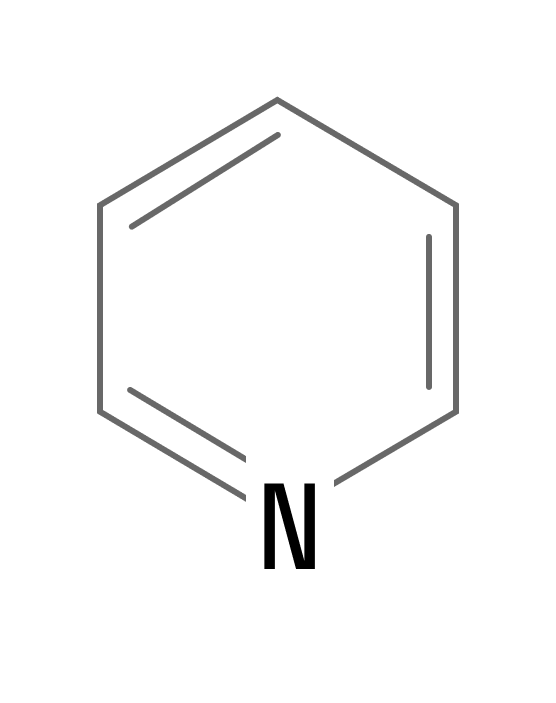
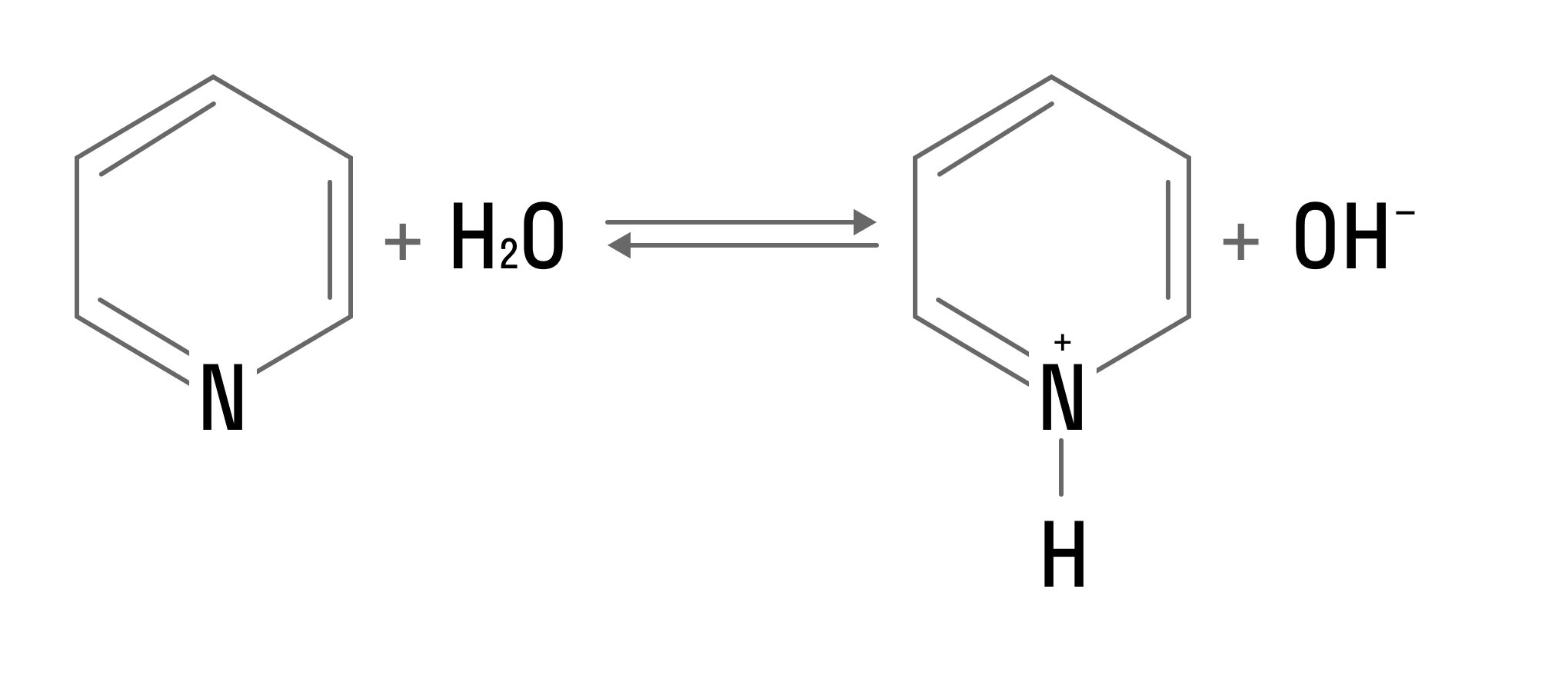
Пиридин — бесцветная жидкость с резким неприятным запахом. Проявляет основные свойства:
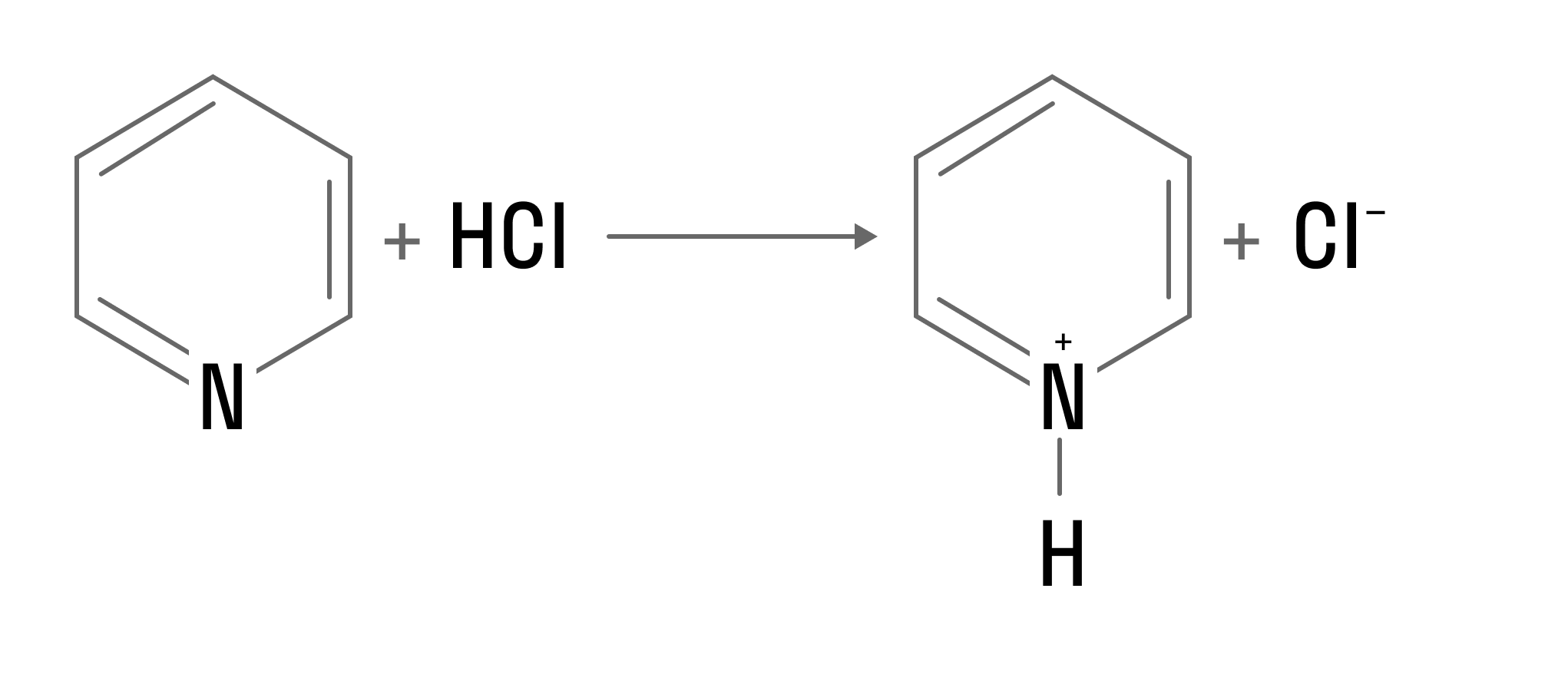
Может взаимодействовать с сильными кислотами с образованием солей:
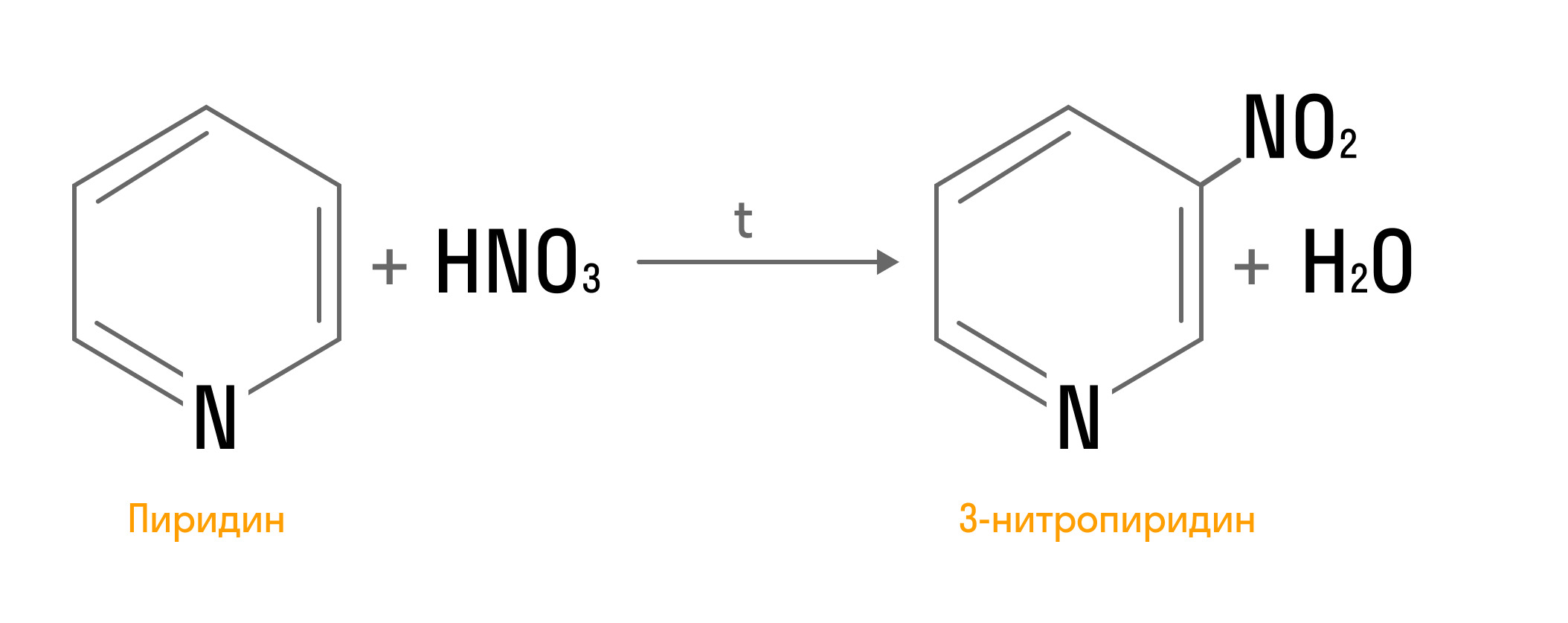
Наличие системы сопряженных двойных связей дает возможность вступать в реакции электрофильного замещения:
А ещё, в отличии от бензола, пиридин вступает в реакции нуклеофильного замещения:
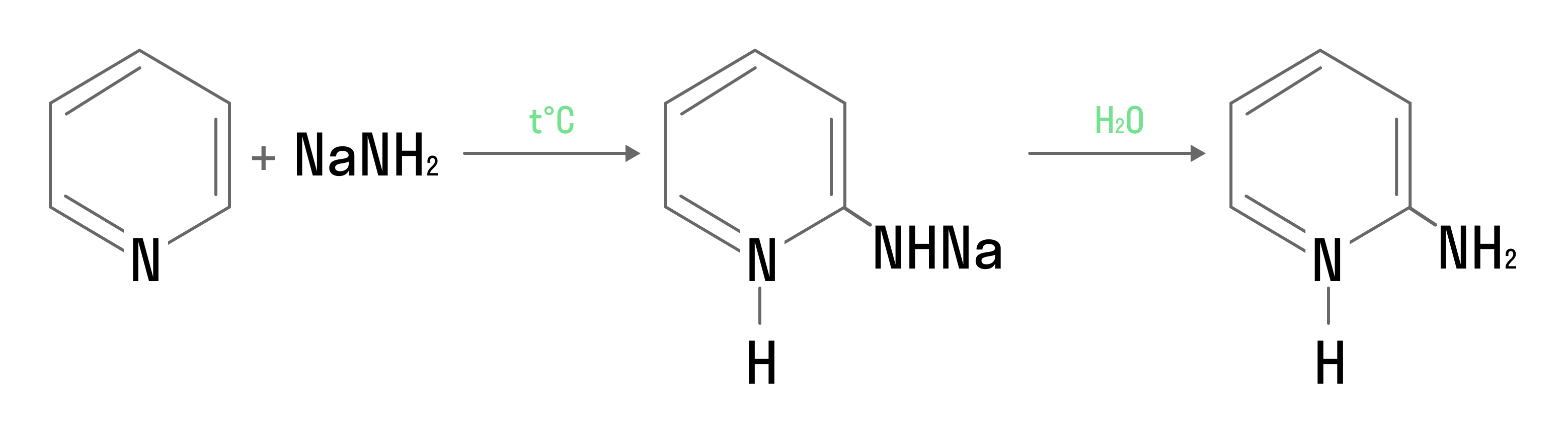
Гидрирование пиридина приводит к образованию циклического вторичного амина:
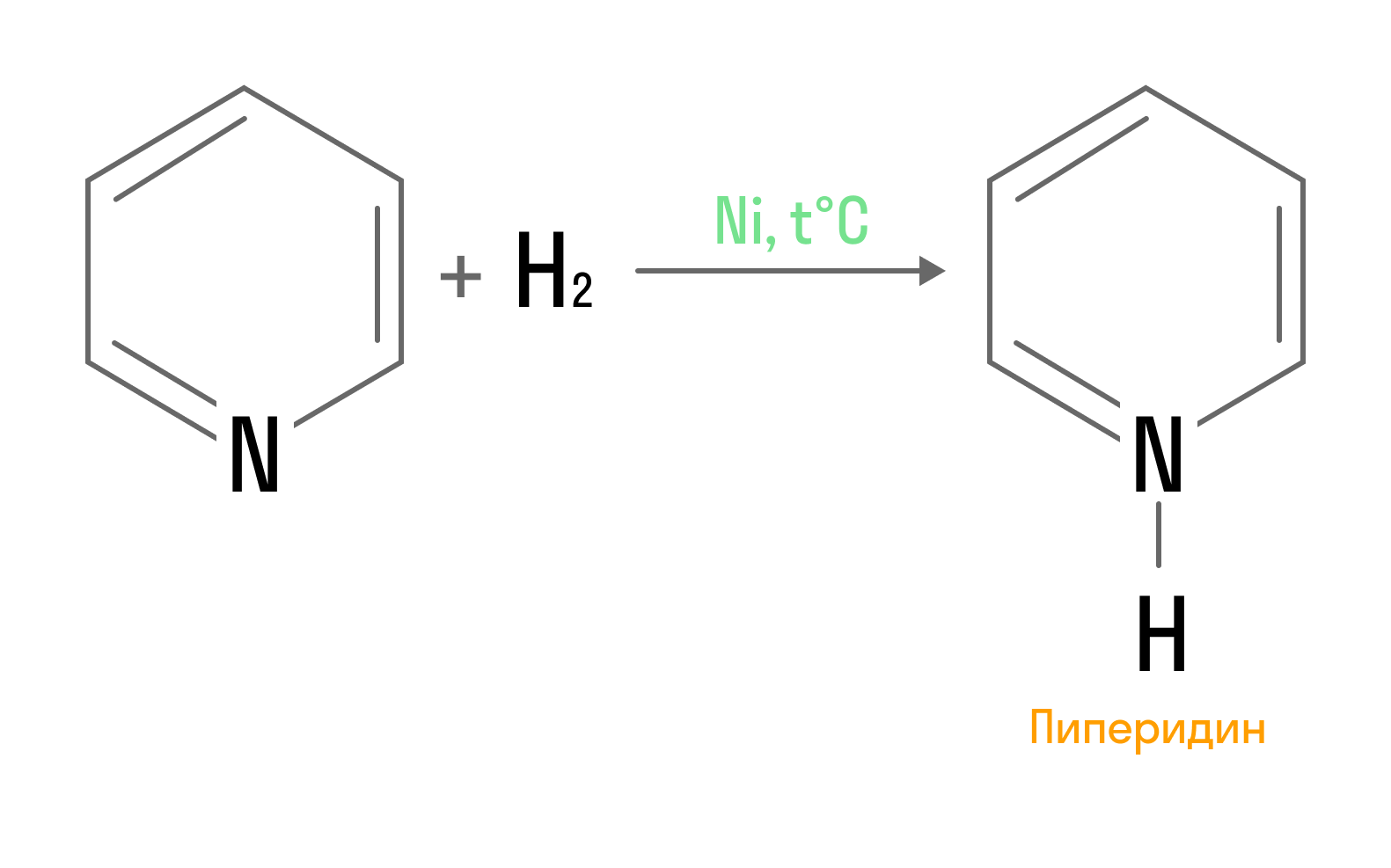
Гомологи пиридина проявляют свойства аналогично гомологам бензола.
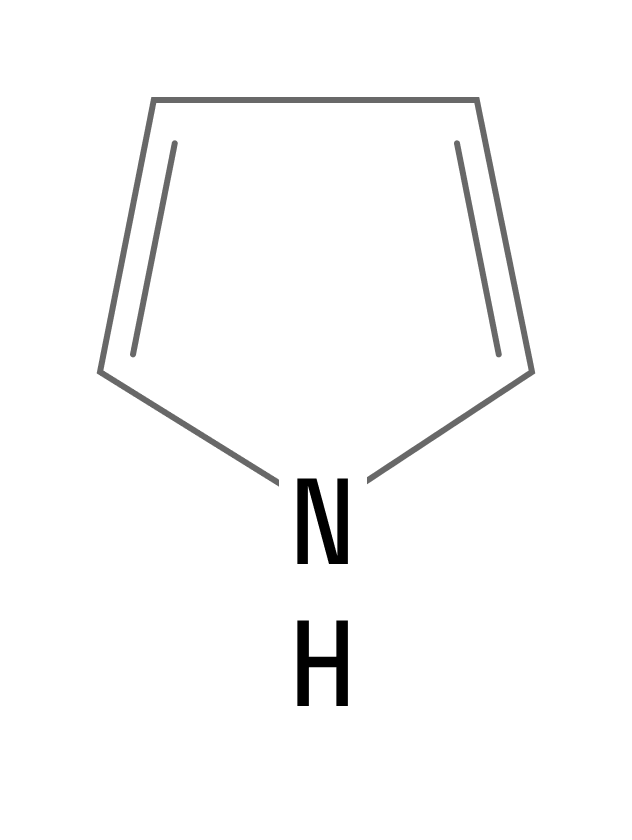
Пиррол
Пятичленный цикл, содержащий атом азота, называется пиррол. Это бесцветная жидкость, плохо растворимая в воде.
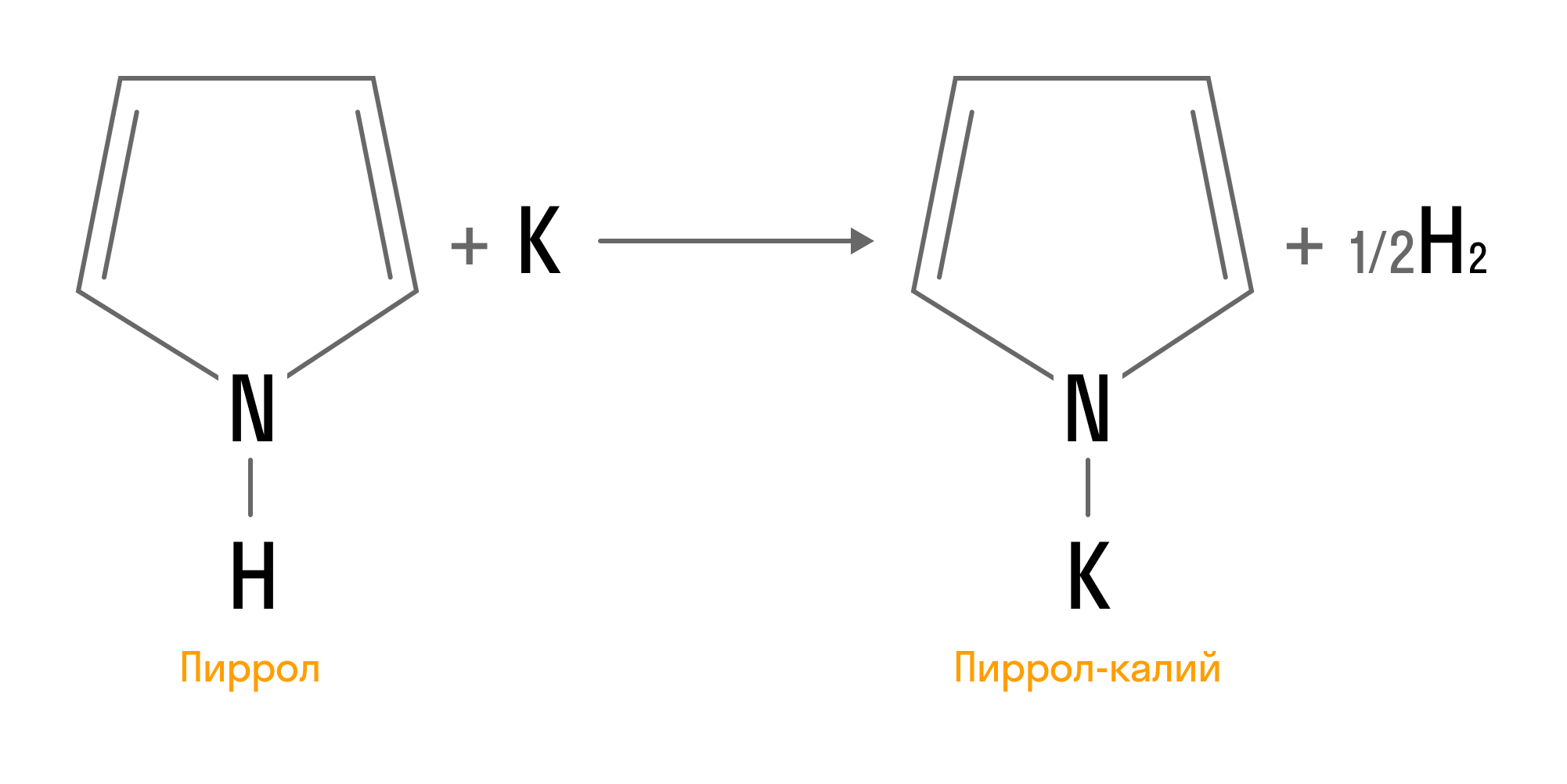
Атом водорода, связанный с атомом азота, может замещаться металлом, что приводит к проявлению слабых кислотных свойств у пиррола. В результате реакции с щелочными металлами образуются соответствующие соли:
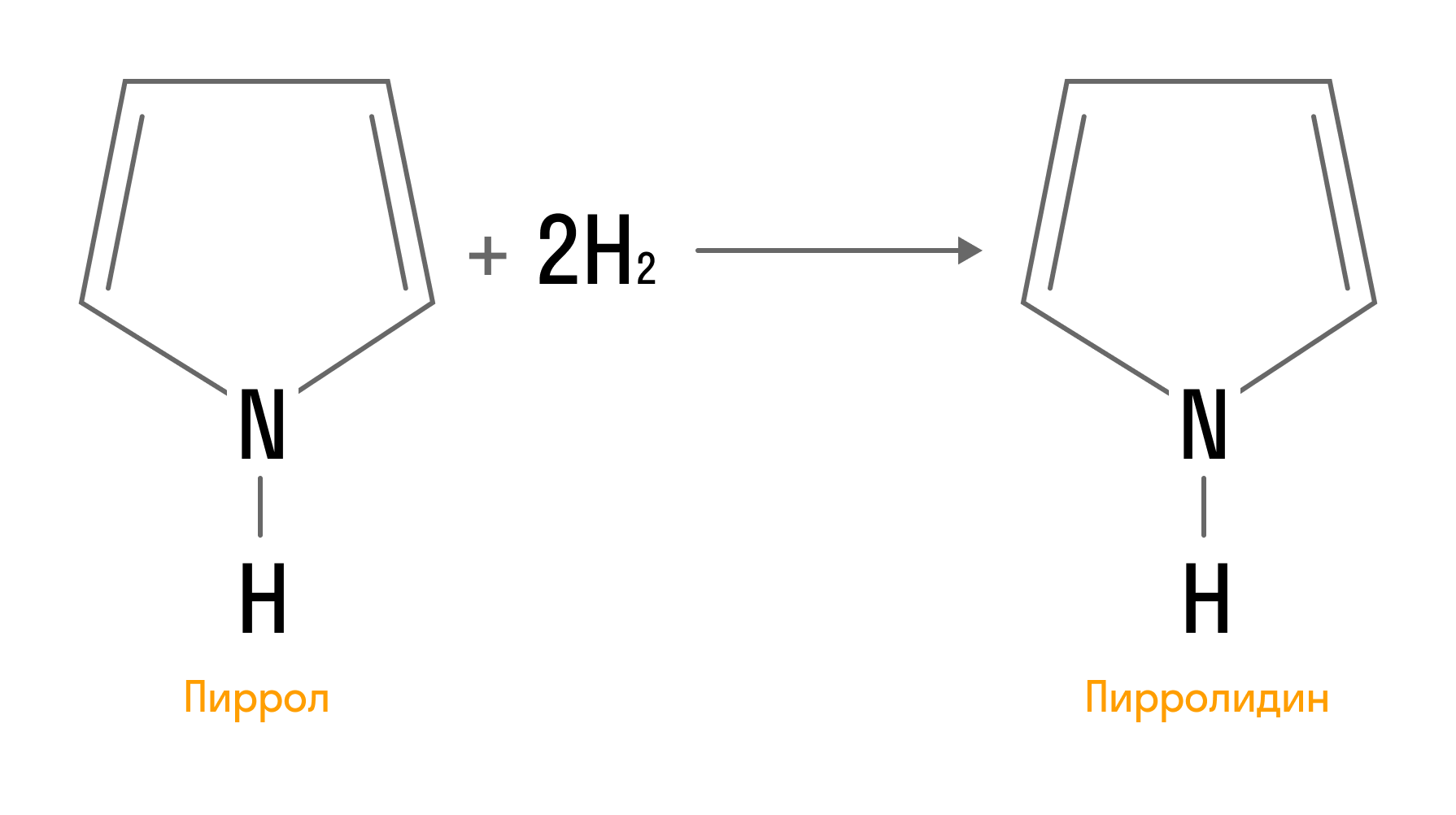
При гидрировании из пиррола образуется пирролидин:
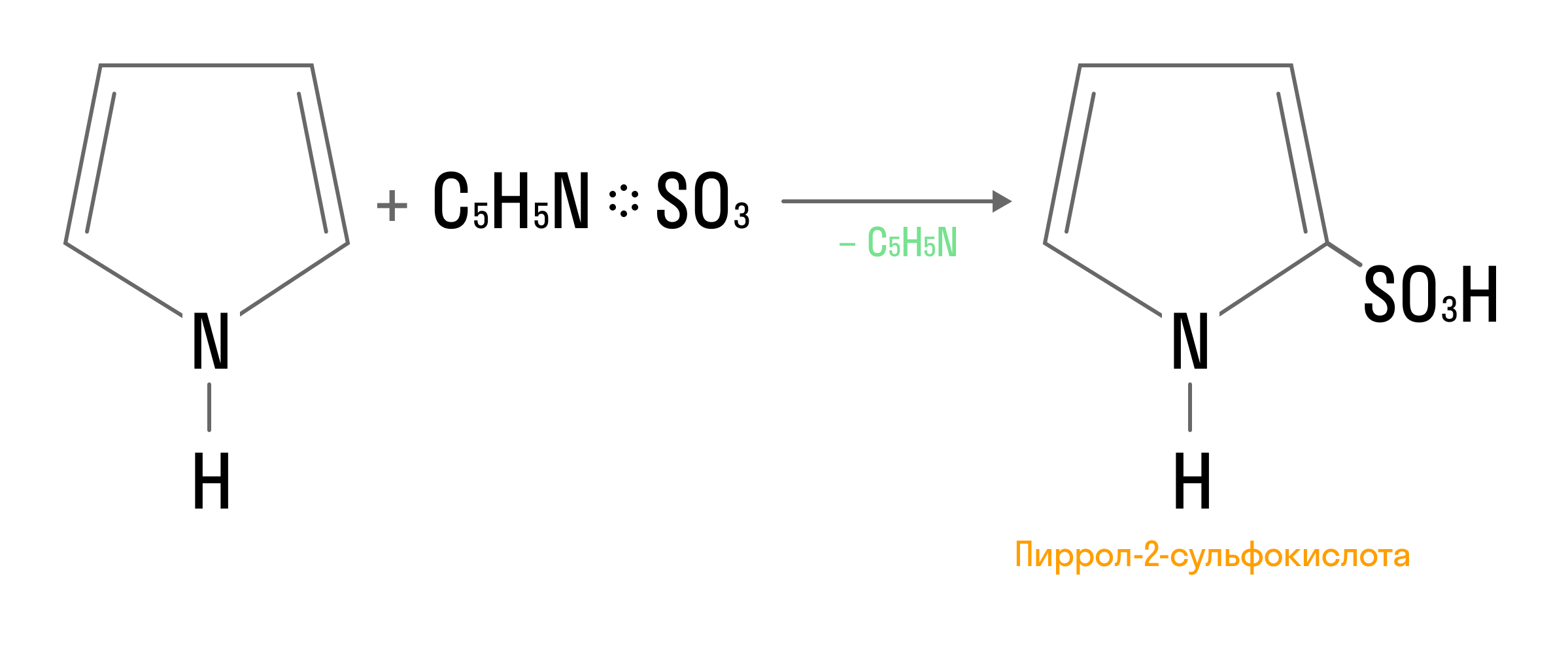
Также пиррол способен вступать в реакции нитрования, сульфирования и другие варианты электрофильного замещения:
Индол
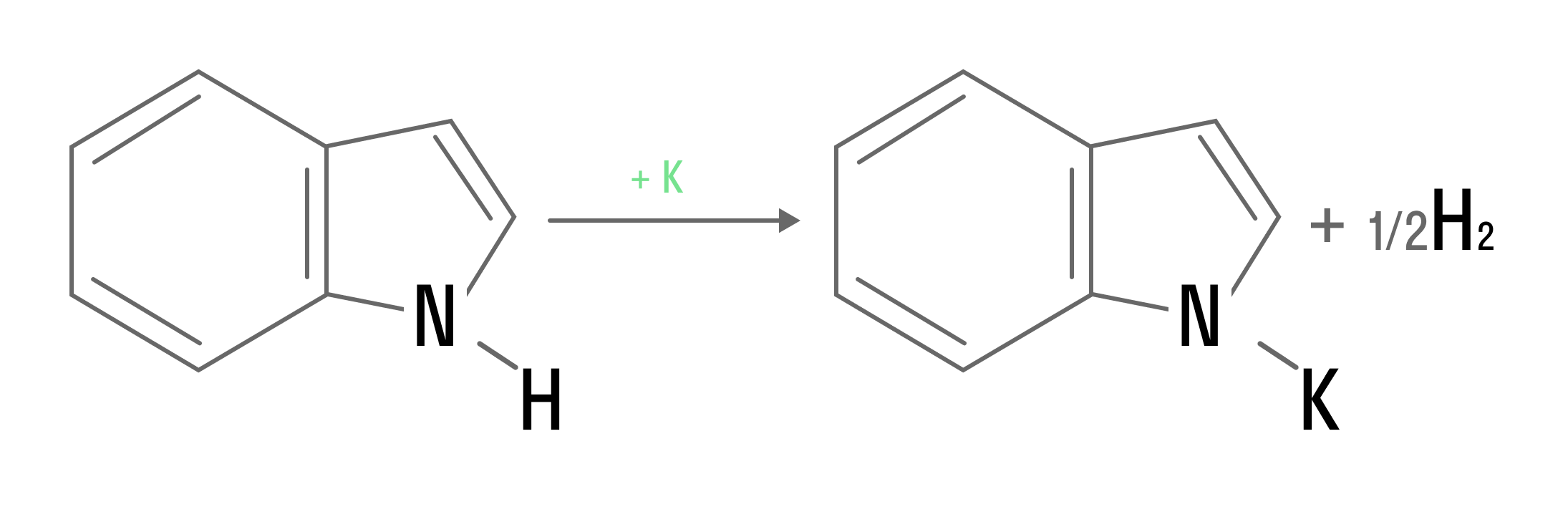
Соединение, включающее бензольное ядро и пиррольный гетероцикл, называется индол (бензопиррол). Это вещество проявляет амфотерные свойства.
Взаимодействие с активными металлами происходит по пиррольной части:
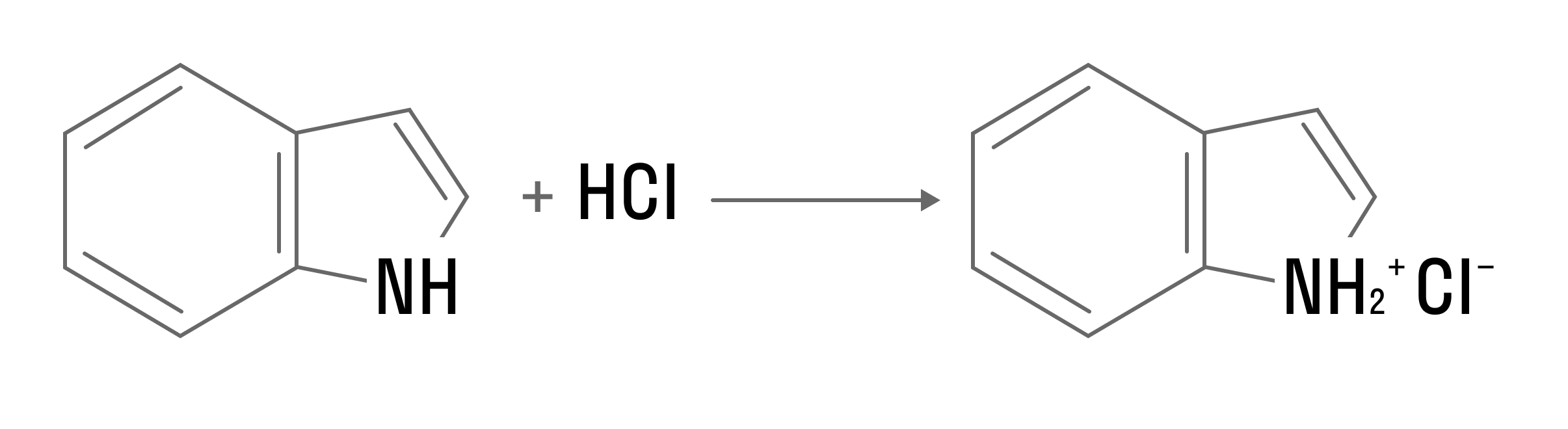
В реакциях с кислотами образуются соли:
Индол вступает в реакции электрофильного замещения:
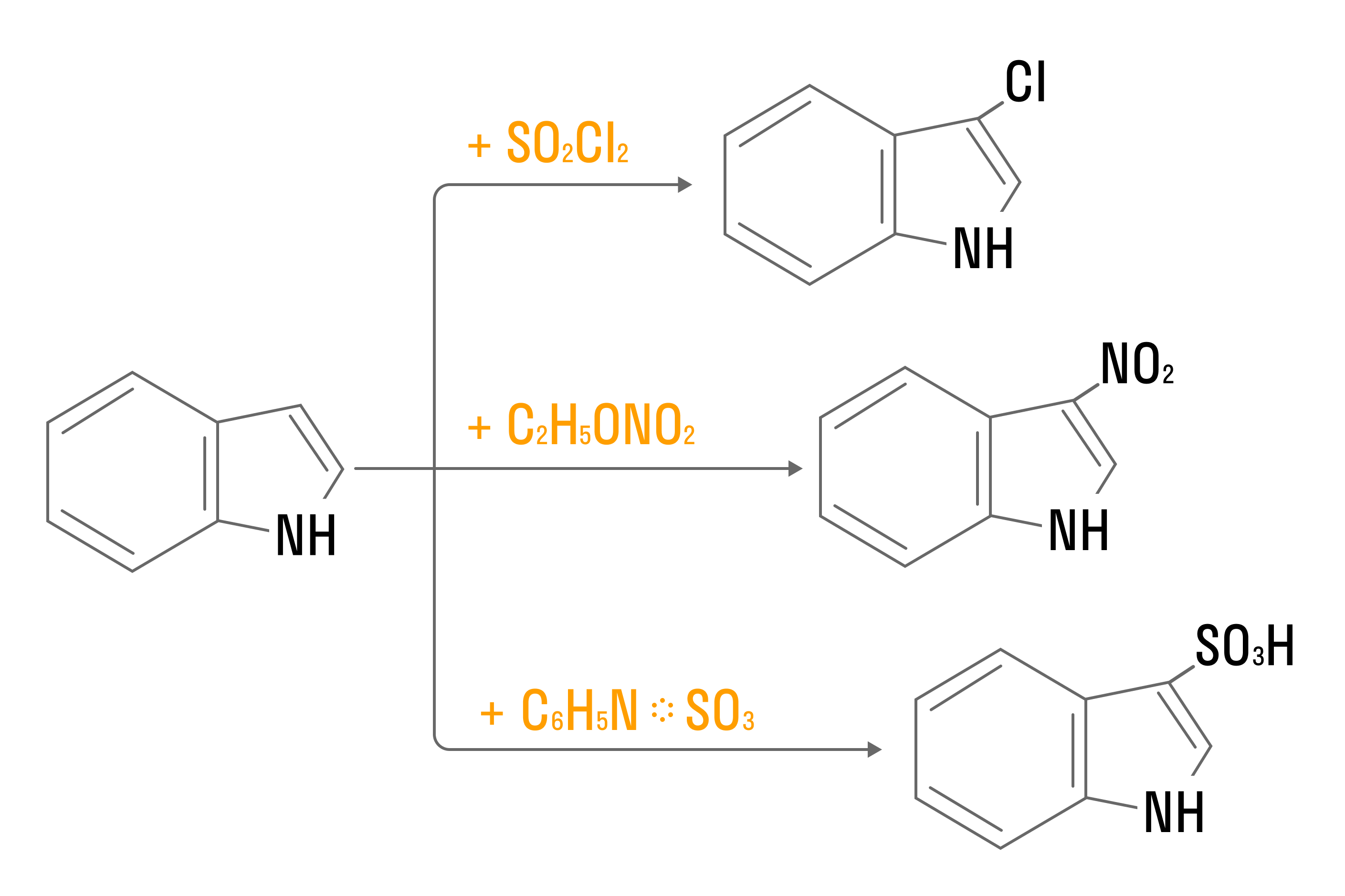
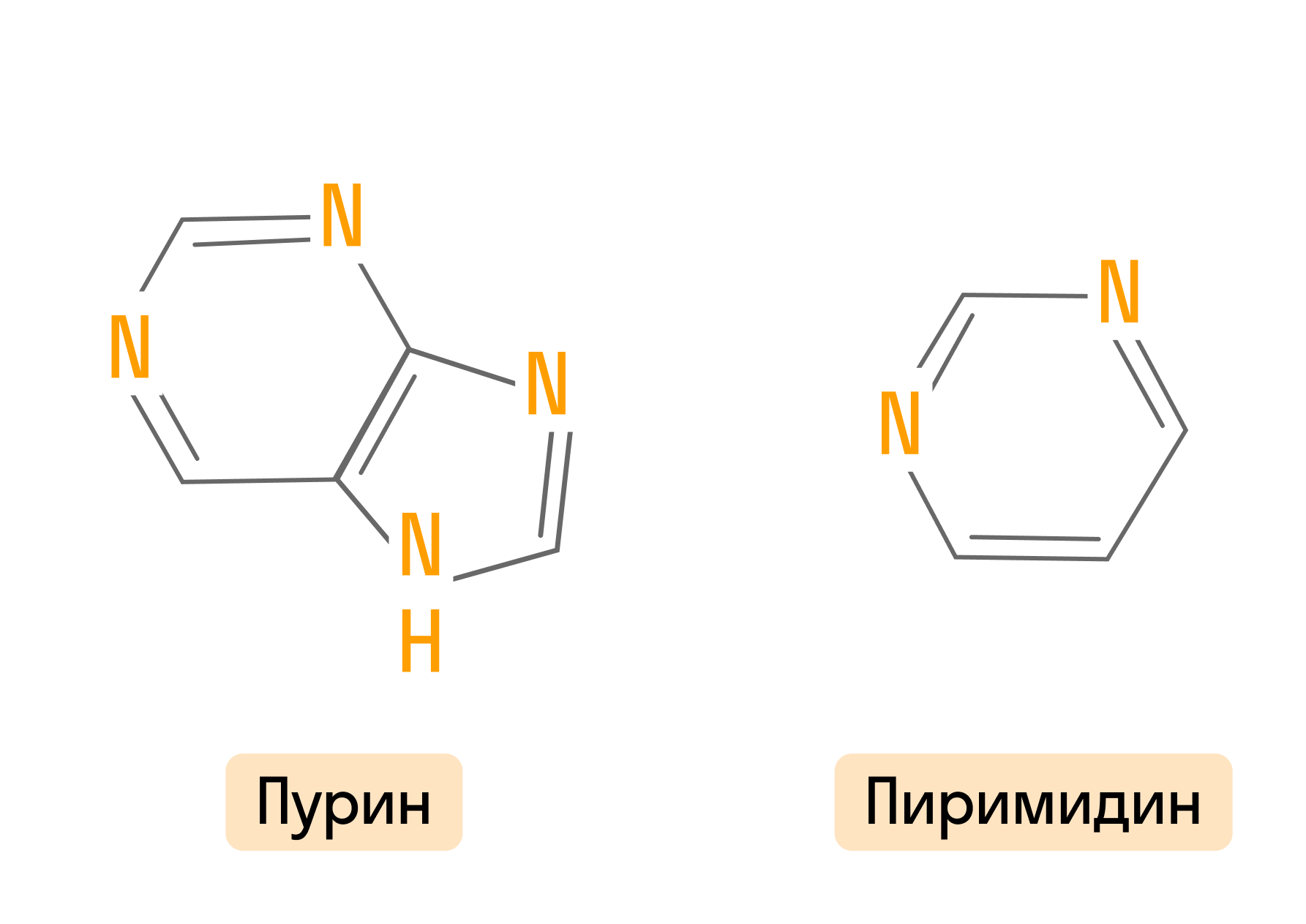
Часто встречаются гетероциклы, в состав которых входит 2 и более атомов азота. Самые значимые из них — это пурин, пиримидин и их производные, входящие в состав нуклеиновых кислот.
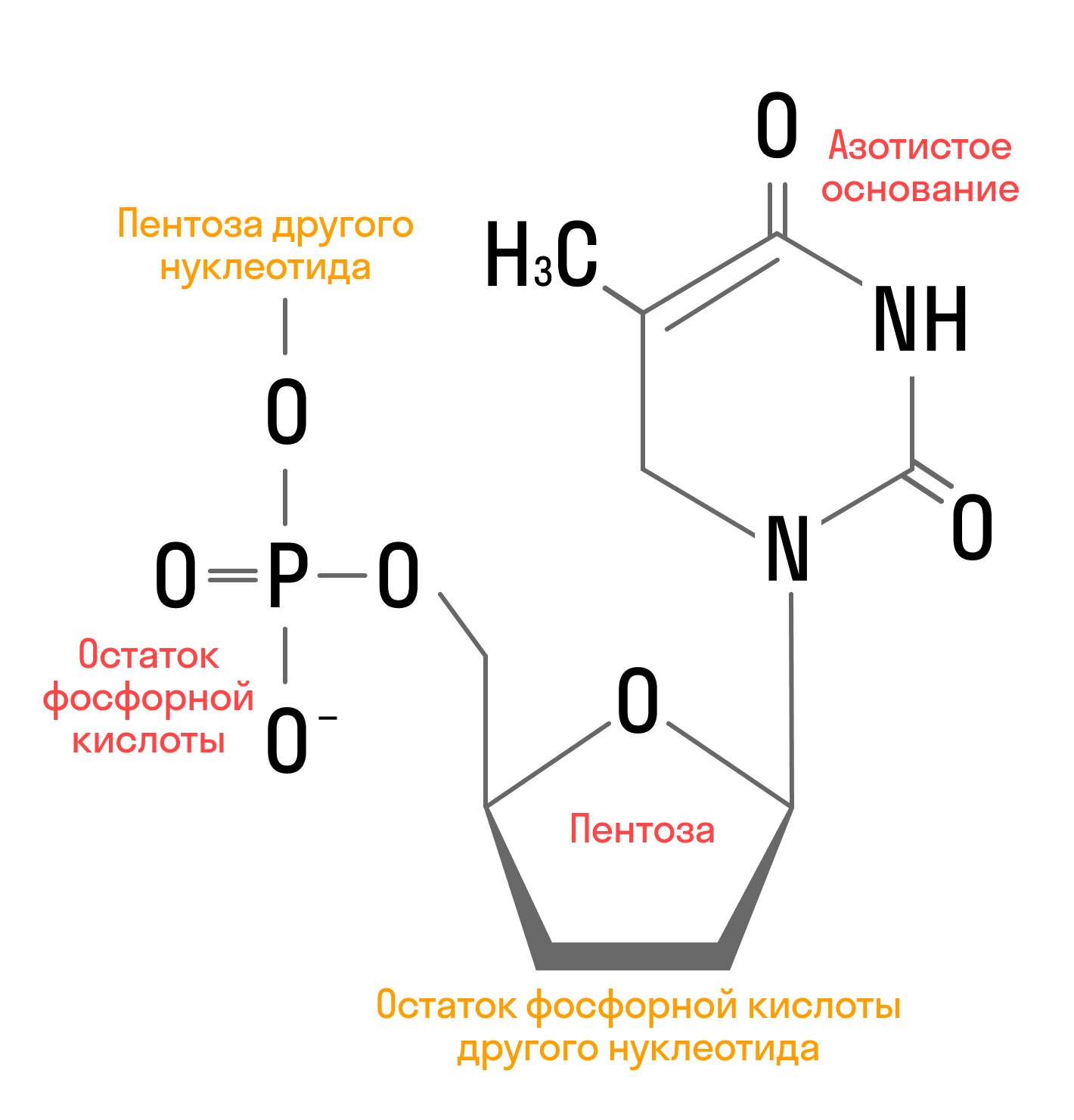
Нуклеиновые кислоты
Нуклеиновые кислоты представляют собой сложные биополимеры, последовательность нуклеотидов, присутствующие во всех клетках живого организма и служащие носителями наследственной информации. Структура нуклеотида выглядит так:
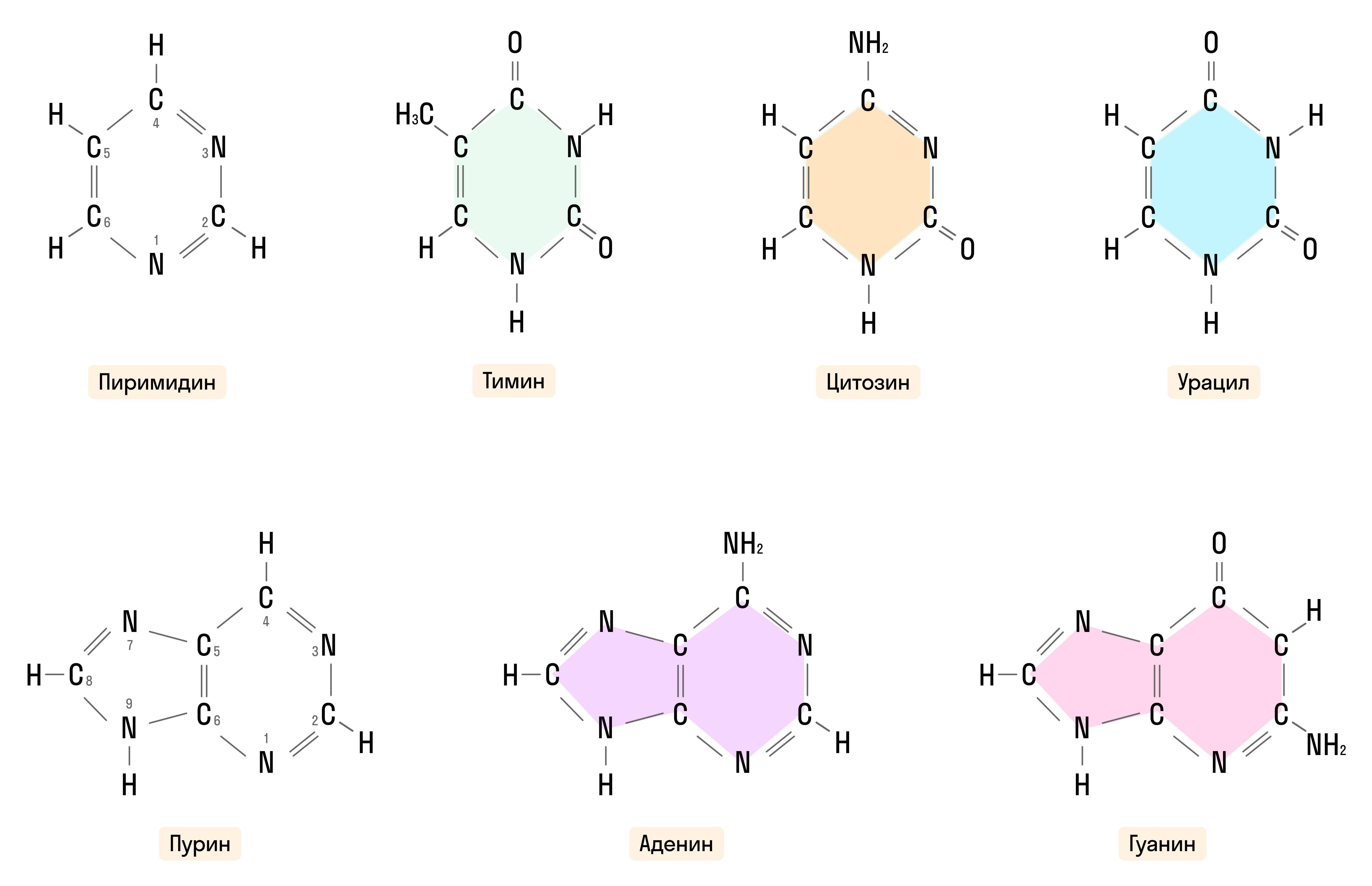
Азотистые основания — производные пурина и пиримидина, о которых мы рассказали выше, входящие в состав нуклеиновых кислот:
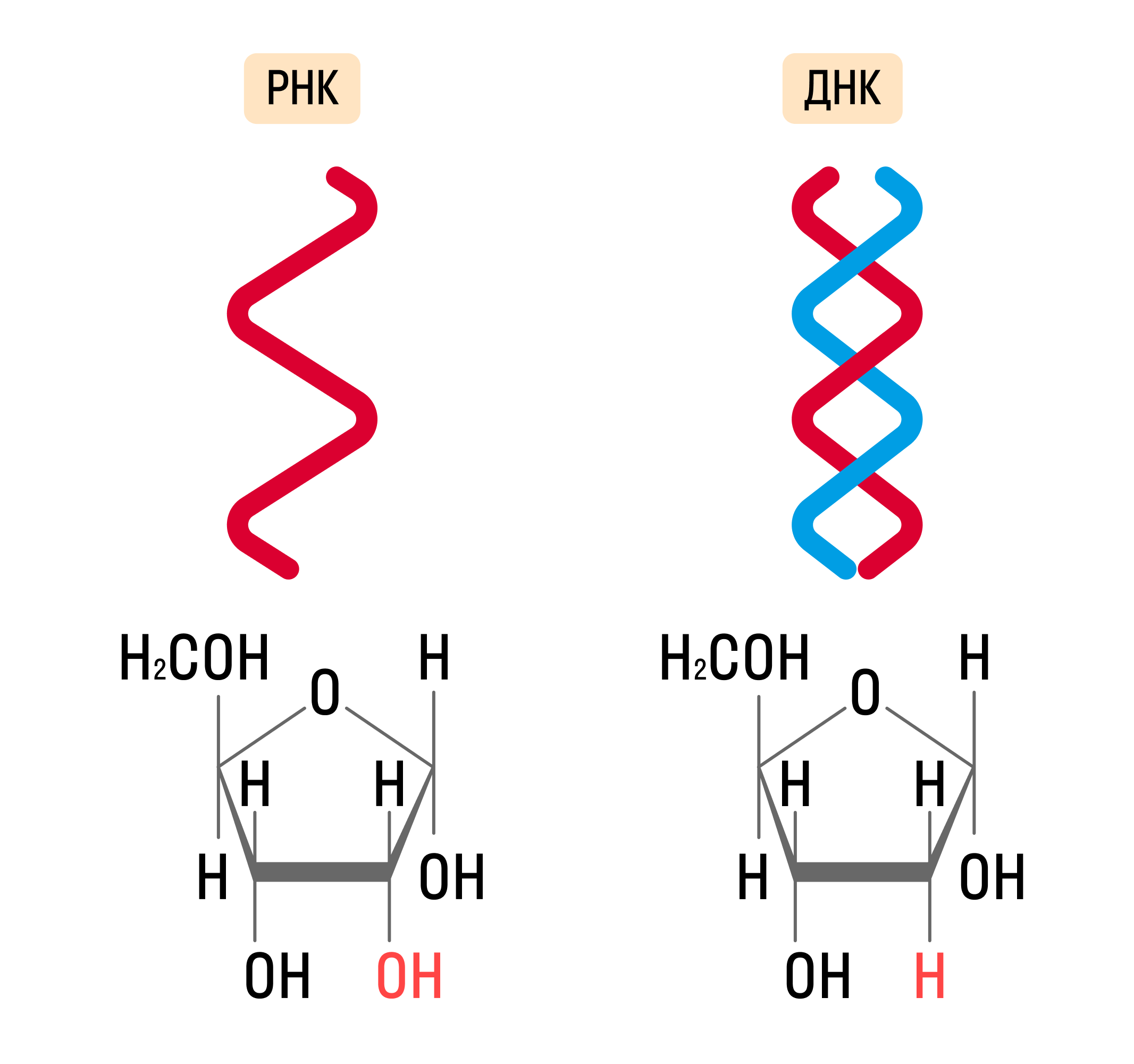
Существует 2 типа нуклеиновых кислот, отличающихся углеводом, входящим в их состав:
- РНК — рибонуклеиновая кислота, содержит рибозу, построена одной нуклеотидной цепью;
- ДНК — дезоксирибонуклеиновая кислота, содержащая дезоксирибозу, состоит из двух нуклеотидных цепей, соединенных по принципу комплементарности.
Ещё больше теории простыми словами по этой теме — на курсе подготовки к ЕГЭ по химии в Skysmart. Присоединяйтесь!