Сложные вещества — это вещества, образованные атомами различных химических элементов. Например, вода (H₂O) состоит из двух атомов водорода и одного атома кислорода, метан (CH₄) — из одного атома углерода и четырех атомов водорода. К сложным веществам относятся как органические (глюкоза C₆H₁₂O₆), так и неорганические соединения (серная кислота H₂SO₄, углекислый газ CO₂).
- Органические соединения: глюкоза (C₆H₁₂O₆)
- Неорганические соединения:
- серная кислота (H₂SO₄)
- углекислый газ (CO₂)
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Для кого эта статья:
- школьники и студенты, изучающие химию
- любая аудитория, интересующаяся основами химических веществ
- учителя и преподаватели химии для подготовки учебных материалов
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента |
Характеристика простого вещества |
|---|---|
|
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
|
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.

Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
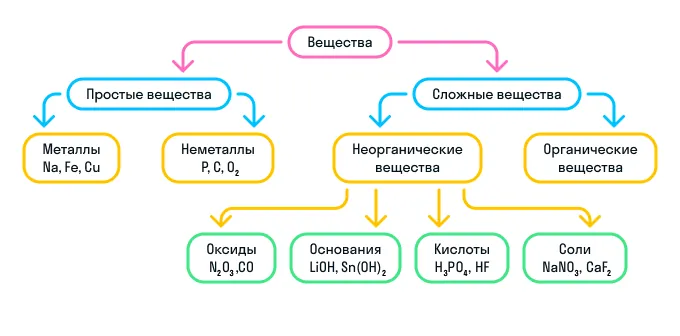
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Например: Na2O, CaO, P2O5.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Например: KOH, Fe(OH)3, Ni(OH)2.
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Например: HNO3, HCl, H3PO4.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Например: NaCl, CaCO3, K2SO4.
Один из видов сложных веществ — основания. Об основаниях в химии мы писали в соответствующей статье.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
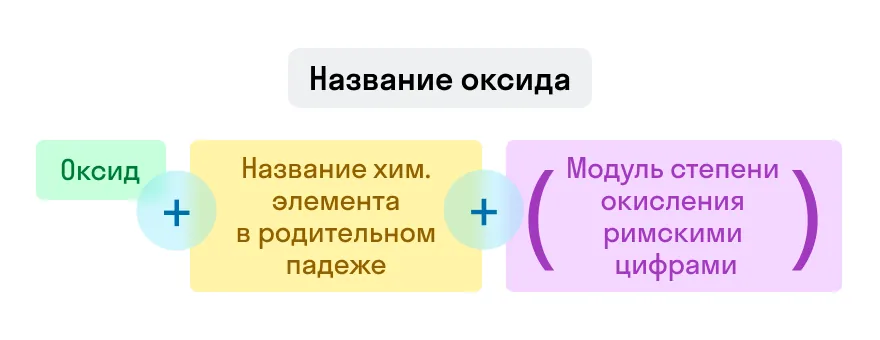
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
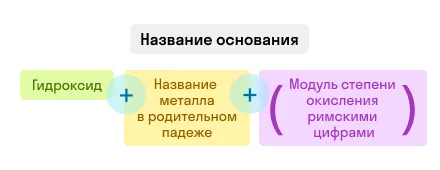
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
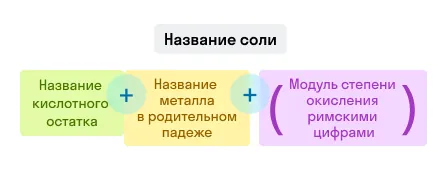
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Формула кислоты |
Название кислоты |
Формула кислотного остатка |
Название кислотного остатка |
|---|---|---|---|
HF |
Фтороводород, плавиковая |
F− |
Фторид |
HCl |
Хлороводород, соляная |
Cl− |
Хлорид |
HBr |
Бромоводород |
I− |
Йодид |
H2S |
Сероводород |
S2− |
Сульфид |
HCN |
Циановодородная |
CN− |
Цианид |
HNO2 |
Азотистая |
NO2− |
Нитрит |
HNO2 |
Азотная |
NO3− |
Нитрат |
H3PO4 |
Ортофосфорная |
PO43− |
Фосфат |
H3AsO4 |
Мышьяковая |
AsO43− |
Арсенат |
H2SO4 |
Сернистая |
SO32− |
Сульфит |
H2SO4 |
Серная |
SO42− |
Сульфат |
H2CO3 |
Угольная |
CO32− |
Карбонат |
H2SiO3 |
Кремниевая |
SiO32− |
Силикат |
H2CrO4 |
Хромовая |
CrO42− |
Хромат |
H2Cr2O7 |
Дихромовая |
Cr4O72− |
Дихромат |
HMnO2 |
Марганцовая |
MnO4− |
Перманганат |
HClO |
Хлорноватистая |
ClO− |
Гипохлорит |
HClO2 |
Хлористая |
ClO2− |
Хлорит |
HClO3 |
Хлорноватая |
ClO3− |
Хлорат |
HClO4 |
Хлорная |
ClO4− |
Перхлорат |
HCOOH |
Метановая, муравьиная |
HCOO− |
Формиат |
CH3COOH |
Этановая, уксусная |
CH3COO− |
Ацетат |
H3C2O4 |
Этандиовая, щавелевая |
C2O4− |
Оксалат |
Знать свойства и строение простых и сложных веществ важно не только на экзамене, но и в жизни. Поэтому на курсах подготовки к ОГЭ по химии в онлайн-школе Skysmart мы разбираем много реальных примеров, смотрим опыты и учимся применять полученные знания в быту.
Один из важных аспектов при изучении химических веществ — понимание их состава и пропорций компонентов. Для этого вам потребуется формула массовой доли.


















