Массовая доля - это отношение массы компонента к общей массе смеси или вещества.
Формула для расчёта массовой доли вещества: w(вещества) = m(вещества) / m(смеси) * 100%.
Например, массовая доля соли в соляном растворе может быть определена путём деления массы соли на массу раствора и умножением на 100%.
Для кого эта статья:
- студенты и школьники, изучающие химию
- профессиональные химики и исследователи
- люди, интересующиеся практическими применениями химических расчетов
Что такое массовая доля
Начнем с примера: допустим, мы приготовили два раствора соли. Первый имеет массу 400 г и для него использовано 100 г соли. Масса второго 900 г и для него использовали 90 г соли. Какой раствор будет более концентрированным? Чтобы это понять, нужно выяснить процент соли в каждом растворе. Можно сказать иначе — нужно определить, какую долю в растворе занимает соль.
Массовая доля — это отношение растворенного вещества к массе раствора. Она может измеряться в процентах (от 0 до 100%) или в долях от единицы (от 0 до 1).
Как найти массовую долю растворенного вещества, расскажет формула:
где
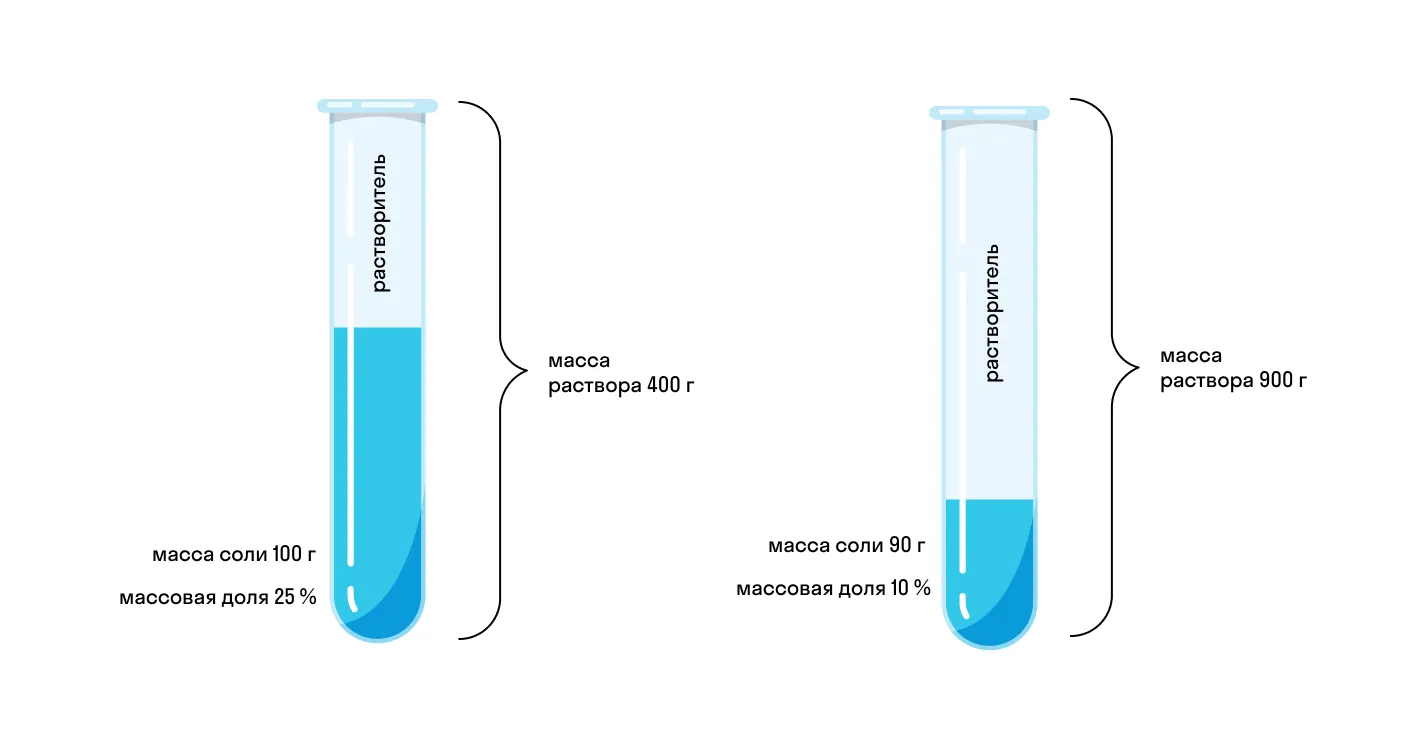
В нашем примере и без формул понятно, что в первом растворе соль занимает 25%, а в то втором — только 10%. А что будет, если в первый раствор добавить еще столько же соли и воды? Очевидно, что на концентрацию это не повлияет. Доля соли останется прежней, пусть даже масса раствора увеличилась.
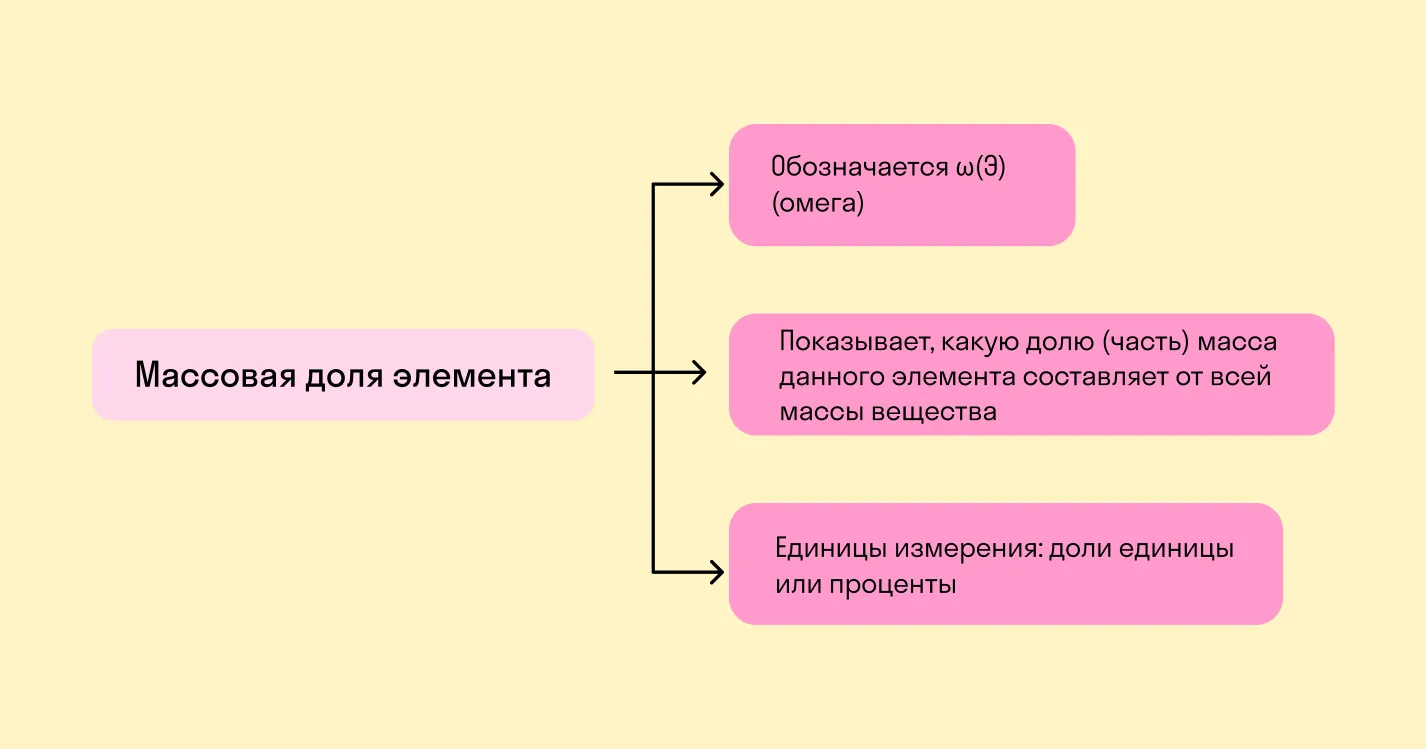
Массовая доля химического элемента — это отношение между относительной массой его атомов и относительной молекулярной массой соединения, частью которого является данный элемент.
Как видите, фактическая масса сложного вещества или его отдельного компонента не имеет значения. Если мы не знаем этих показателей, для расчетов берутся относительные величины.
Такое определение массовой доли элемента выражается формулой:
В данном случае:
Если нужен показатель в процентах, результат надо умножить на 100%.

Относительная атомная и молекулярная масса
В формуле нахождения массовой доли мы видим две важные составляющие: относительную массу атома элемента (Ar) и относительную массу молекулы вещества (Mr). Разберемся, что это такое. И та, и другая величина — это отношение реальной массы к эталонной единице, за которую взята 1/12 массы атома углерода.
Относительная атомная масса элемента (Ar) говорит о том, насколько масса его атома больше 1/12 массы атома углерода. Для каждого элемента эта величина является постоянной и ее можно увидеть в таблице Менделеева.
Относительная молекулярная масса соединения (Mr) складывается из относительных атомных масс всех элементов в составе его молекулы. Она показывает, насколько молекула вещества больше 1/12 массы атома углерода.
Это не измеряемые величины, то есть они не имеют единиц измерения. Буква r в обозначениях относительной атомной и молекулярной массы восходит к английскому слову relative — «относительный».
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Как найти массовую долю элемента в веществе
Выше мы рассмотрели формулу для вычисления массовой доли химического элемента в веществе и узнали, откуда берутся ее составляющие. Применим эти знания на практике.
Пример 1
Оксид магния массой 8 г образовался при вступлении 4,8 г магния в реакцию с кислородом. Каковы массовые доли магния и кислорода в полученном оксиде?
Решение:
Для начала вычислим массу кислорода. Согласно закону сохранения массы веществ в соединении можно воспользоваться формулой m(O) = m(MgO) − m(Mg).
m(O) = 8 − 4,8 = 3,2 г
Вспоминаем, как найти массовую долю элемента в веществе: нужно понять, какую часть соединения оно составляет.
Зная массы каждого компонента оксида, сделать расчет несложно:
Ответ: массовые доли магния и кислорода в оксиде магния составляют 60% и 40% соответственно.
Пример 2
Потренируемся находить массовую долю элемента в сложном веществе. Определим, какую часть этилового спирта С2H6O составляет водород.
Решение:
В данном случае у нас нет конкретных указаний на массы элементов или всего вещества. Но мы можем воспользоваться другой формулой массовой доли в химии, которая позволяет работать с относительными величинами:
Согласно таблице Менделеева относительная атомная масса водорода равна единице.
Ar(H) = 1.
Вычислим относительную молекулярную массу соединения С2H6O, которая складывается из соответствующих масс каждого элемента:
Mr(С2H6O) = 2M(C) + 6M(H) + M(O) = 2⋅12 + 6⋅1 + 16 = 46.
Полученные данные подставим в формулу и определим массовую долю элемента в соединении:
Ответ: в этиловом спирте массовая доля водорода составляет 13%.
Другая полезная статья по химии: «Примеры моносахаридов».
Как вычислить массовую долю вещества в растворе
Вспомним, что такое концентрация раствора. Она говорит о том, в каком соотношении находятся растворенное вещество и растворитель, а другими словами — сколько растворенного вещества содержится в единице объема или массы. Концентрация может быть безразмерной величиной и выражаться в процентах, но также ее можно выразить в массовых или в молярных долях.
В случае с растворами применима та же формула:
Если нужно значение в процентах, результат надо умножить на 100%.
Пример
Требуется приготовить 0,5 л раствора карбоната натрия плотностью 1,13 г/мл. Определите массу карбоната натрия при условии, что концентрация раствора должна быть 13%.
Решение:
Вначале нам нужно узнать массу раствора, что легко сделать, когда известны его объем и плотность. Воспользуется формулой m(р–ра) = ρ × V
m(р–ра) = 500 × 1,13 = 565 г.
Дальше вспомним, как находить массовую долю растворенного вещества:
Поскольку концентрация раствора — это и есть массовая доля растворенного вещества, подставим ее в уравнение:
m(Э) = 0,13 × 565 = 73,45 г.
Ответ: для раствора понадобится 73,45 г карбоната натрия.
Вопросы для самопроверки:
Как обозначается массовая доля и в чем она выражается?
В чем разница между молекулярной массой вещества и его молярной массой?
Как найти массовую долю элемента в веществе, если мы знаем массу элемента и массу вещества?
Как рассчитать массовую долю вещества в растворе?
В каких безразмерных и размерных величинах можно выразить концентрацию раствора?
Вам может быть полезная статья о том, как найти обьем параллелепипеда.




















