Спирты — это большая группа химических соединений, производные углеводородов, у которых один или несколько атомов водорода замещены на гидроксильную группу ОН−.
Гидроксильная группа является функциональной группой спиртов.
Для кого эта статья:
- Читатели, интересующиеся темой статьи
- Специалисты в данной области знаний
- Студенты или школьники, стремящиеся углубить свои знания
Классификация спиртов
Спирты классифицируют по различным признакам: по количеству гидроксильных групп; по типу атома углерода, с которым связана гидроксогруппа; а также по строению углеводородного радикала.
По количеству гидроксогрупп
По этому признаку выделяют одноатомные и многоатомные спирты.
У одноатомных спиртов одна группа ОН−. Пример — этиловый спирт (этанол):
CH3—CH2—OH(C2H5OH).
У многоатомных — несколько групп ОН−.
Например, предельный двухатомный спирт этиленгликоль (этандиол):
HO—CH—CH—OH.
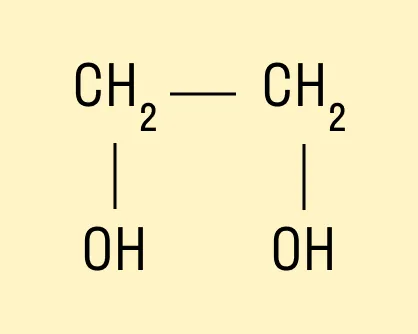
Трехатомный спирт глицерин:
HO—CH2—CH(OH)—CH2—OH.
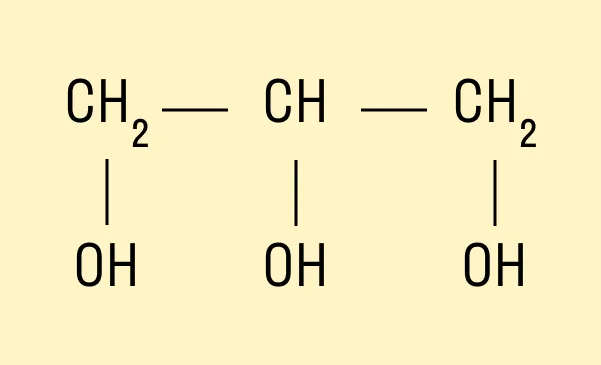
Современное название многоатомных спиртов — полиолы (диолы, триолы и т. д.).
👉 Посмотри возможности нашей онлайн школы!
Химия станет понятной за несколько уроков!
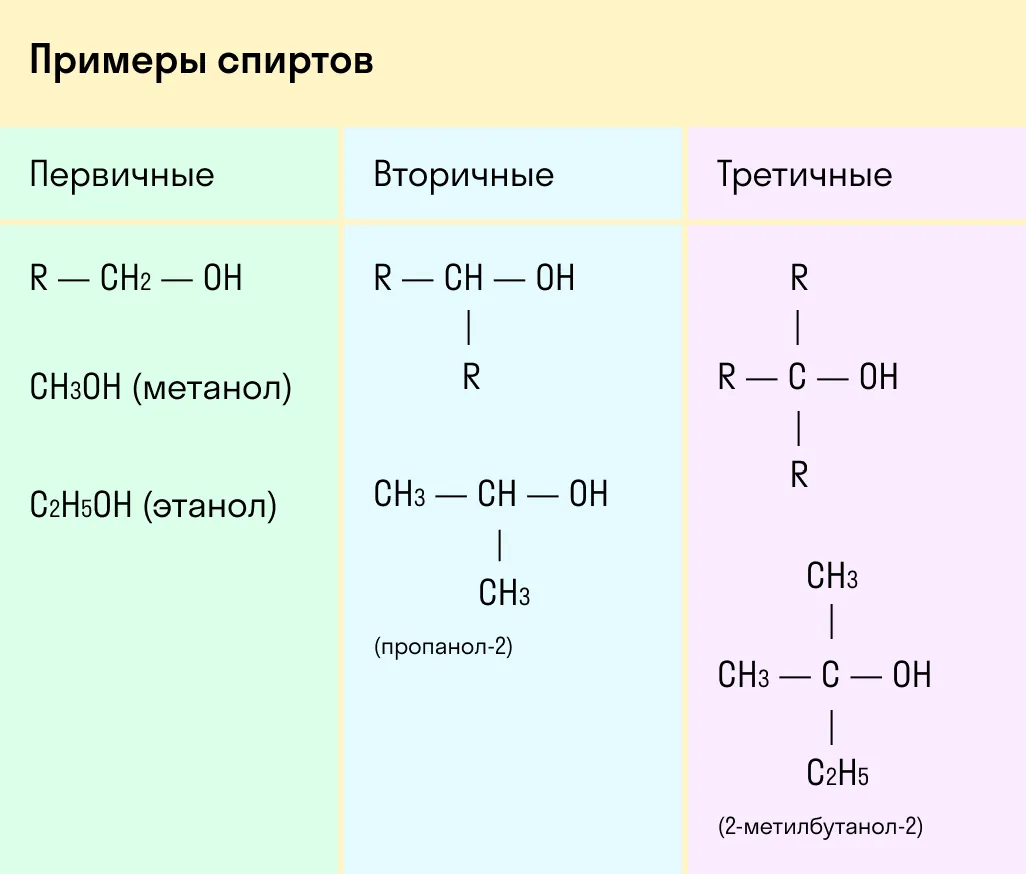
По типу атома углерода, с которым связана гидроксогруппа
Выделяют первичные, вторичные и третичные спирты. Показали примеры каждого вида спиртов в таблице.
Для полного понимания химических свойств спиртов важно рассмотреть также строение атома углерода, из которого формируются кислородные связи в спиртах. Подробнее об этом можно узнать в статье, посвященной строению атома углерода, где подробно описаны формула, химические свойства и характеристики этого химического элемента.
По строению углеводородного радикала
По строению углеводородного радикала спирты бывают:
Предельные (этанол СН3—СН2—ОН);
Непредельные (пропенол СН2=СН—СН2—ОН);
Ароматические (фенилметанол С6Н5—СН2ОН).

Номенклатура спиртов
По систематической номенклатуре ИЮПАК (IUPAC)
Спиртам дают название по названию углеводорода с добавлением суффикса -ол и цифры, которая показывает положение гидроксильной группы. Для того, чтобы правильно определить, с каким по счету атомом углерода соединена гидроксильная группа, необходимо учитывать следующие правила:
-
Выбрать самую длинную углеводородную цепь, в состав которой входит гидроксильная группа. Таким образом устанавливают число атомов углерода и соответственно формируют название.
-
Нумерацию длинной цепи осуществляют с того края, к которому ближе расположена гидроксильная группа.
-
Местоположение гидроксогруппы в названии определяют написанием цифры после суффикса -ол.
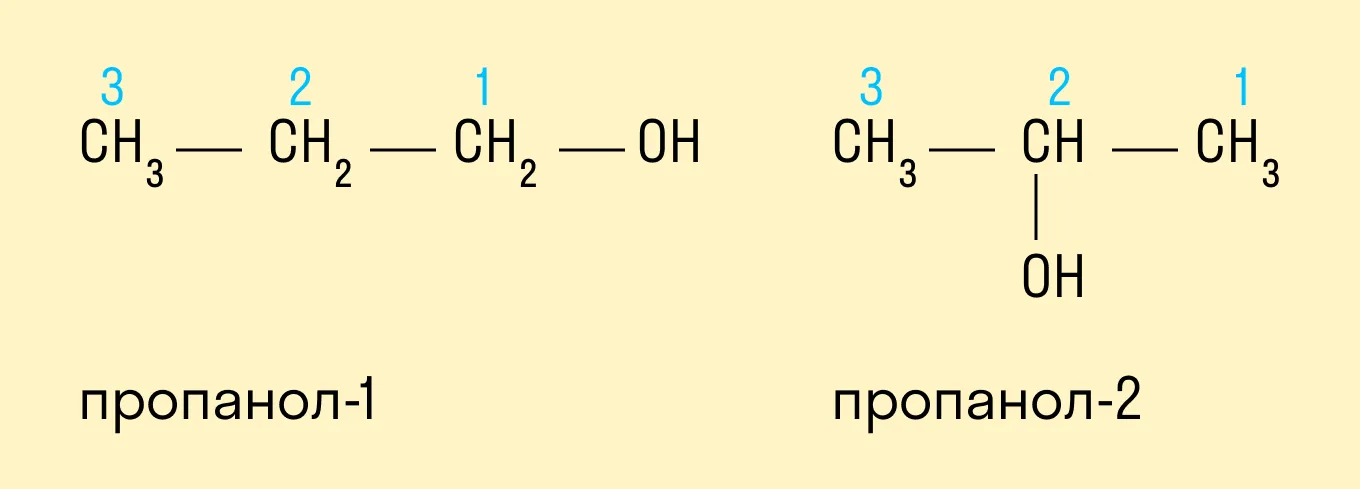
Если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа. В таком случае перед названием указывают цифрой, от какого атома углерода идет ответвление.
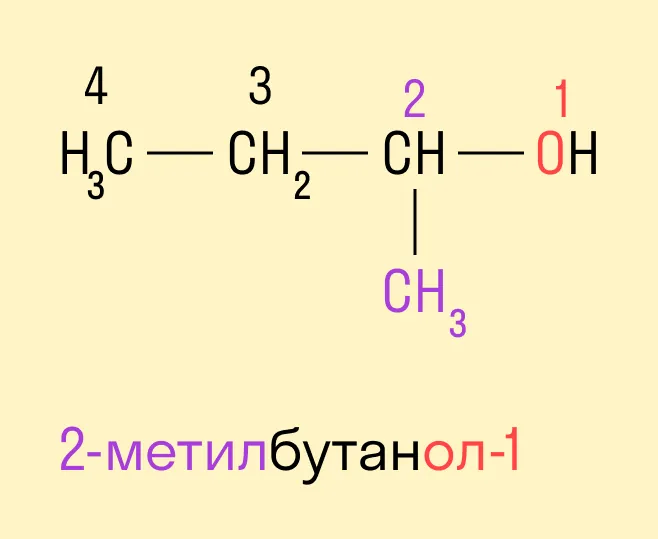
Радикально-функциональная номенклатура
По такому способу название спирта формируется от названия радикала с добавлением слова «спирт». Например:
-
СH3—OH — метанол или метиловый спирт;
-
C2H5OH — этанол или этиловый спирт;
-
CH3—CH2—CH2—СН2—OH — бутанол или бутиловый спирт.
Тривиальная номенклатура
Тривиальные названия были даны спиртам по источнику природного получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Показали некоторые тривиальные названия спиртов в таблице:
|
Химическая формула спирта |
Название по номенклатуре ИЮПАК |
Тривиальное название |
|---|---|---|
|
CH3—OH |
Метанол |
Древесный спирт |
|
CH3—CH2—OH |
Этанол |
Винный спирт |
|
CH3—CH2—CH2—CH2—CH2—OH |
Пентанол-1 |
Амиловый спирт |
|
|
Этандиол-1,2 |
Этиленгликоль |
|
|
Пропантриол-1,2,3 |
Глицерин |
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Изомерия спиртов
Изомерия — это явление существования соединений, у которых одинаковый качественный и количественный состав, но различное строение, а значит, разные свойства.
Давайте рассмотрим виды изомерии, которые характерны для спиртов.
Структурная
-
Изомерия углеродного скелета характерна для спиртов, в состав которых входит четыре и более атомов углерода.
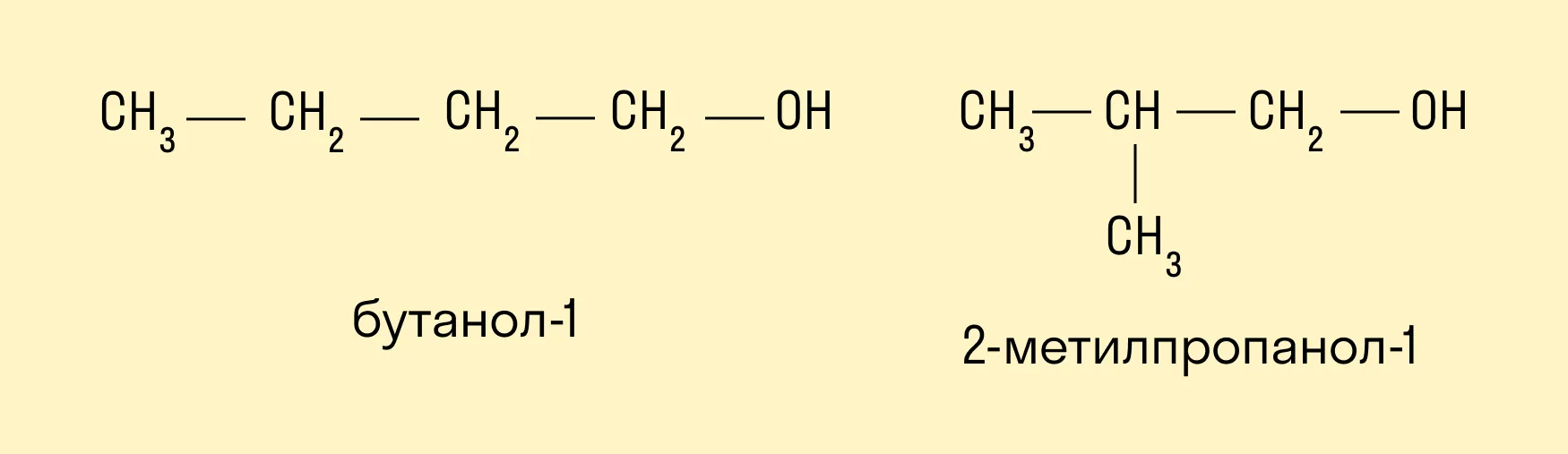
-
Изомерия положения гидроксильной группы.
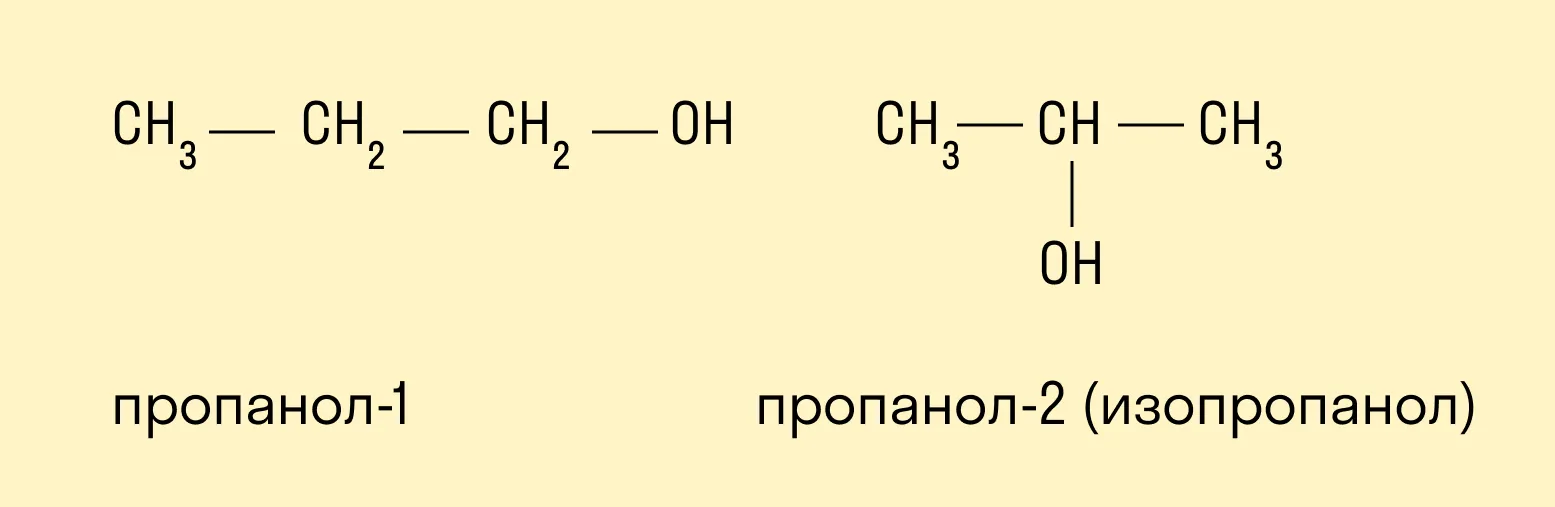
Межклассовая
Межклассовые изомеры — это вещества, которые относятся к разным классам и имеют различное строение, но одинаковый состав.
Для спиртов межклассовыми изомерами являются простые эфиры. Общая формула спиртов и простых эфиров — CnH2n+2O.
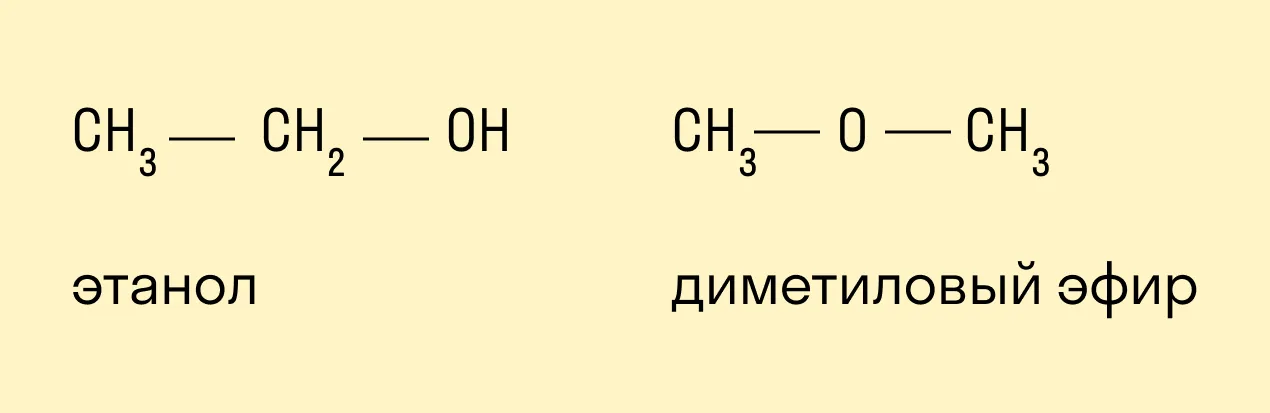
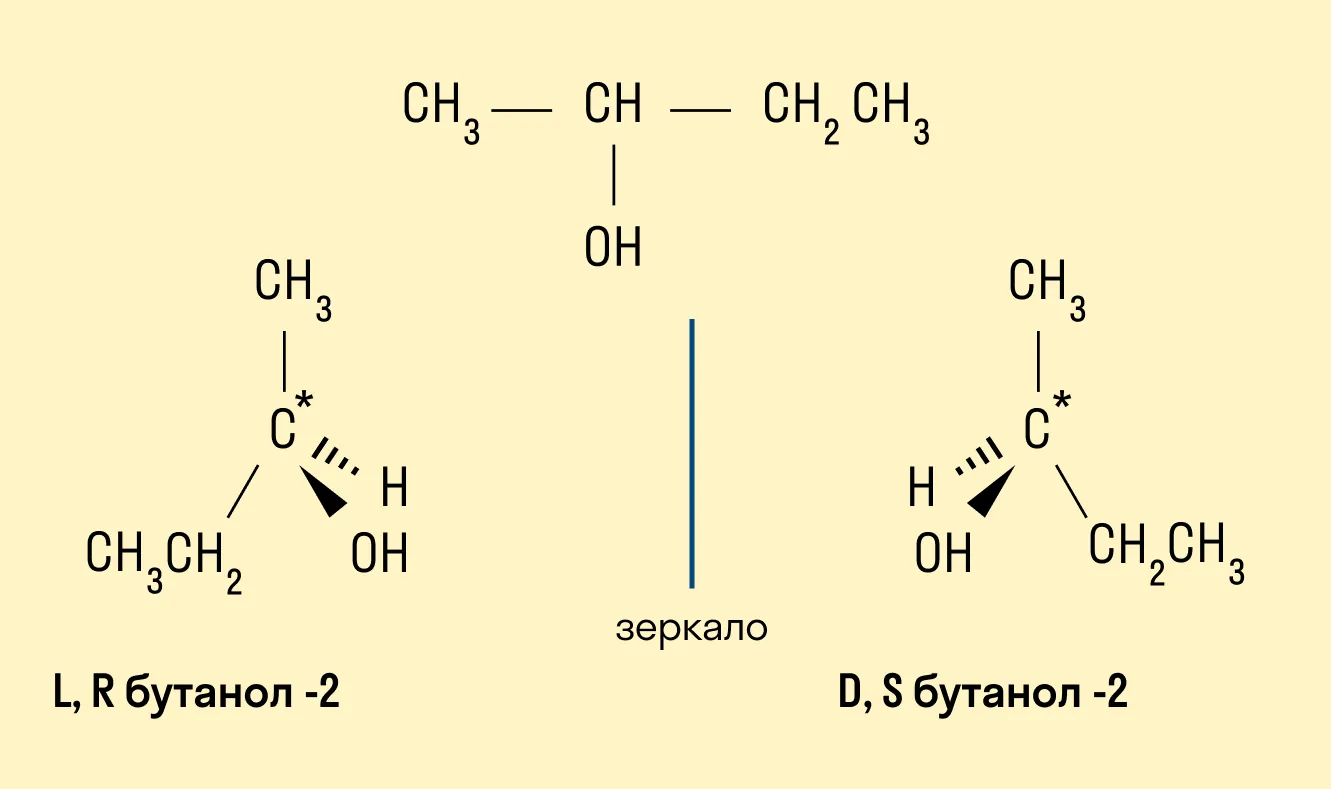
Пространственная (оптическая)
Например, бутанол-2, в молекуле которого второй атом углерода соединен с четырьмя различными заместителями, существует в форме двух различных оптических изомеров.
Получение спиртов
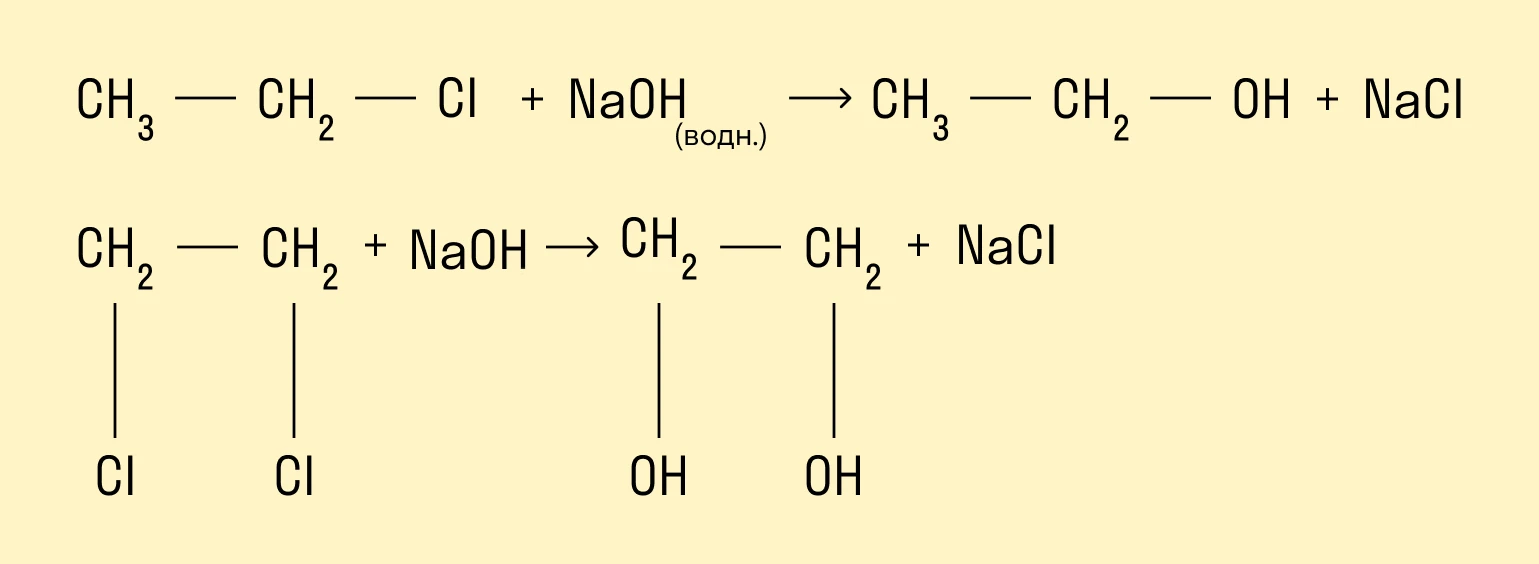
Гидролиз галогенопроизводных алканов
Галогенпроизводные алканов реагируют с водным раствором щелочей, результатом реакции является образование спиртов. Атом галогена в галогеналкане замещается на гидроксогруппу.
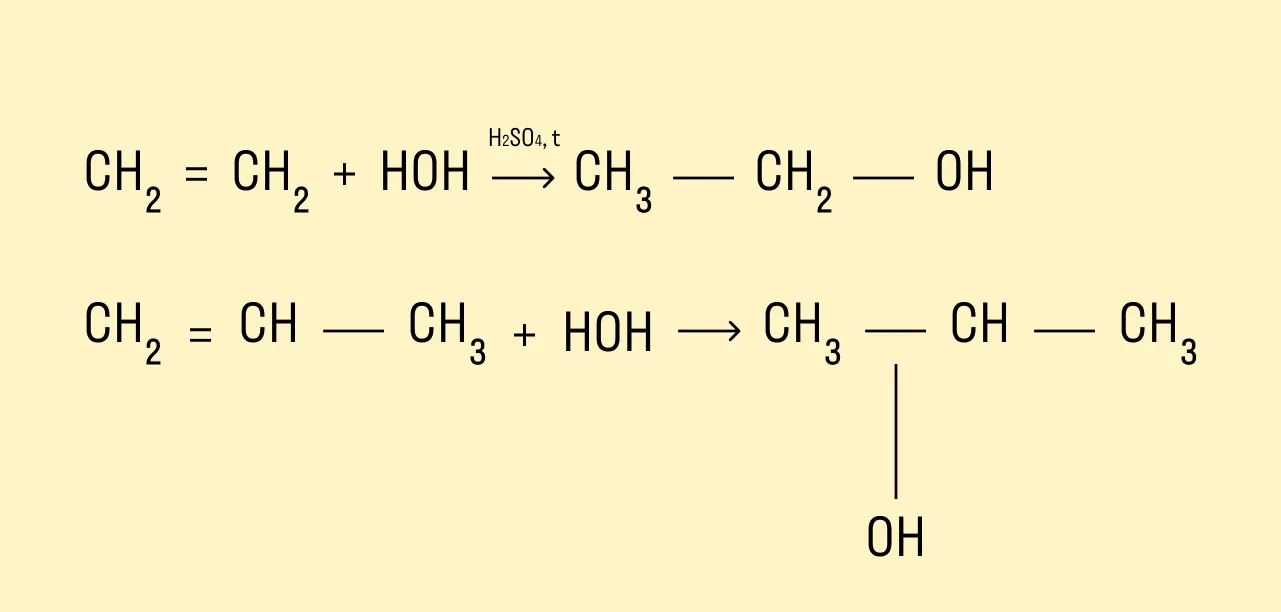
Гидратация алкенов
Присоединение молекул воды происходит в присутствии минеральных кислот и при нагревании.
Если в реакцию вступают несимметричные алкены, то процесс гидратации подчиняется правилу Марковникова. Атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксогруппа соединяется с соседним атомом углерода, наименее гидрированным.
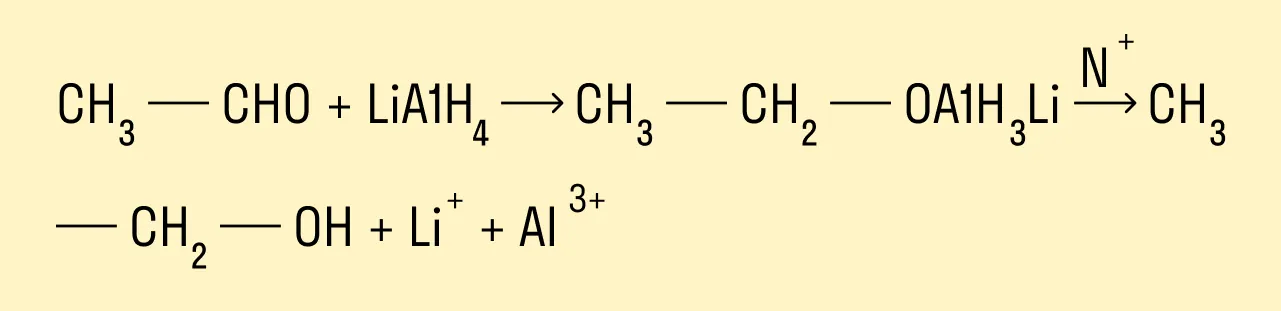
Восстановление альдегидов и кетонов
Восстановление проводят каталитическим гидрированием карбонильной группы. Катализаторами могут быть никель, платина, палладий. Первичные спирты образуются из альдегидов, вторичные — из кетонов.
СН3—СНО + Н2 → CH3—CH2—OH
CH3—C(O)—CH3 + H2 → CH3—CH(OH)—CH3
Альдегиды и кетоны можно восстанавливать, действуя на них разными восстановителями, например, комплексным алюмогидридом лития LiAlH4.
Реакция Канниццаро
Это окислительно-восстановительная реакция диспропорционирования альдегидов в первичные спирты и карбоновые кислоты под действием оснований.
2СH3—CHO + NaOH → CH3—CH2—OH + CH3—COONa
Гидролиз сложных эфиров
Процесс гидролиза заключается в том, что под действием воды происходит расщепление сложных эфиров. Гидролиз может протекать в кислой и щелочной среде. Гидролиз в щелочной среде является процессом необратимым, так как происходит омыление, т. е. образование солей карбоновых кислот.
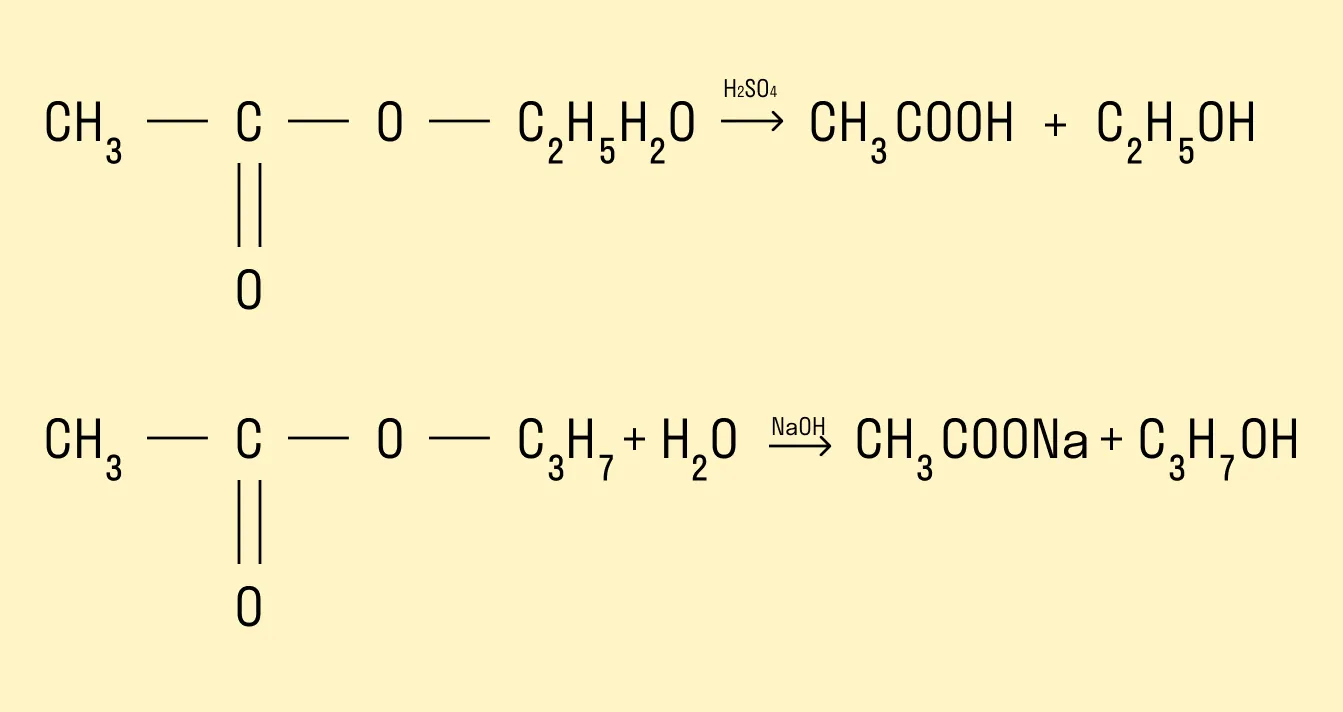
Синтез Гриньяра
Синтез с использованием реактива Гриньяра. Реактивы Гриньяра — магнийорганические соединения, содержащие ковалентную связь C—Mg. Чаще всего их получают из органилгалогенидов вида R—X, где X = Cl, Br, I и магния в безводной среде.
Первичные спирты получают из муравьиного альдегида.
Уксусный альдегид и другие альдегиды дают вторичные спирты.
Кетоны и сложные эфиры образуют третичные спирты.
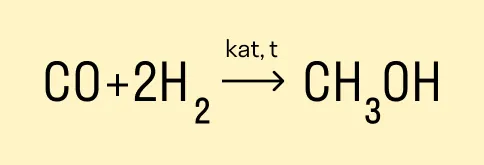
Получение метанола из синтез-газа
Основной промышленный метод получения метанола состоит из двух этапов:
-
Получение синтез-газа с помощью паровой, парокислородной или пароуглекислотной конверсии природного газа.
-
Синтез метанола путем восстановления оксида и диоксида углерода водородом на катализаторе.
Получение этанола
Этанол можно получить путем ферментативного брожения глюкозы (спиртовое брожение).
С6Н12О6 → 2C2H5OH + 2CO2
Реакция Вагнера
Окисление алкенов холодным раствором перманганатом калия в нейтральной среде (реакция Вагнера).
3CH2=CH2 + 2KMnO4 + 4H2O → HO—CH2—CH2—OH + 2MnO2 + 2KOH
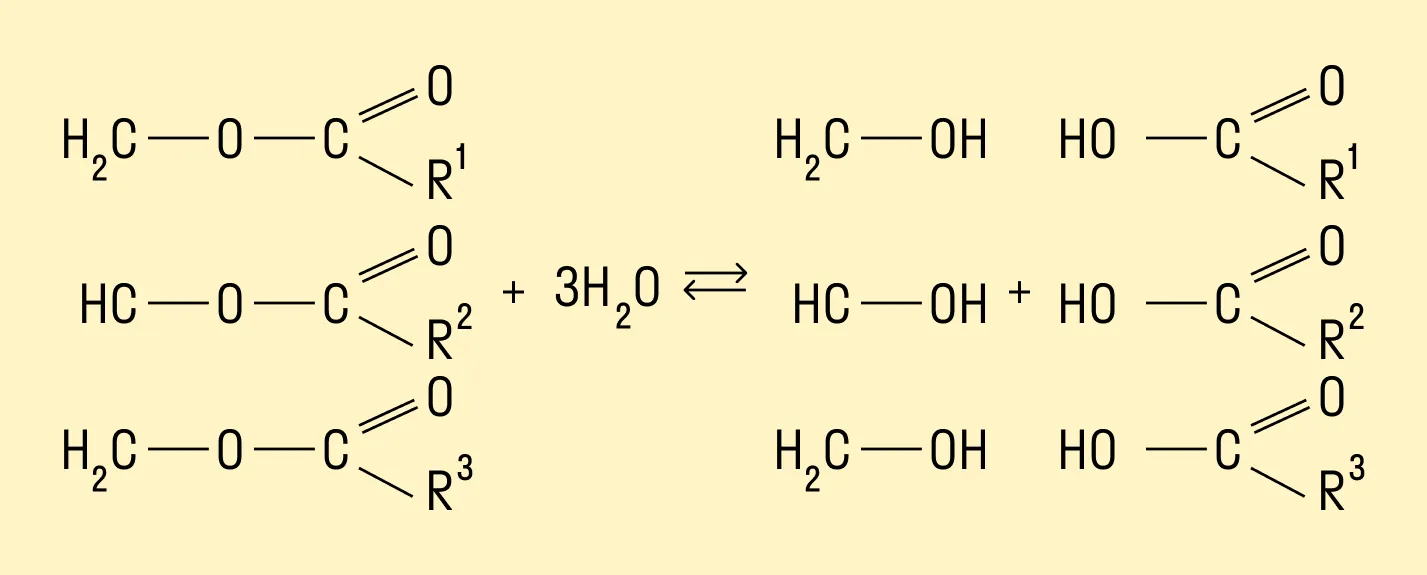
Гидролиз жиров
Многоатомные спирты можно получить путем гидролиза жиров. При взаимодействии кислот с жирами происходит образование глицерина и карбоновых кислот.
Физические свойства спиртов
В основном все виды спиртов — это жидкости, имеющие относительно высокие температуры кипения. Температуры кипения выше у многоатомных спиртов и фенолов.
Температуры кипения спиртов
|
Название спирта |
Формула |
Температура кипения, °C |
|---|---|---|
|
Метанол |
CH3—OH |
64 |
|
Этанол |
CH3—CH2—OH |
78 |
|
Пропанол-1 |
CH3—CH2—CH2—OH |
92 |
|
Бутанол-1 |
CH3—CH2—CH2—CH2—OH |
118 |
|
Этандиол-1,2 (этиленгликоль) |
|
197 |
|
Пропантриол-1,2,3 (глицерин) |
|
290 |
Понимание химических свойств и методов получения спиртов невозможно без глубокого знания теории химического строения органических веществ. В этом контексте большое значение имеет теория Бутлерова, которая описывает структурные основы органической химии и помогает объяснить поведение различных органических соединений.
Химические свойства одноатомных спиртов
Общая формула одноатомных предельных спиртов: CnH2n+1OH. В спиртах, одноатомных и многоатомных, помимо связи между углеродом и водородом (С—ОН), есть еще одна связь между кислородом и водородом (О—Н). Поэтому химические реакции проходят с разрывом одной из цепей:
-
реакции восстановления проходят с отщеплением гидроксильной группы от молекулы спирта;
-
реакции окисления — с отщеплением водорода.
Низшие спирты (метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин) смешиваются с водой в любых соотношениях.
Кислотно-основные свойства
Согласно теории Бренстеда-Лоури спирты — достаточно слабые кислоты. Кислотность спиртов уменьшается по мере усложнения углеродного скелета.
-
Взаимодействие со щелочными металлами:
2С2Н5ОН + 2Na → 2C2H5ONa + H2. -
Взаимодействие со щелочами: С2H5OH + NaOH ⇄ C2H5ONa + H2O.
Спирты — более слабые кислоты, чем вода, поэтому невозможна реакция с водными растворами щелочей. Взаимодействие с твердыми щелочами возможно, реакция обратима. Равновесие сильно смещено влево.
Основность кислот увеличивается по мере увеличения углеродного скелета.
Замещение гидроксогруппы
Гидроксогруппа является плохо уходящей. Энергия разрыва связи С—О довольно высока, поэтому непосредственное замещение группы ОН на другую группу невозможно.
Для того, чтобы замещение было возможно, группу ОН превращают в хорошо уходящую, т. е. понижают энергию разрыва связи. Для этого:
-
проводят реакцию в кислой среде;
-
переводят гидроксигруппу в сульфогруппу применяя H2SO4;
-
применяют кислоты Льюиса.
R—OH + PCl5 → R—Cl + POCl3 + HCl
R—OH + SOCl2 → R—Cl + SO2 + HCl
R—OH + HCl → R—Cl + H2O
R—OH + PBr → R—Br + H3PO3
R—OH + KBr + H2SO4 → R—Br + KHSO4 + H2O
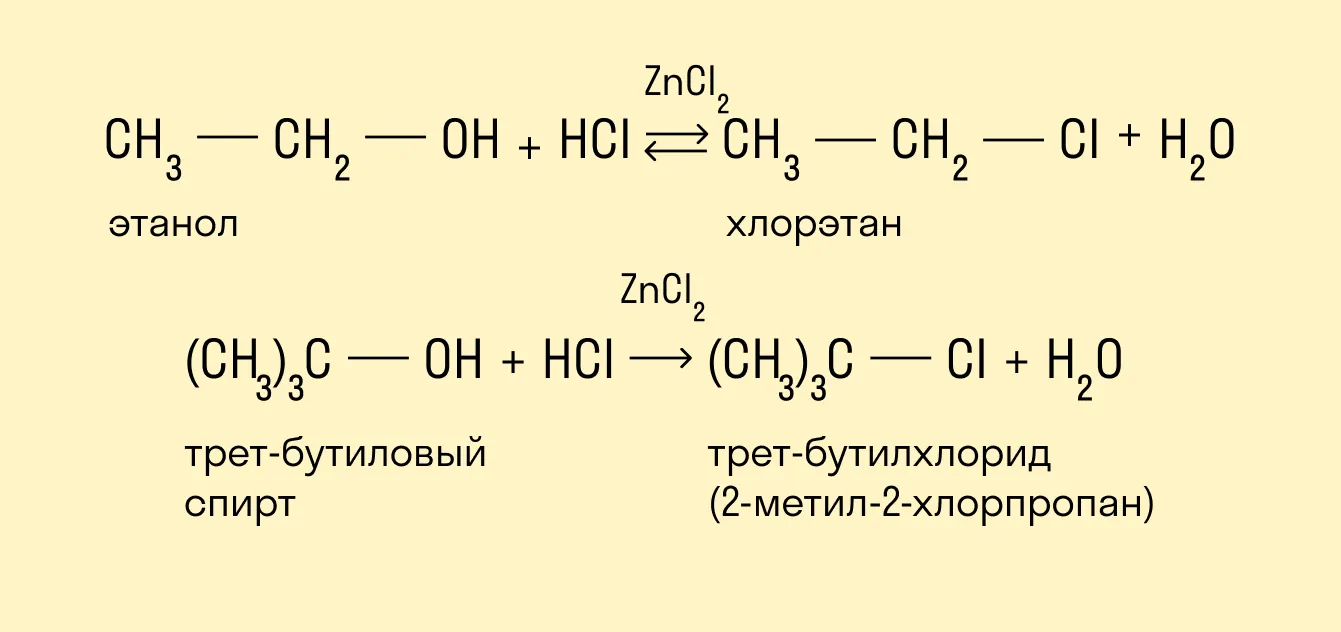
Реакция с использованием реактива Лукаса
Реактив Лукаса — это смесь ZnCl2 и HCl. Скорость реакции убывает при упрощении углеродного скелета. Внешним признаком реакции служит расслоение реакционной смеси в случае образования хлоруглеводорода R—Cl, представляющего собой маслообразное нерастворимое вещество.
Быстрее всего реагируют третичные спирты, слой нерастворимого алкилгалогенида появляется фактически сразу же после смешения реагентов — меньше чем за минуту.
Вторичные спирты вначале растворяются в реактиве, но затем раствор мутнеет, в течение 5 минут появляются капли алкилгалогенида.
Растворы первичных спиртов остаются прозрачными, они образуют хлориды только при нагревании.
Дегидратация спиртов
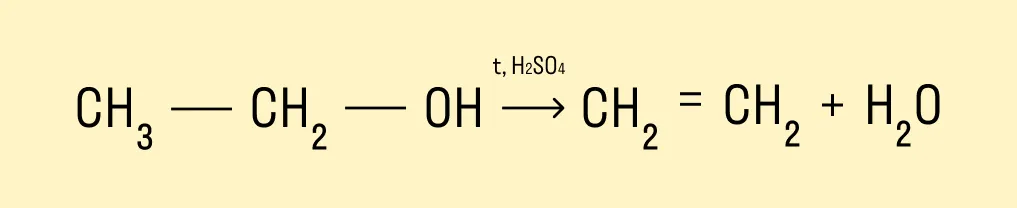
При температуре &rt 140°C и в присутствии серной кислоты происходит внутримолекулярная дегидратация. В результате реакции получается алкен.
При температуре < 140°C и в присутствии серной кислоты происходит межмолекулярная дегидратация. В результате образуется простой эфир.
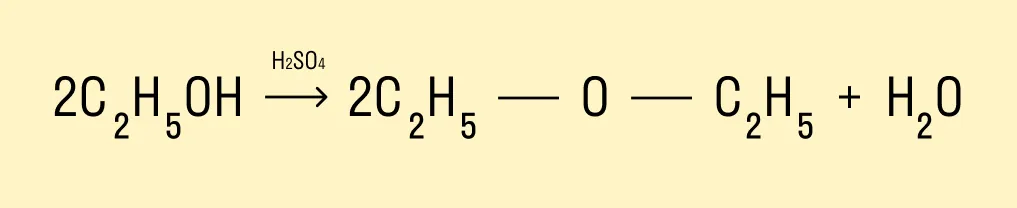
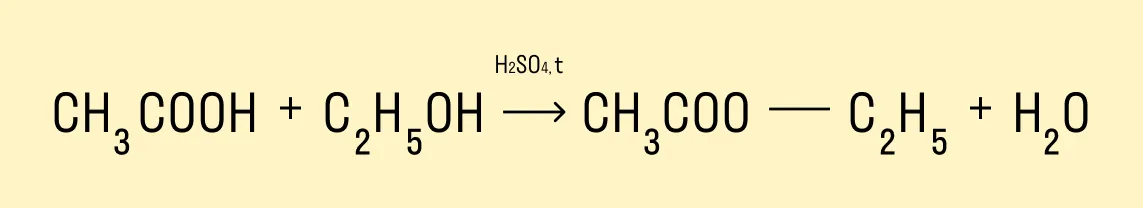
Реакция этерификации — получение сложных эфиров
Предельные одноатомные спирты вступают в химические реакции с карбоновыми кислотами, продукты таких реакций — сложные эфиры.
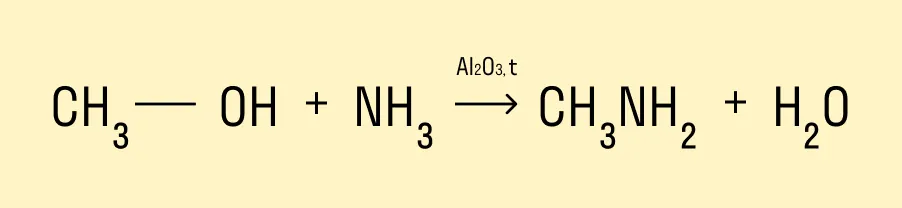
Взаимодействие с аммиаком
Эта реакция происходит при нагревании и в присутствии катализатора. Гидроксогруппа замещается на аминогруппу. Продукт реакции — амин.
Окисление
-
Горение спиртов:
C2H5OH + 3O2 → 2CO2 + 3H2O. -
Жидкофазное окисление с применением хромовой смеси K2Cr2O7 + H2SO4:
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O. -
Окисление оксидом меди (II) при нагревании:
CH3—CH2—OH + CuO → CH3—CHO + Cu + H2O.
Первичные спирты при окислении образуют альдегиды, вторичные переходят в кетоны, третичные окисляются с разрушением углеродного скелета.
Химические свойства многоатомных спиртов
В целом многоатомные спирты сходны с одноатомными, но имеют особенности: проявляют более сильные кислотные свойства и вступают в специфические реакции.
Кислотные свойства
Многоатомные спирты взаимодействуют с щелочными металлами:
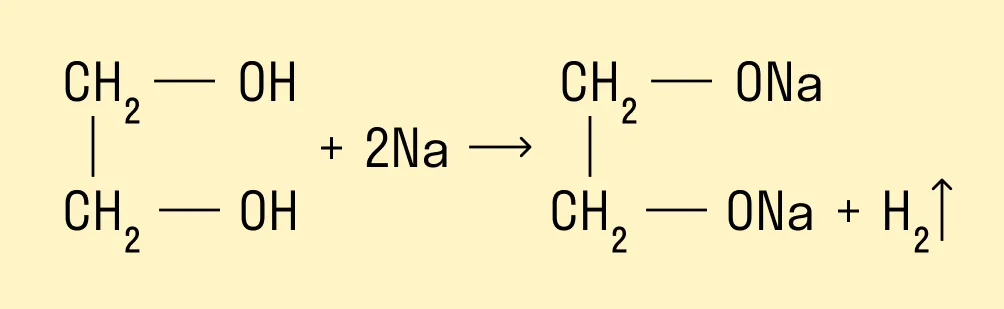
Взаимодействие со свежеосажденным гидроксидом меди (II)
Это качественная реакция на многоатомные спирты:
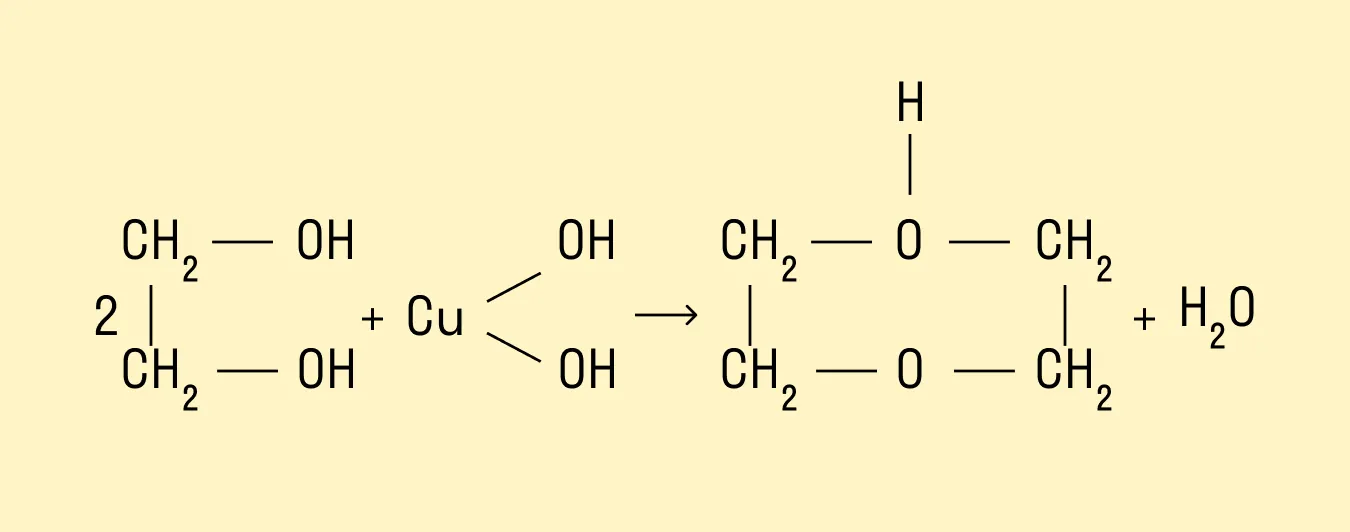
Окисление йодной кислотой и ее солями
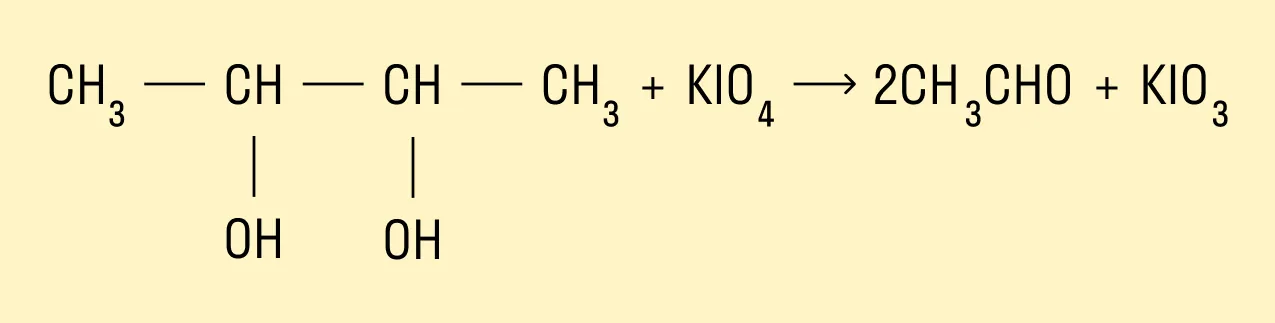
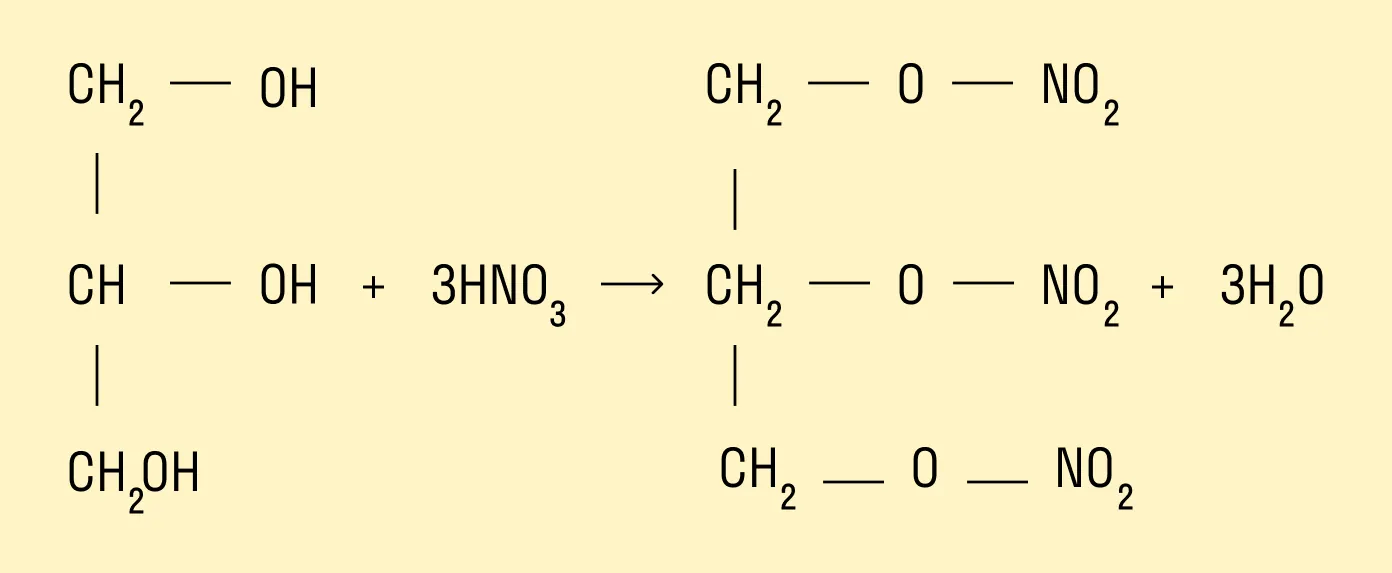
Образование эфиров с азотной кислотой
Вопросы для самопроверки
-
Что такое спирты?
-
Что образуется при межмолекулярной дегидратации спиртов?
-
Какую качественную реакцию имеют многоатомные спирты?
-
Какой характерной реакцией можно получить этанол?
-
Напишите все виды изомерии для пентанола-1.
-
Как классифицируют спирты?





















