Для кого эта статья:
- ученые и исследователи в области химии
- студенты и преподаватели химических специальностей
- специалисты в области экологии и медицинских наук
Спирты
Спирты представляют собой органические соединения, в которых одна или несколько гидроксильных групп ーOH связаны с углеродным атомом.
Классификация спиртов
Спирты делят по различным признакам:
|
Признак |
Пример |
||
|---|---|---|---|
|
Количество гидроксогрупп ーOH |
Одноатомные |
CH3ーOH |
Метанол |
|
Многоатомные |
HOーCH2ーCH2ーOH |
Этандиол |
|
|
Тип углеродного атома, связанного с функциональной группой |
Первичные |
CH3ーCH2ーOH |
Этанол |
|
Вторичные |
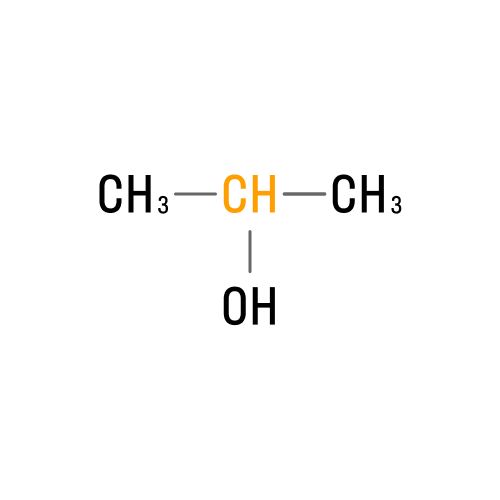 |
Пропанол-2 |
|
|
Третичные |
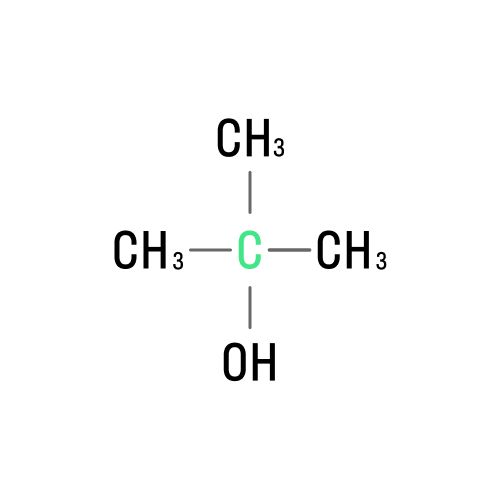 |
2-метилпропанол-2 |
|
|
Строение углеводородного радикала |
Предельные |
CH3ーCH2ーOH |
Этанол |
|
Непредельные |
CH2=CHーOH |
Этенол |
|
|
Ароматические |
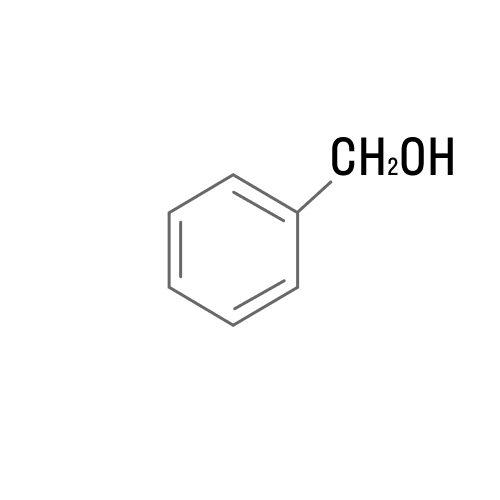 |
Бензиловый спирт |
|
Номенклатура спиртов
Дать спирту название по систематической номенклатуре можно по схеме:
Например: CH3ーCH2ーCH2ーOH — пропанол-1.
Физические свойства спиртов
Все спирты преимущественно являются жидкостями с высокими температурами кипения.
Изомерия спиртов
Для спиртов характерно несколько видов изомерии:
- Структурная
- Если в состав спирта входит четыре и более атомов углерода, то имеет место изомерия углеродного скелета:
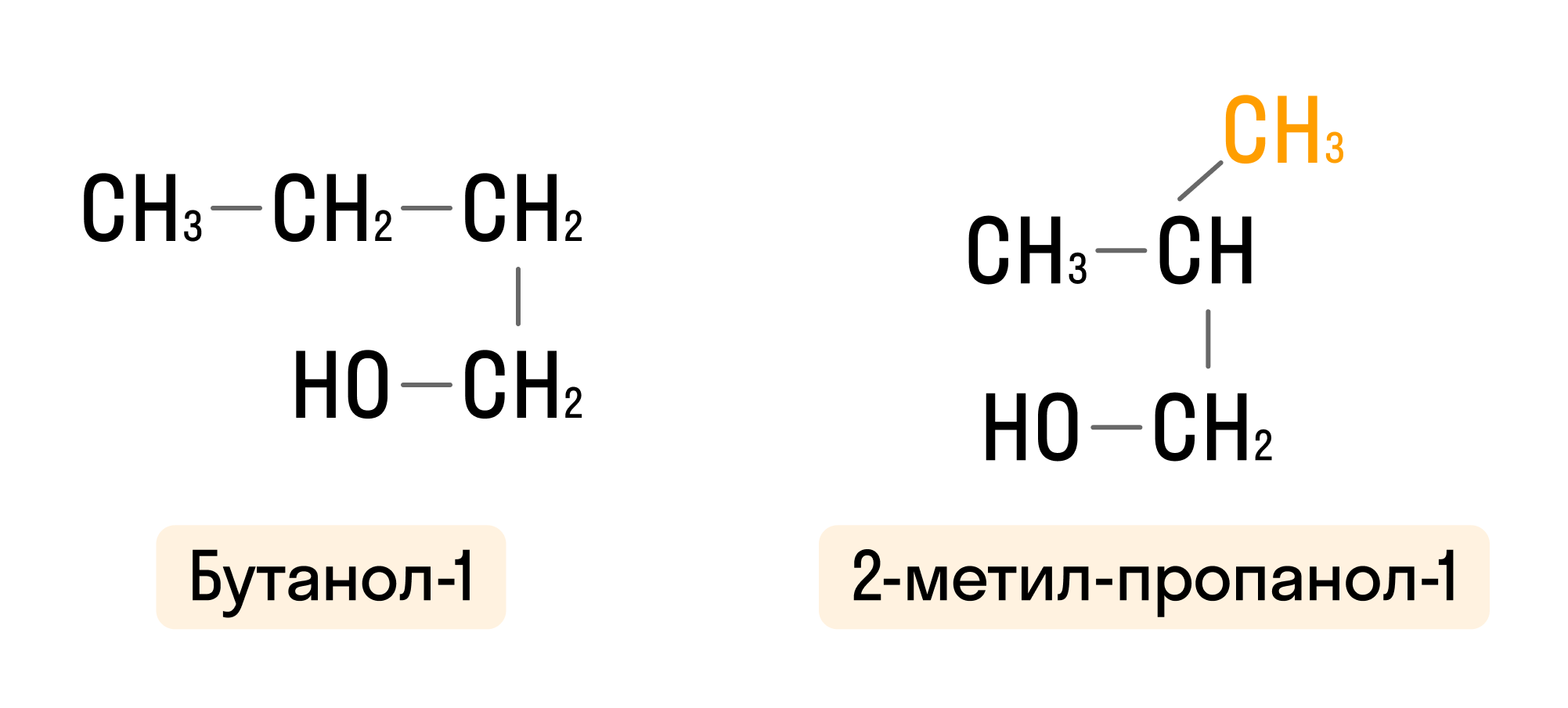
- Изомерия положения гидроксогруппы:
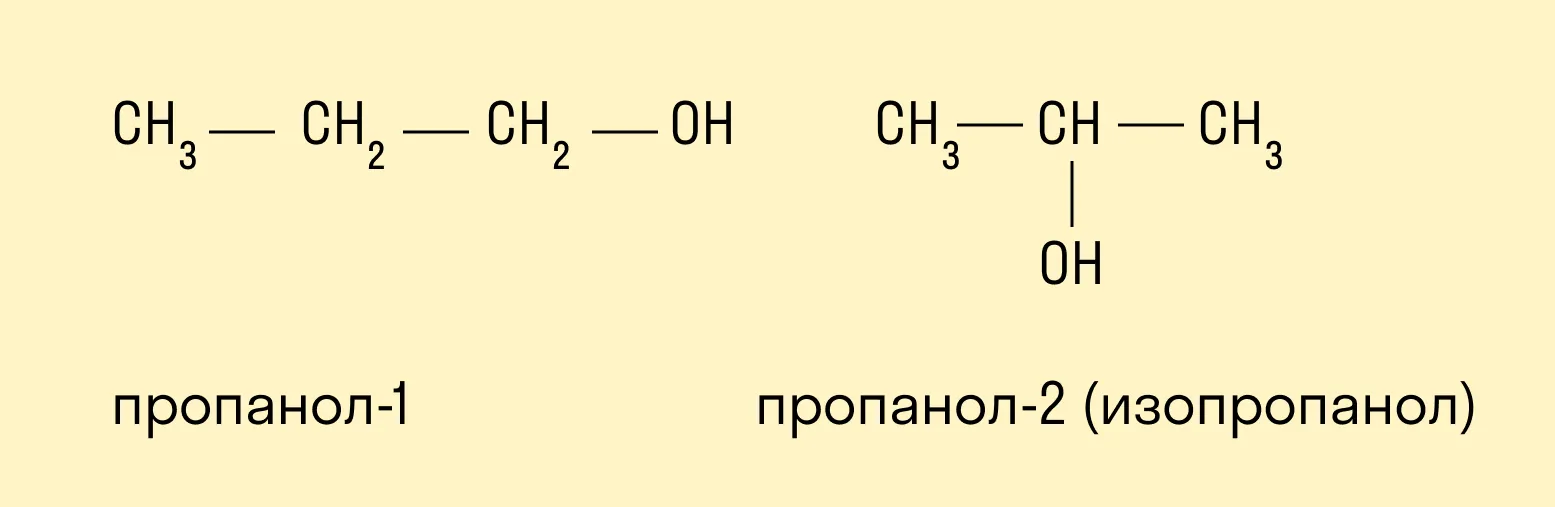
- Если в состав спирта входит четыре и более атомов углерода, то имеет место изомерия углеродного скелета:
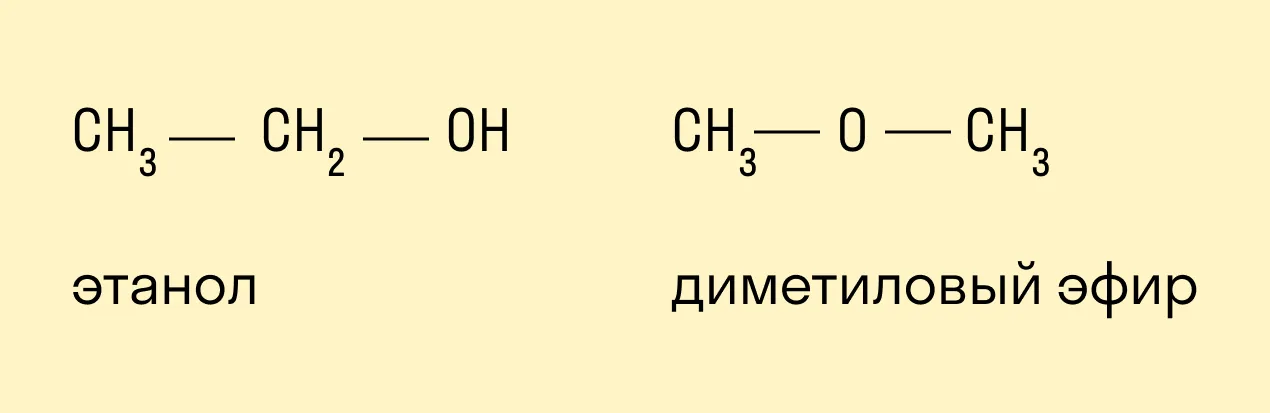
- Межклассовая
Предельным одноатомным спиртам изомерны простые эфиры:
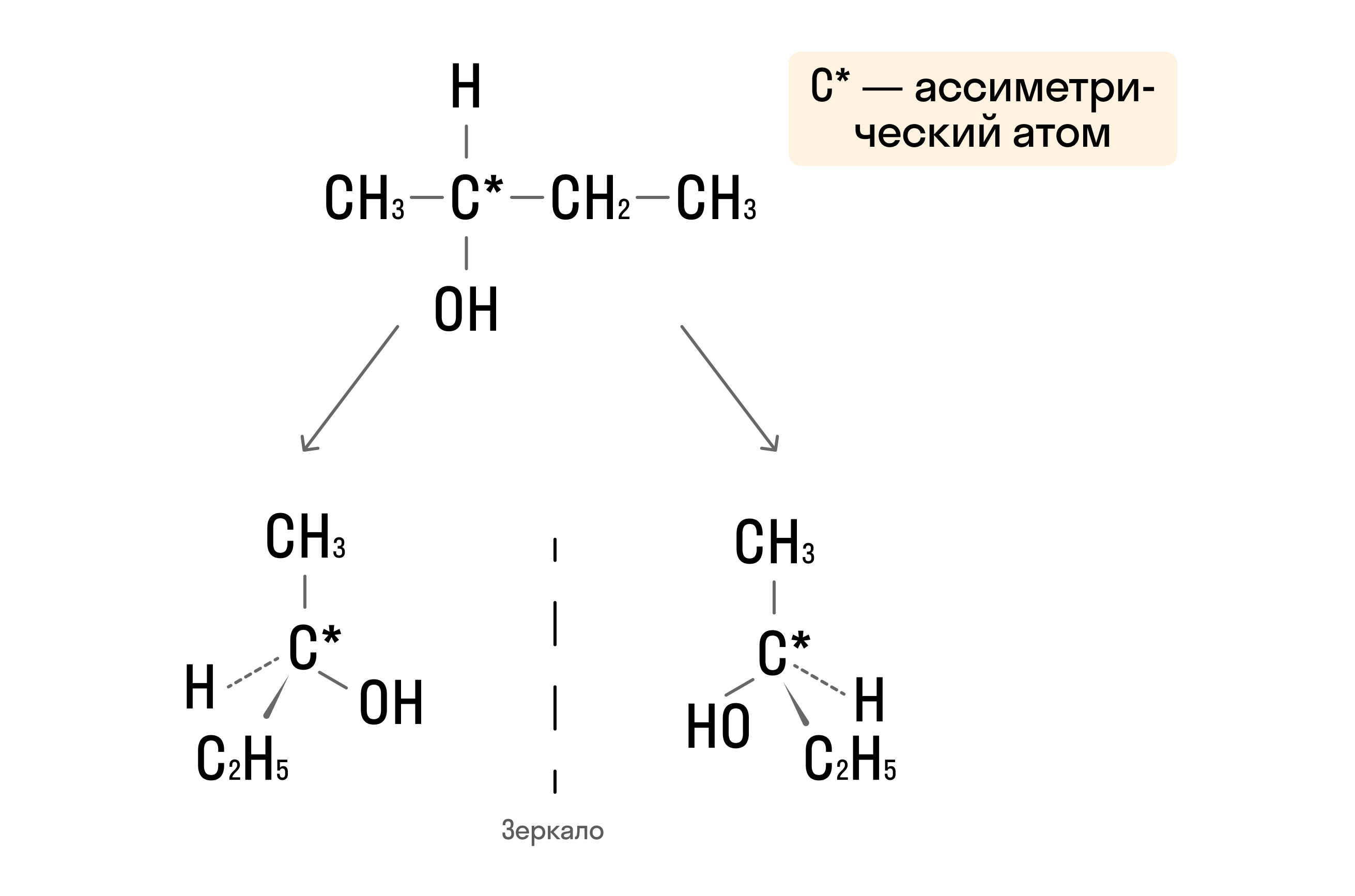
- Оптическая
Химические свойства одноатомных спиртов
Каждая молекула спирта содержит углеводородный радикал и функциональную группу, которые взаимно влияют друг на друга, и благодаря этому химические свойства спиртов имеют некоторые особенности, отличные от других классов органических соединений. В данном разделе мы рассмотрим свойства предельных одноатомных спиртов.
- Кислотные свойства. Спирты проявляют кислотные свойства. Это выражается во взаимодействии с активными металлами IA и IIA групп. Продуктами таких реакций являются соли:
2CH3ーOH + 2Na → 2CH3ーONa (метилат натрия) + H2↑
- Взаимодействие с галогеноводородами. Гидроксильная группа спирта способна обратимо замещаться на атом галогена, что приводит к образованию галогеналканов:
CH3ーOH + HBr ⇄ CH3ーBr (бромметан) + H2O
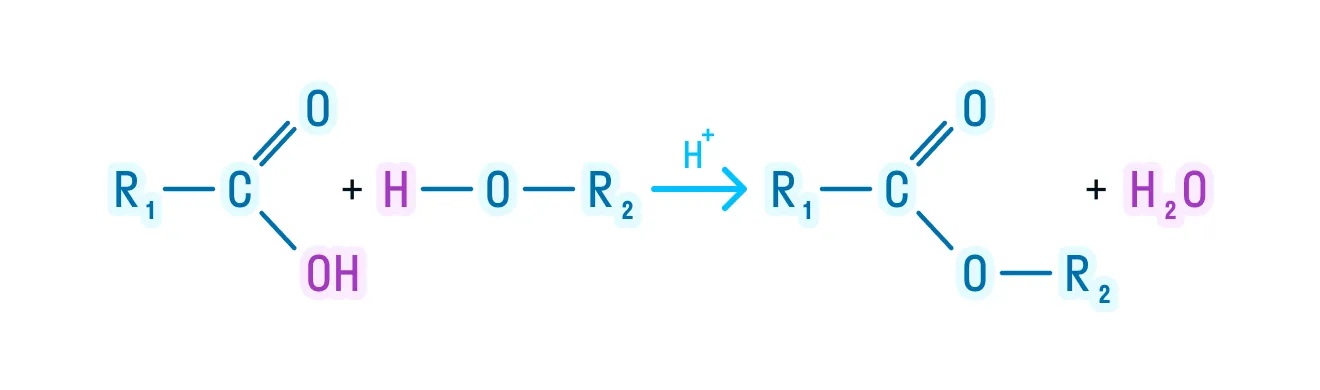
- Реакция этерификации. Одно из важнейших свойств спиртов — взаимодействие с карбоновыми кислотами с образованием сложных эфиров по схеме:
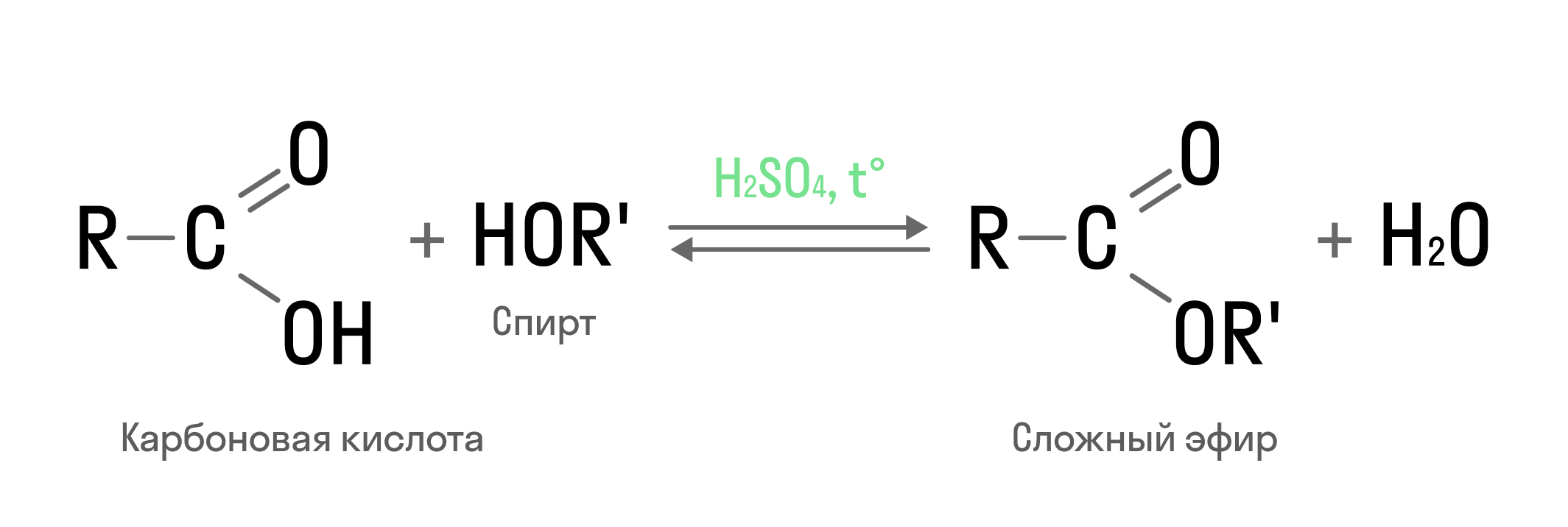
Реакция возможна и с неорганическими кислотами в качестве реагента:
CH3ーOH + HOーNO2 → CH3ーOーNO2 (метилнитрат) + H2O
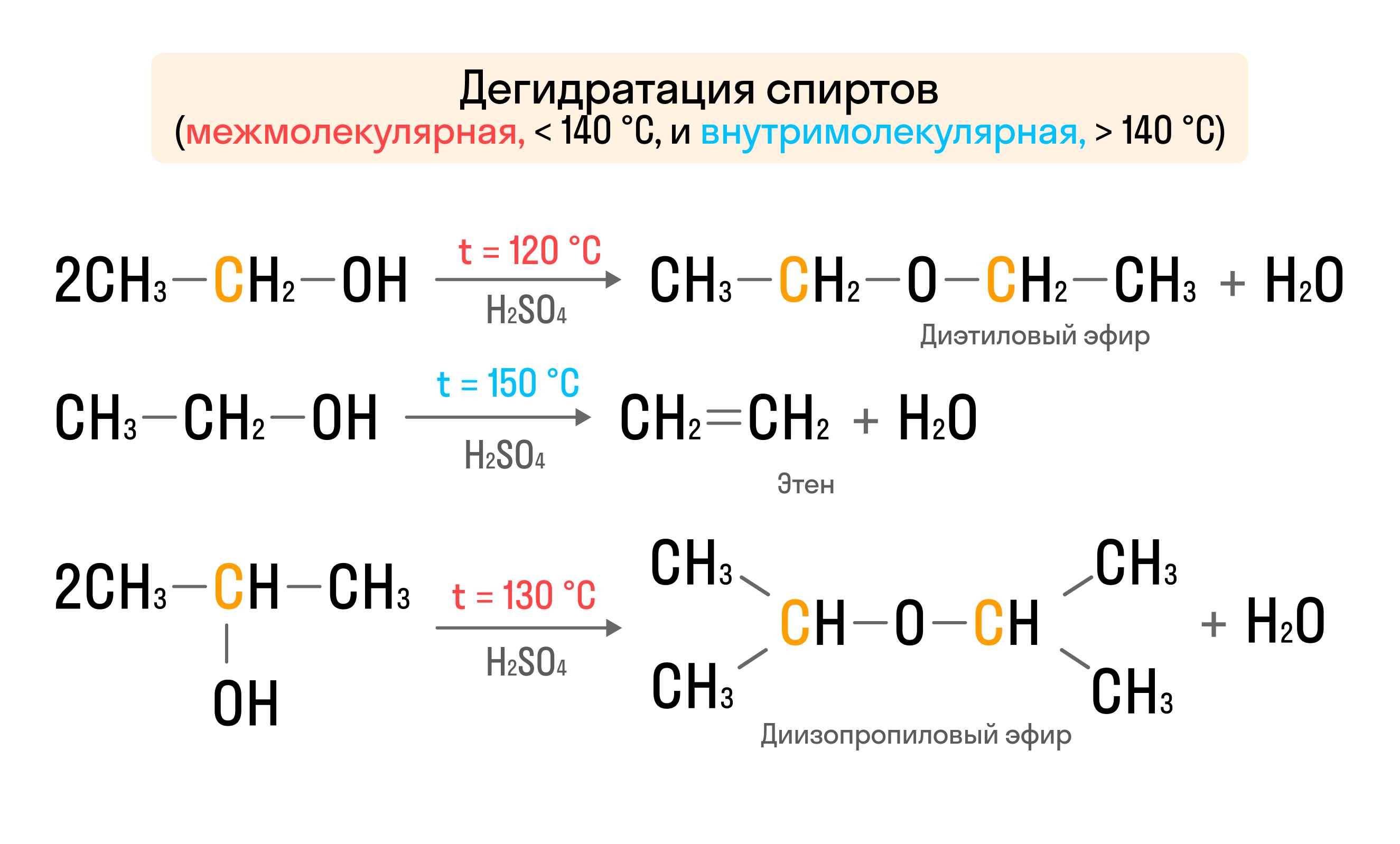
- Дегидратация. Отщепление воды происходит в присутствии серной кислоты и при поддержании высокой температуры. Различают два вида дегидратации — внутримолекулярную и межмолекулярную:
- Взаимодействие с аммиаком — образование аминов:
CH3ーOH + NH3 → CH3ーNH2 (метиламин) + H2O
- Окисление. Таким образом из первичных спиртов получают альдегиды, а из вторичных — кетоны:
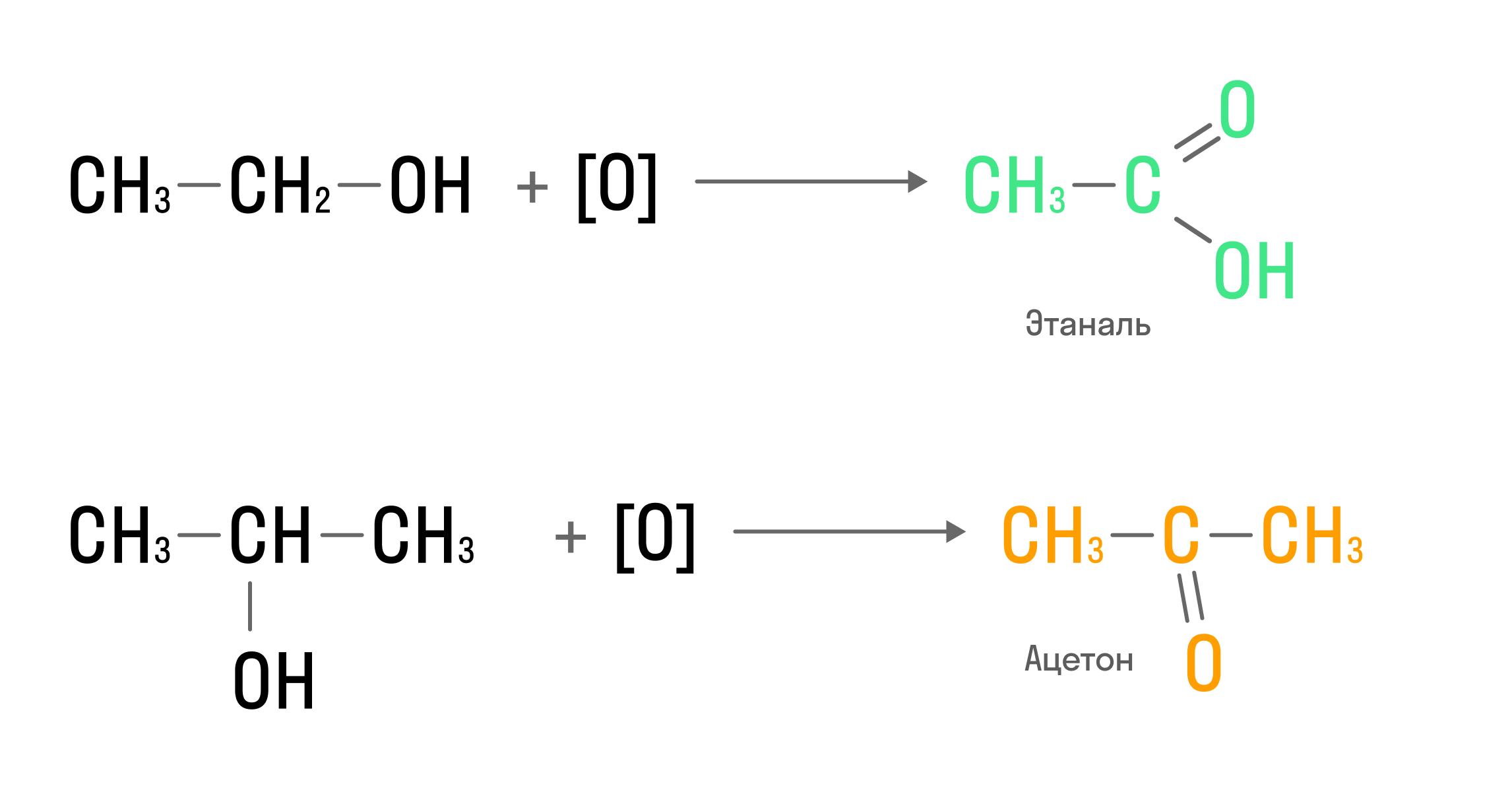
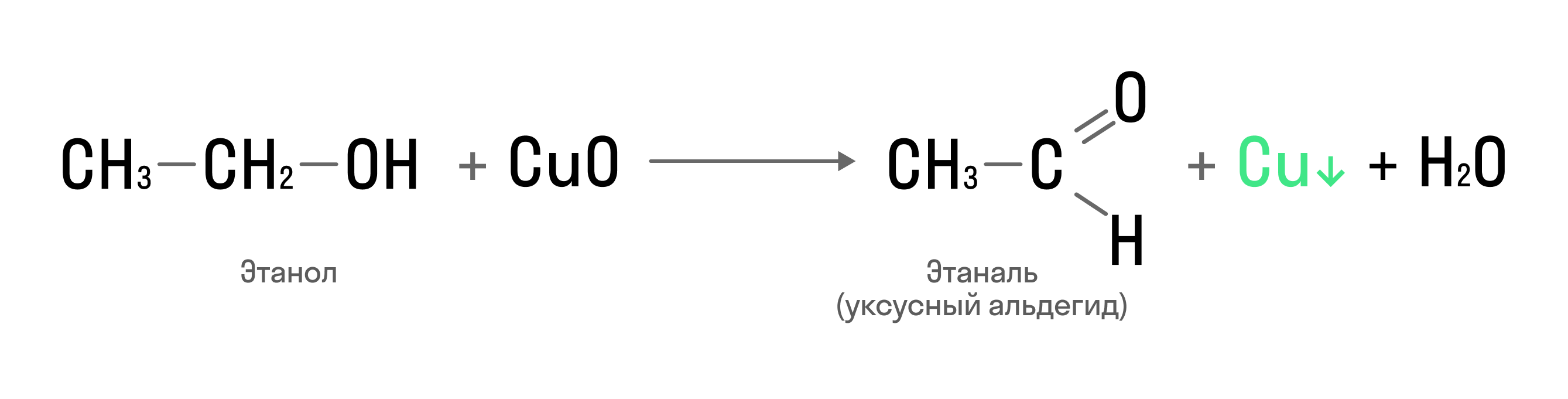
Окисление одноатомных спиртов с помощью оксида меди (II) является качественной реакцией:
Горение спиртов проходит по схеме:
CnH2n+2O + (3n/2)O2 = nCO2 + (n+1)H2O
Химические свойства многоатомных спиртов
Многоатомные спирты обладают двумя и более гидроксильными группами ーOH при разных атомах углерода. Если два соседних атома углерода связаны с функциональной группой, они называются гликолями.
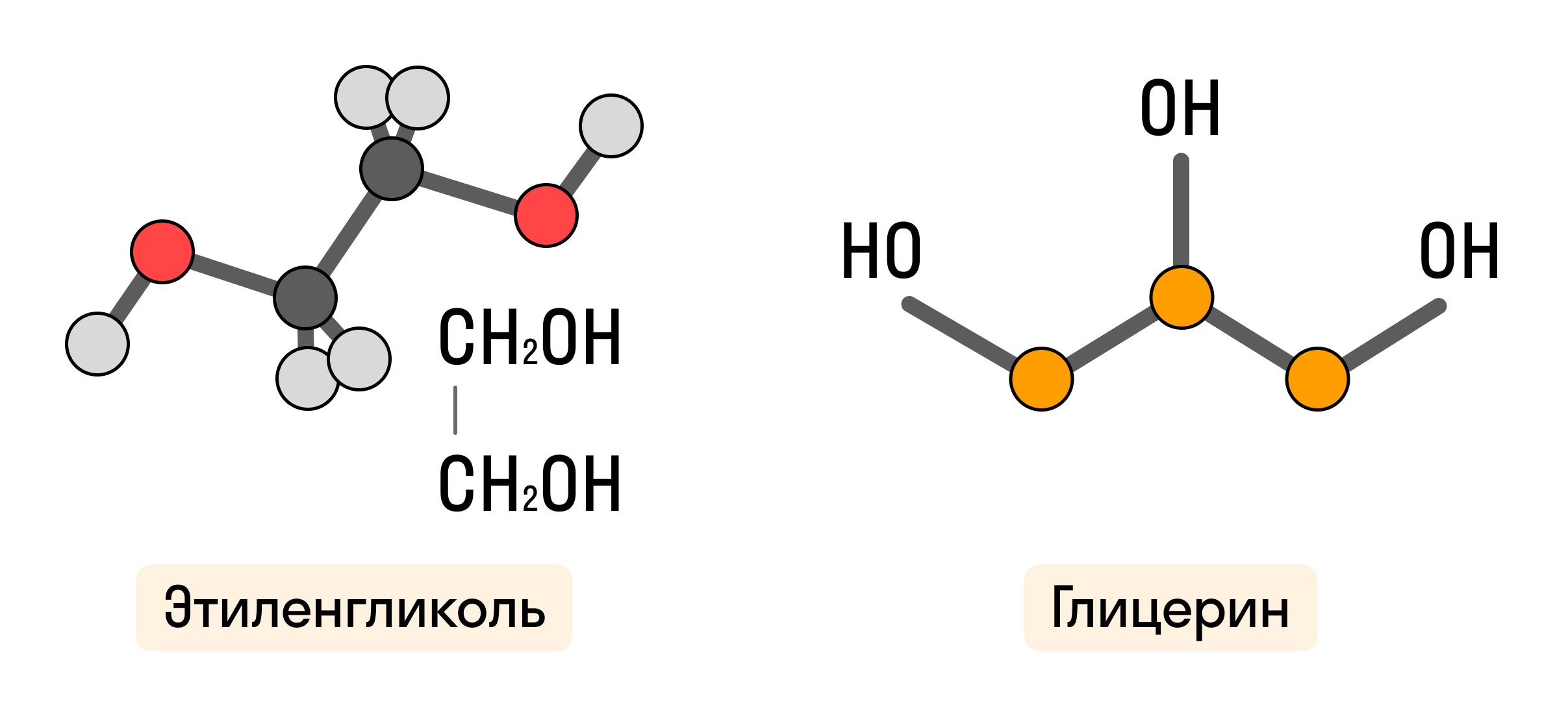
Свойства многоатомных спиртов аналогичны свойствам спиртов одноатомных, однако, наличие нескольких гидроксогрупп обуславливает проявление более выраженного кислотного характера.
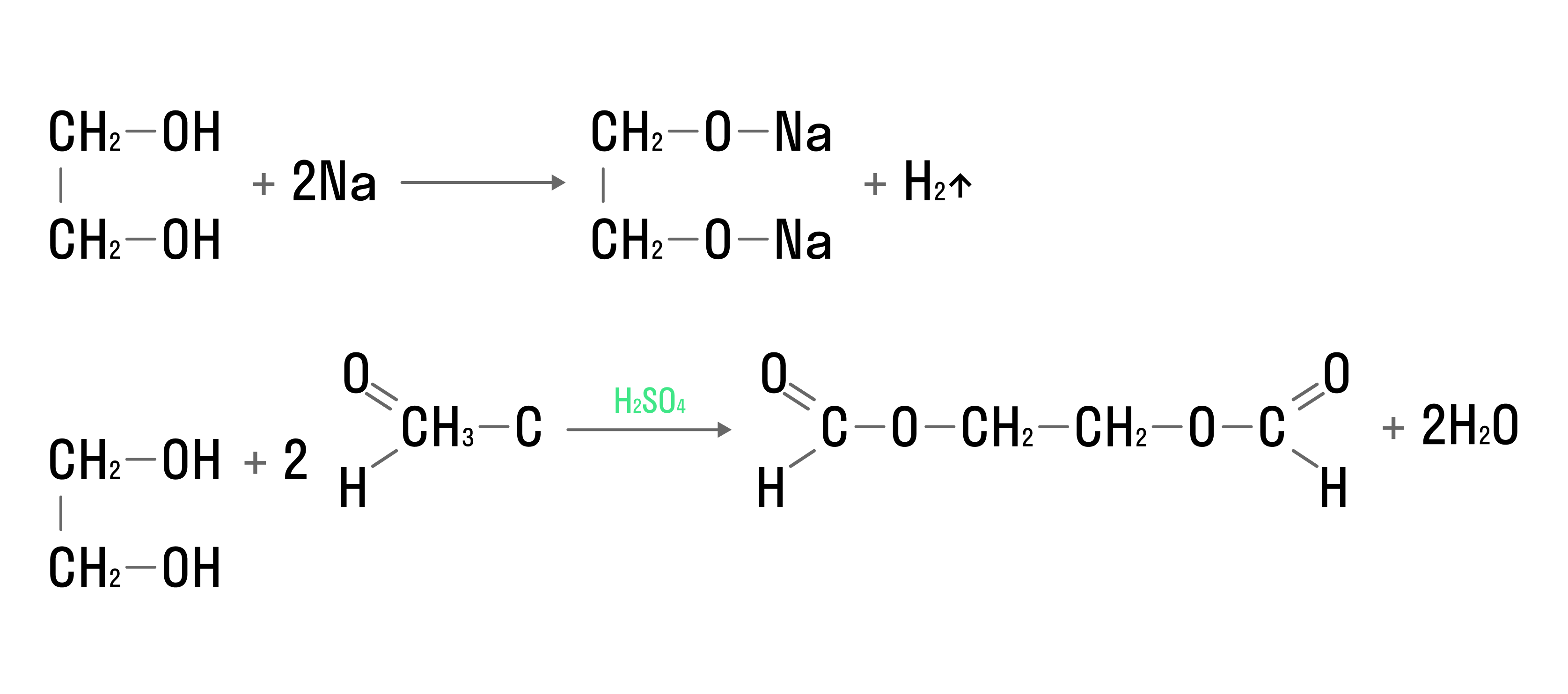
В реакциях с металлами и кислотами замещение атома водорода в гидроксогруппе будет проходить по всем функциональным группам:
Качественная реакция на многоатомные спирты — взаимодействие со свежеосажденным гидроксидом меди (II):
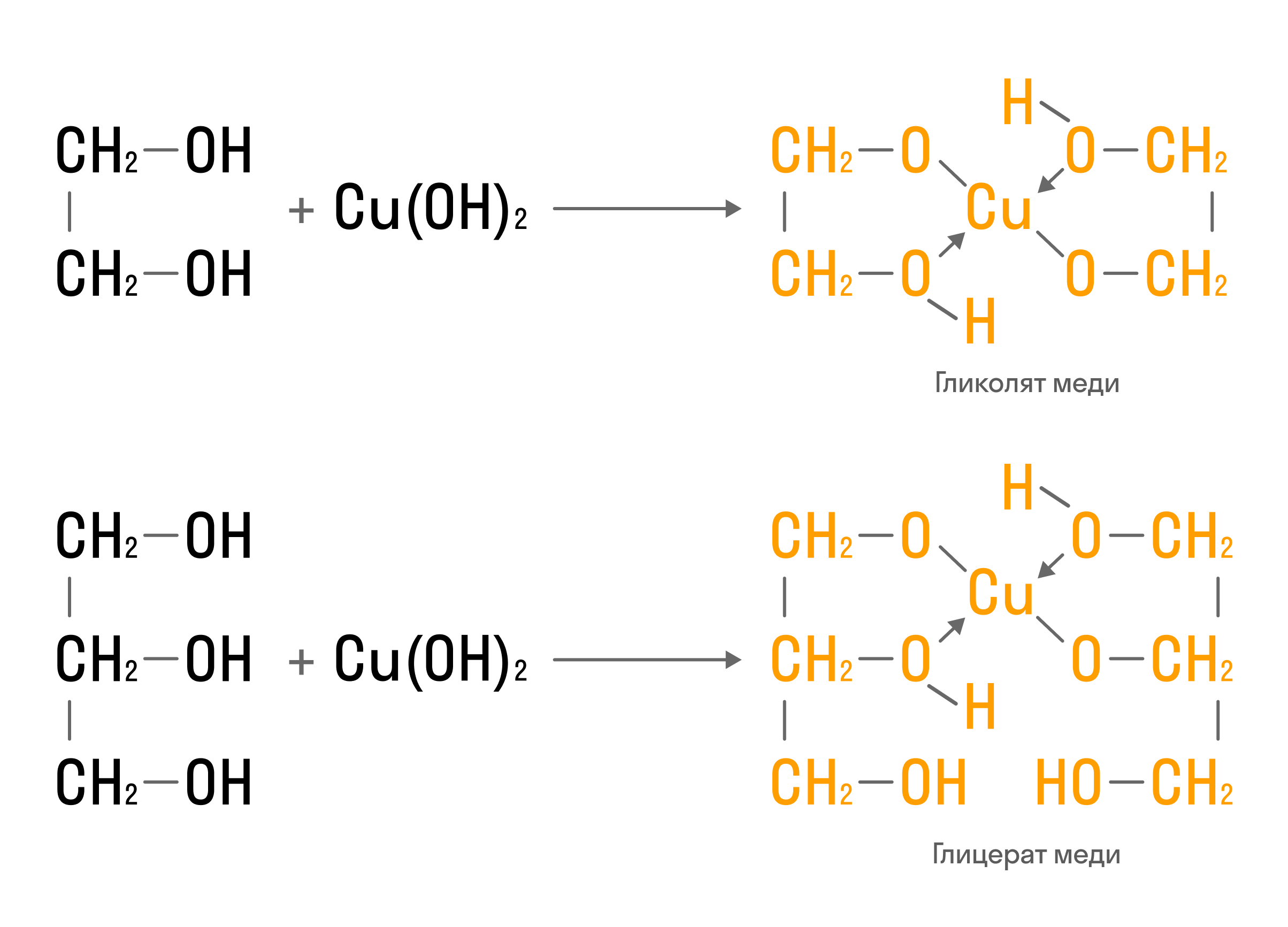
Также многоатомные спирты можно окислить йодной кислотой или ее солями:
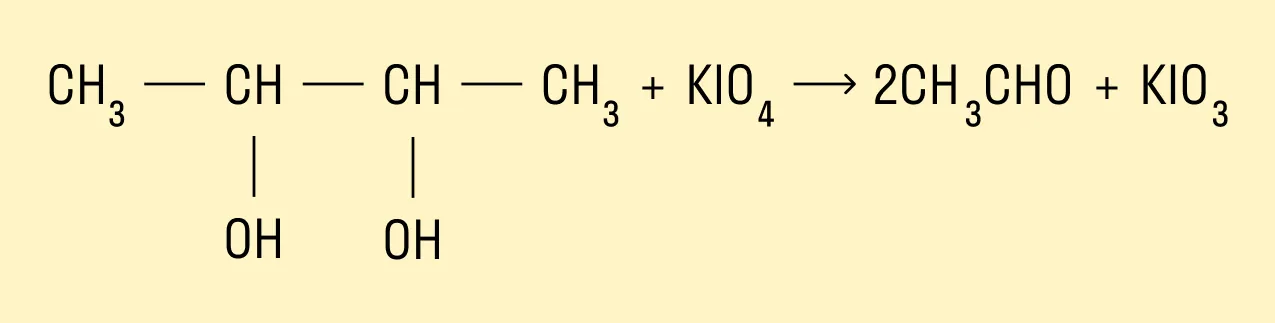

Альдегиды и кетоны
Помимо гидроксильных групп, в органических молекулах можно встретить карбонильные функциональные группы ーCНO.
Альдегиды — вещества, содержащие карбонильную группу у первого атома углерода в углеводородной цепи (RーCНO).
Кетоны — вещества, в которых карбонильная группа связана с двумя углеводородными радикалами (R1ーCOーR2).
Общая формула карбонильных соединений: CnH2nO.
Физические свойства альдегидов и кетонов
Альдегиды известны своим специфическим запахом, благодаря чему высшие альдегиды используются в парфюмерии. Агрегатное состояние альдегидов — жидкое.
Номенклатура альдегидов и кетонов
Строят названия альдегидов и кетонов так:
|
Класс |
Схема образования |
Пример вещества |
Название |
|---|---|---|---|
|
Альдегиды |
Название углеводородного радикала + суффикс «-аль» |
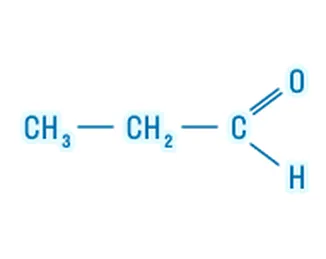 |
Пропаналь |
|
Кетоны |
Название углеводородного радикала + суффикс «-он» |
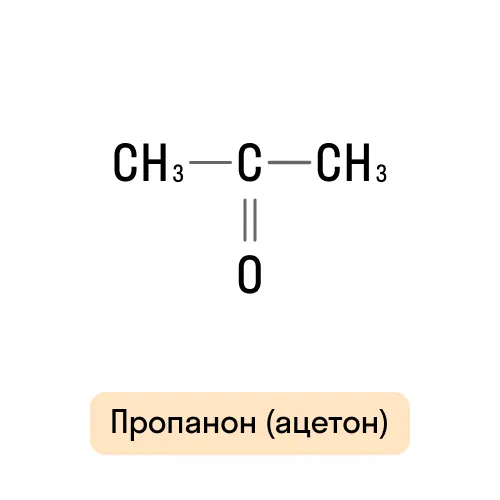 |
Пропанон, или диметилкетон |
Изомерия альдегидов и кетонов
Альдегиды и кетоны являются межклассовыми изомерами друг для друга:
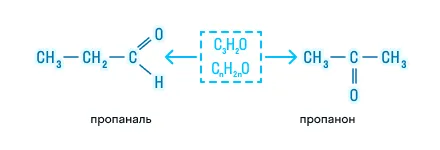
Также для них характерна изомерия углеродного скелета:
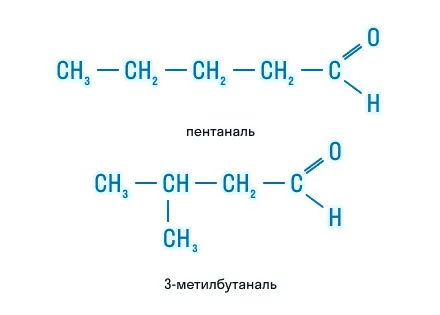
А для кетонов свойственна изомерия положения функциональной группы:
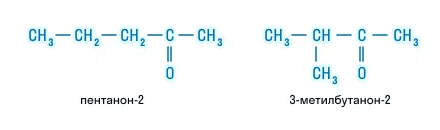
Химические свойства альдегидов и кетонов
Химические свойства альдегидов и кетонов во многом определены наличием карбонильной группы. Так, для этих кислородсодержащих молекул характерны реакции присоединения, основанные на электроотрицательности атомов.
Реакции присоединения кислот и солей:
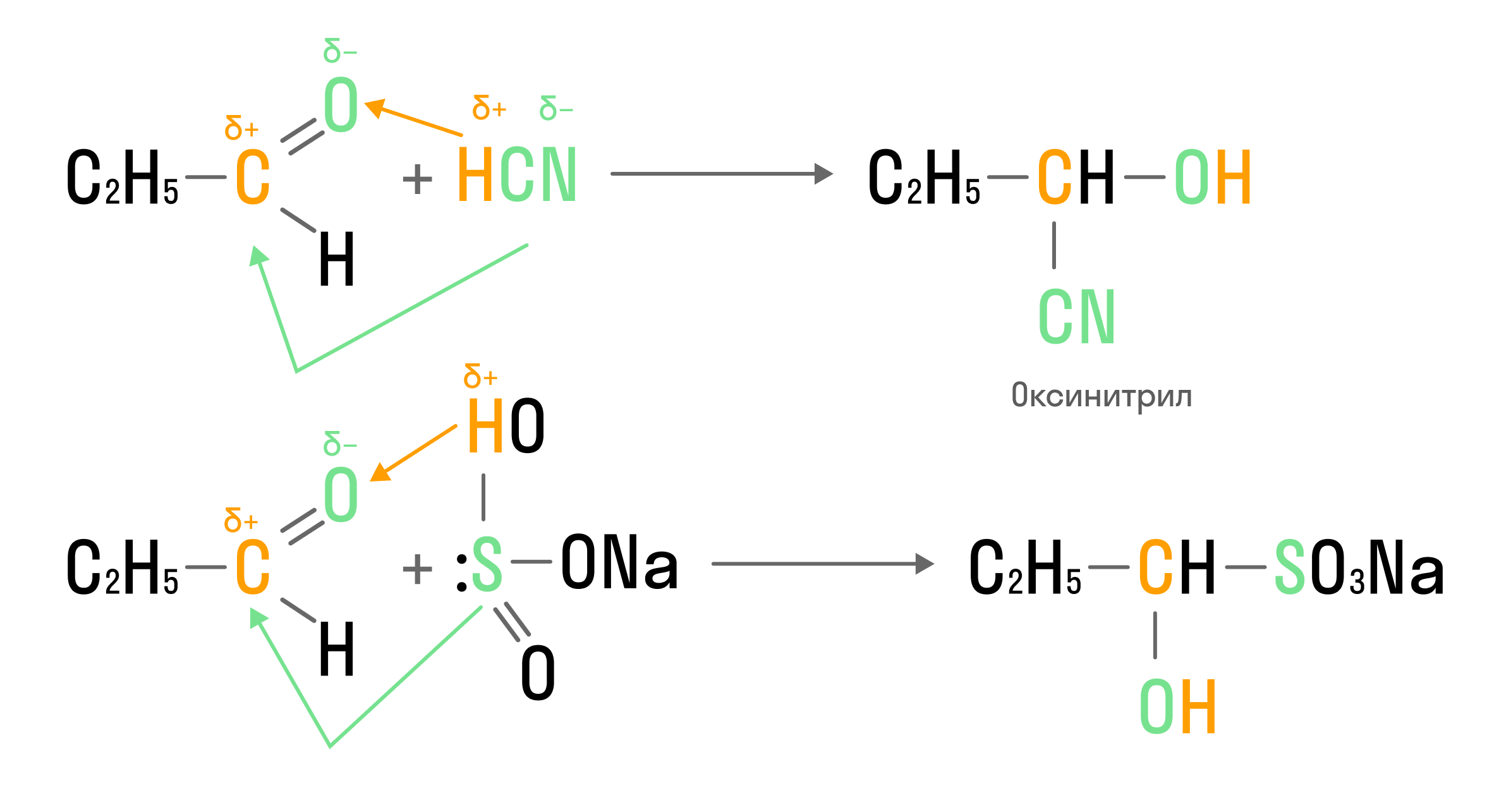
Гидрирование идет по двойной связи, реализованной между атомами углерода и кислорода в карбонильной группе:
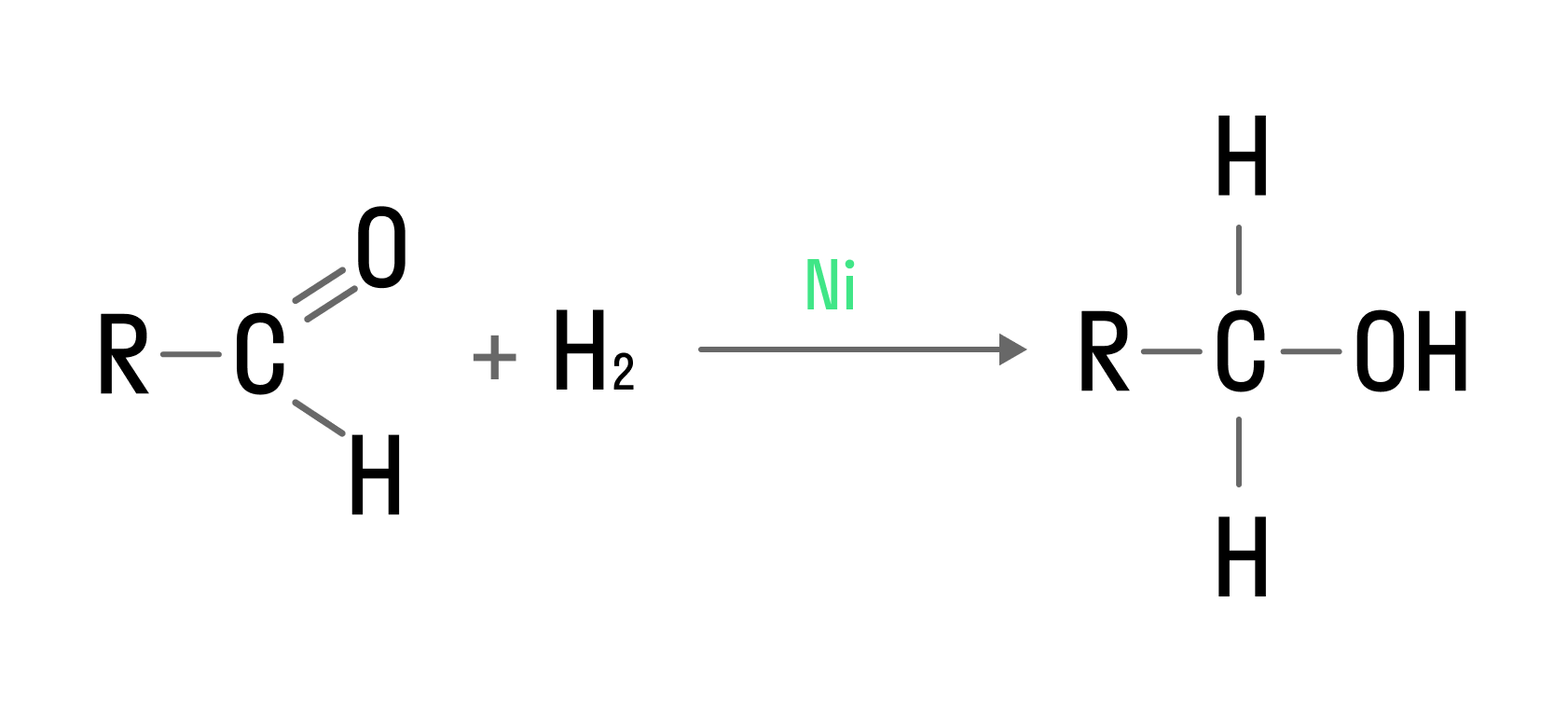
Если гидрированию подвергаются альдегиды, то продуктами реакции являются первичные спирты, если кетоны — вторичные.
Альдегиды и кетоны могут быть полностью окислены в реакции горения:
2CnH2nO + 5O2 = 2nCO2 +2nH2O
Однако кетоны, в отличии от альдегидов, никакому другому виду окисления не подвергаются.
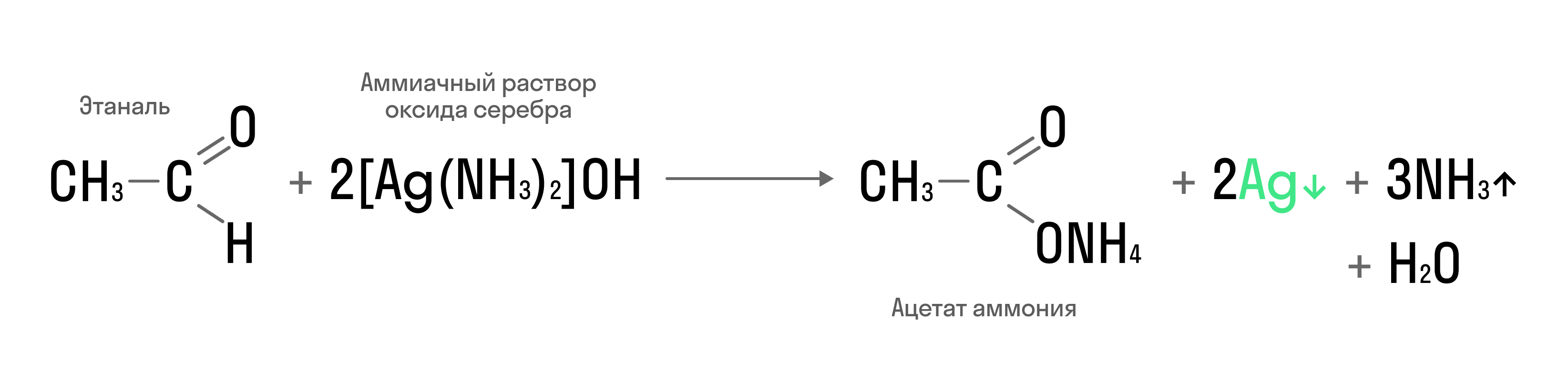
Качественная реакция на альдегиды — реакция серебряного зеркала:
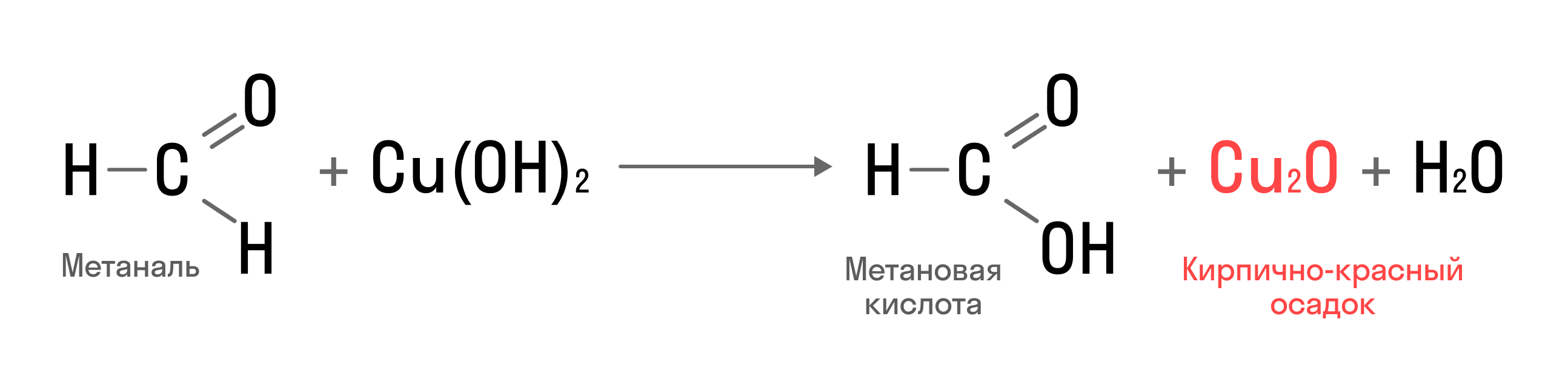
Окислить альдегиды можно и с помощью гидроксида меди (II):
Применение альдегидов и кетонов
Альдегиды и кетоны используются в медицине, фармацевтической промышленности, а также находят широкое применение в органическом синтезе.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Карбоновые кислоты
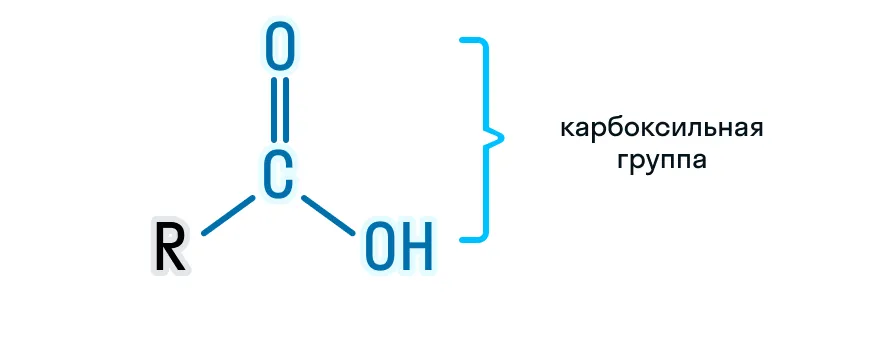
Карбоновые кислоты — это кислородсодержащие органические вещества, в состав которых входит карбоксильная группа ーCOOH.
Структурный вид карбоксильной группы:
Классификация карбоновых кислот
Как и неорганические кислоты, карбоновые разделяются по основности. Выделяют кислоты:
- Одноосновные (CH3COOH) с общей формулой CnH2nO2;
- Многоосновные — ди- и трикарбоновые кислоты с общей формулой CnH2n-2O4 (COOHCH2COOH).
По строению углеводородного радикала карбоновые кислоты бывают:
- Предельные (не имеют кратных связей);
- Непредельные (содержат кратные связи);
- Циклические;
- Ароматические.
Физические свойства карбоновых кислот
Физические свойства карбоновых кислот зависят от длины углеводородного радикала и наличия кратных связей между атомами углерода:
- Низшие (C1–C3) — жидкости с неприятным запахом;
- C4–C9 — вязкие жидкости, плохо растворимые в воде;
- Высшие карбоновые кислоты (C10–Cn) — твердые вещества, не обладающие запахом и нерастворимые в воде;
- Все ненасыщенные кислоты — жидкости;
- Дикарбоновые и ароматические кислоты при нормальных условиях являются кристаллическими веществами.
Номенклатура карбоновых кислот
Дать название одноосновным карбоновым кислотам по систематической номенклатуре можно по схеме:
Если углеводородный скелет разветвлен:
Для дикарбоновых кислот:
Широко используются и тривиальные названия карбоновых кислот:
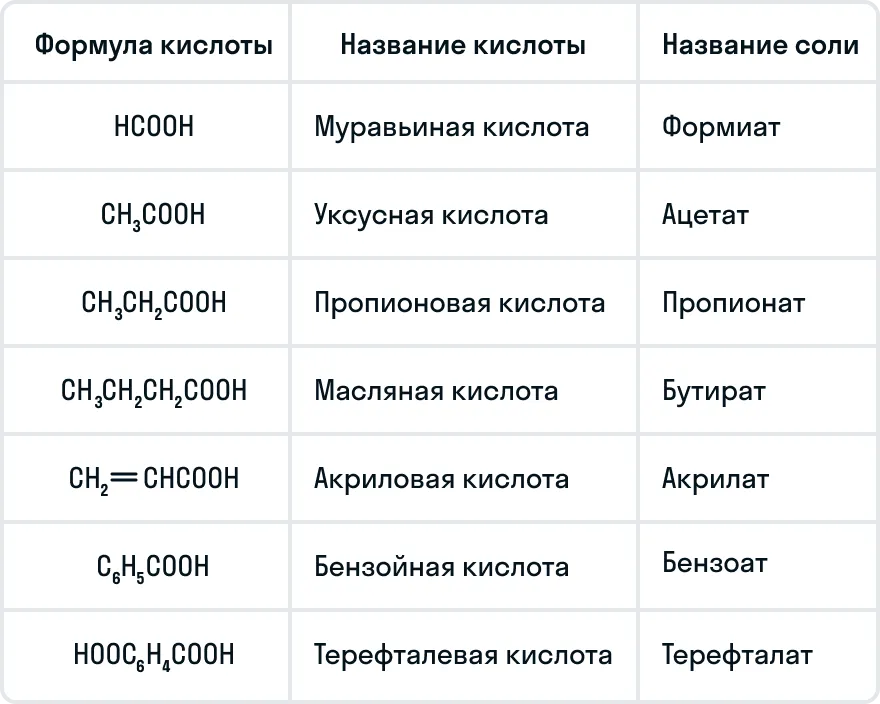
Химические свойства карбоновых кислот
Химические свойства карбоновых кислот обусловлены наличием функциональной группы ーCOOH. Так, они проявляют слабые кислотные свойства и во многом повторяют химические свойства неорганических кислот.
- Взаимодействие с активными металлами, основными оксидами и гидроксидами:
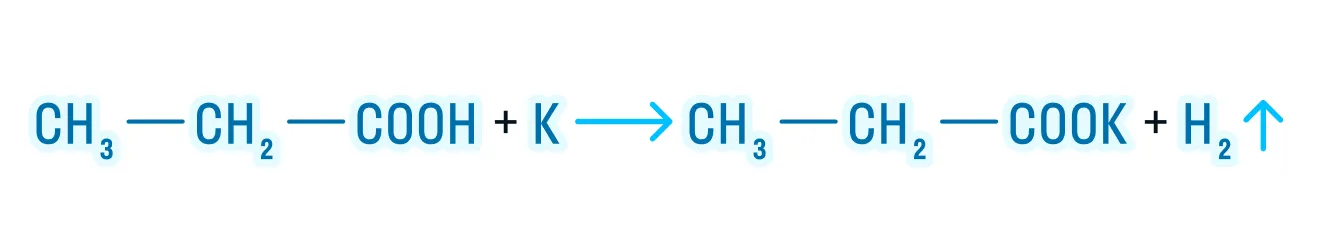
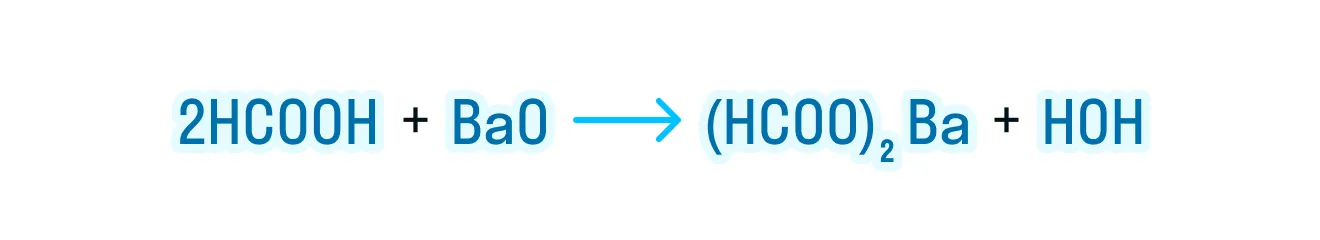
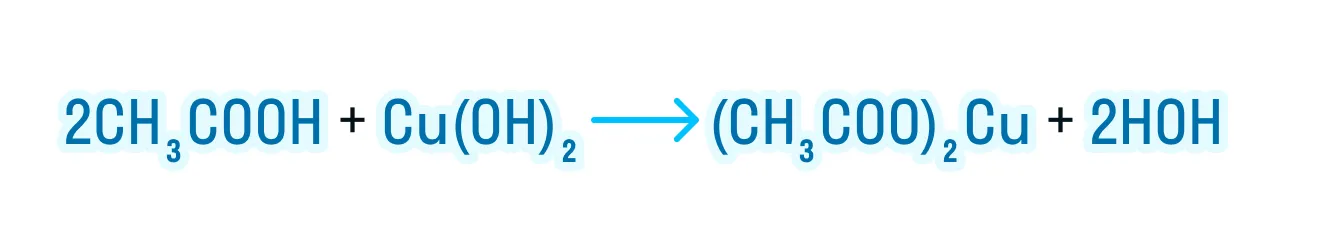
За счет наличия двух функциональных групп дикарбоновые кислоты проявляют более выраженные свойства:
HOOC—CH2—COOH + KOH → HOOC—CH2—COOK + H2O
HOOC—CH2—COOH + 2KOH → KOOC—CH2—COOK + 2H2O
- Взаимодействие с солями:
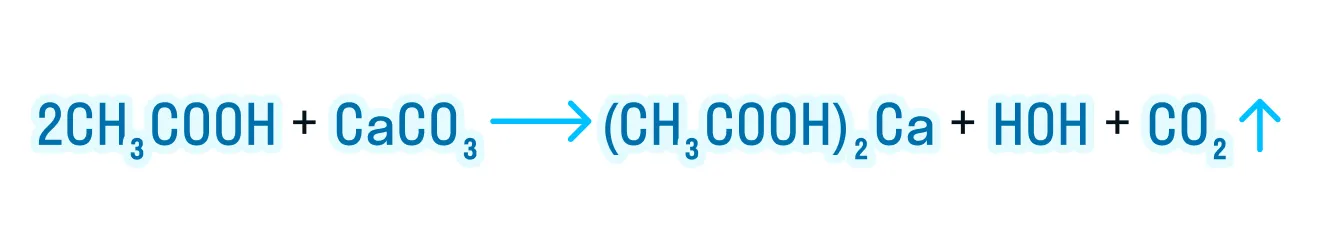
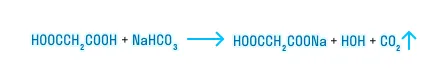
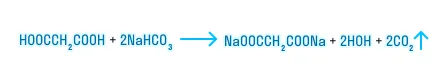
Карбоксильная группа — это своеобразный комплекс «карбонильная группа + гидроксильная группа», поэтому карбоновые кислоты вступают в реакции замещения по ーOH группе.
- Образование галогенангидридов:
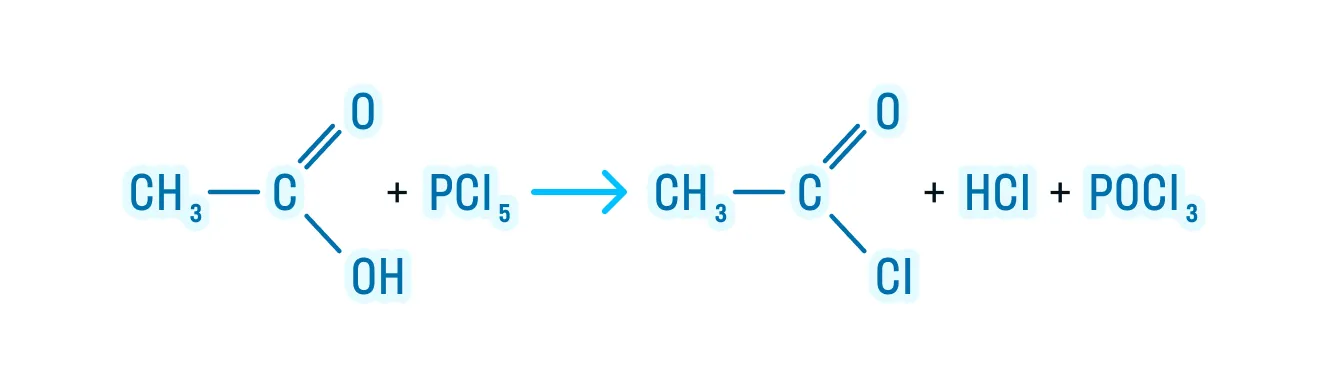
- Реакция этерификации:
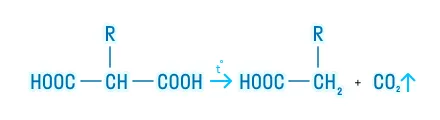
- Для дикарбоновых кислот также характерны реакции декарбоксилирования:
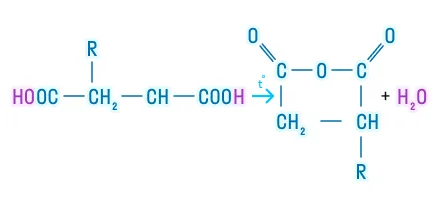
Углеводы
Один из самых обширных классов кислородсодержащих соединений — это углеводы.
Углеводы — это кислородсодержащие органические вещества, которые содержат в своем составе либо карбонильную (ーCНO) и гидроксильную (ーOH) функциональную группу, либо только гидроксильную.
Среди углеводов различают моносахариды, не способные подвергаться гидролизу, и гидролизуемые ди- и полисахариды.
Классификация простых углеводов
Моносахариды иначе называют простыми углеводами. Классифицируются они так:
|
Признак |
Пример |
|
|---|---|---|
|
По числу атомов углерода |
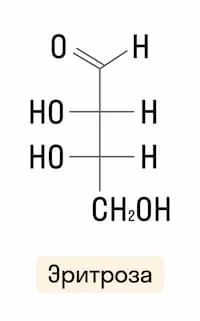
Тетрозы |
|
|
Пентозы |
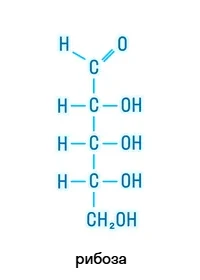 |
|
|
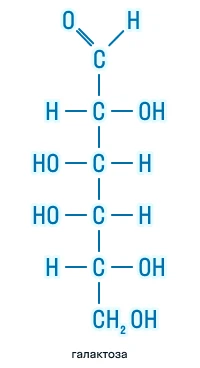
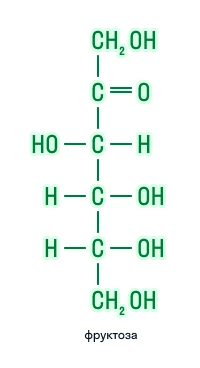
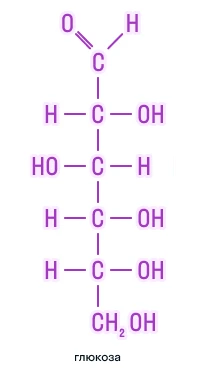
Гексозы |
|
|
|
По наличию функциональных групп |
Кетозы |
|
|
Альдозы |
|
|
Чтобы более подробно разобраться в строении молекул простых углеводов и понять, каким образом составляются их структурные формулы, рекомендуем прочитать нашу статью «Моносахариды».
Химические свойства простых углеводов
Химические свойства моносахаридов основаны на наличии той или иной функциональной группы в структуре молекулы.
- По альдегидной группе происходит окисление и восстановление:
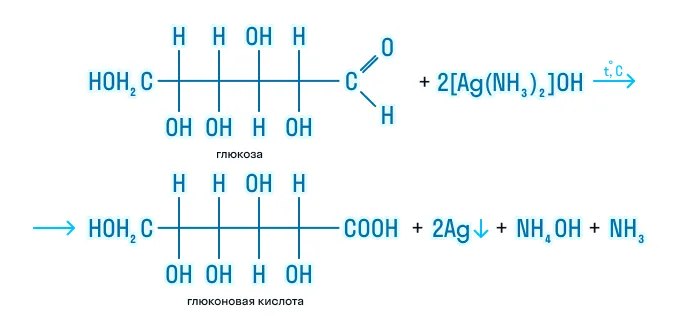
- По гидроксильной группе моносахариды взаимодействуют с активными металлами и с гидроксидами тяжелых металлов:
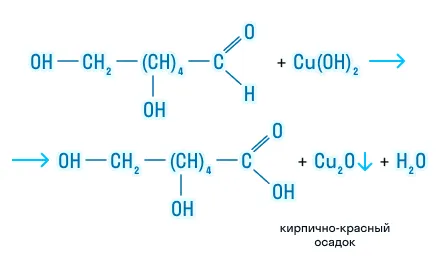
- Также для простых углеводов характерны специфические реакции — брожение:
-
Спиртовое с получением этанола
C6H12O6 → 2C2H5OH + 2CO2
-
Молочнокислое с получением молочной кислоты
C6H12O6 → 2CH3—CH(OH)—COOH
-
Маслянокислое с получением масляной кислоты
C6H12O6 → C3H7—COOH + 2CO2 + 2H2
-
Применение простых углеводов
Моносахариды применяются в пищевой промышленности, в медицине и фармации, а также при производстве зеркал.
Классификация сложных углеводов
Сложные углеводы — это молекулы, состоящие из остатков нескольких моносахаридов. Делятся они следующим образом:
|
Класс |
Свойства |
Пример |
|
|---|---|---|---|
|
Олигосахариды |
От 2 до 10 остатков моносахаридов |
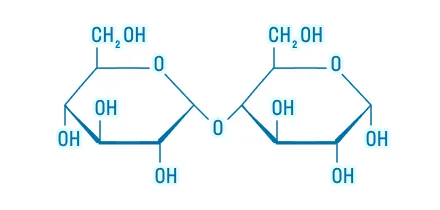
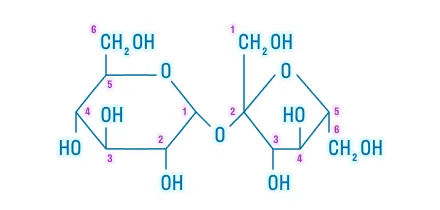
Восстанавливающие |
|
|
Невосстанавливающие |
|
||
|
Полисахариды |
От 10 остатков моносахаридов |
Крахмал, целлюлоза |
|
Химические свойства сложных углеводов
Сложные углеводы подвергаются гидролизу. Например, гидролиз сахарозы проходит так:
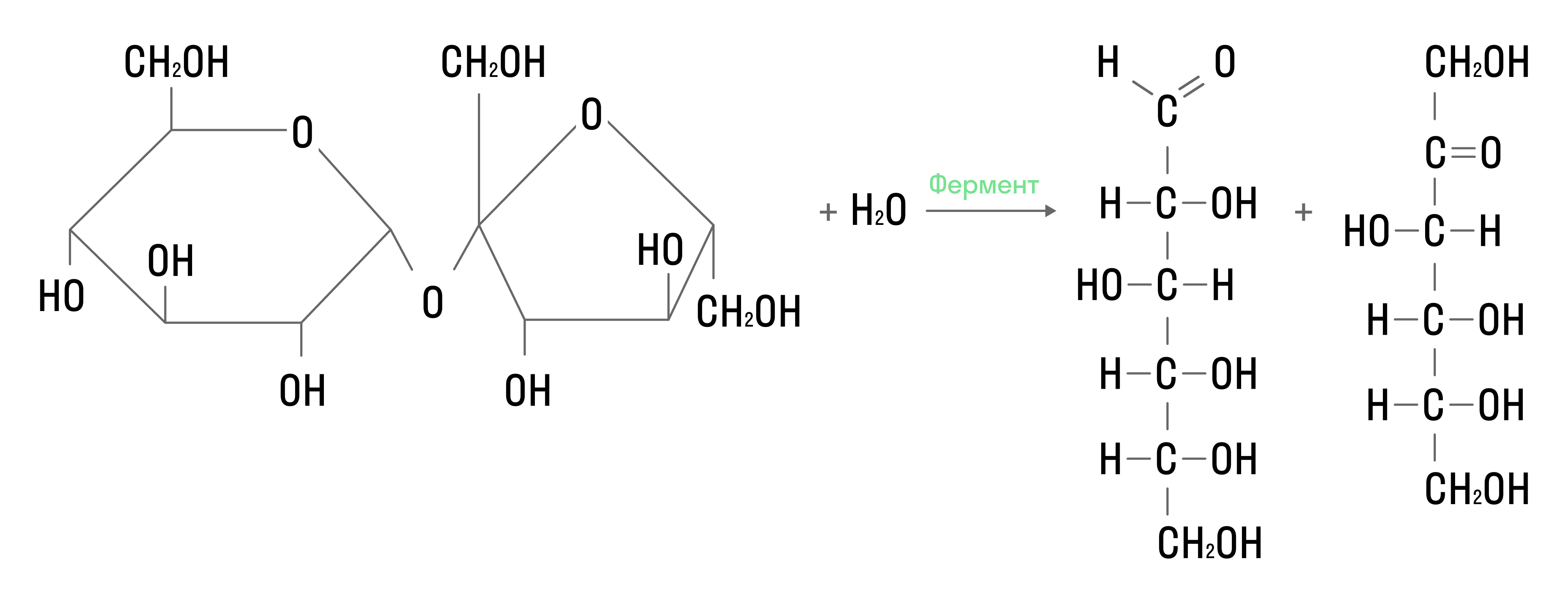
В результате реакции образуются моносахариды.
А при гидролизе полисахаридов — крахмала или целлюлозы — можно получить простой углевод — глюкозу:
Кроме того, полисахариды обладают некоторыми специфическими свойствами.
Так, целлюлоза может вступать во взаимодействие с азотной кислотой с образованием взрывоопасного вещества — тринитроцеллюлозы:
Крахмал же может вступить в качественную реакцию с йодом:
Применение сложных углеводов
Благодаря своим свойствам сложные углеводы являются важным компонентом пищевой, парфюмерной, бумажной и фармацевтической промышленности.
Чтобы хорошо сдать ЕГЭ по химии, мало знать теорию —нужно закрепить полученные знания на практике. Сделать это можно на курсах подготовки к ЕГЭ по химии в Skysmart. Здесь учеников ждут вовлекающие занятия, интересные примеры из жизни и быта, разбор всех заданий экзамена, мотивация и поддержка. Первый урок— бесплатно!