Для кого эта статья:
- студенты и школьники, изучающие химию
- практикующие химики и научные исследователи
- люди, интересующиеся основами химической науки
Простые и сложные вещества
В самой обширной базе данных по химическим веществам, исследуемых наукой, содержатся данные о более чем 125 миллионах различных соединений. Все они образованы 118 элементами Периодической системы химических элементов благодаря уникальным перегруппировкам атомов.
Если в образовании вещества участвуют атомы только одного химического элемента, то вещество считается простым. Если вещество образовано атомами нескольких различных химических элементов, то оно является сложным.

Простые и сложные вещества
К простым веществам относят, например, азот N2, кислород O2, натрий Na. Главное, чтобы вещество состояло из атомов одного элемента. Так, среди простых веществ можно встретить одноатомные молекулы (K, Fe), молекулы двухатомные (N2, Cl2, Br2, I2, F2, H2, O2), а также трех- и четырехатомные.
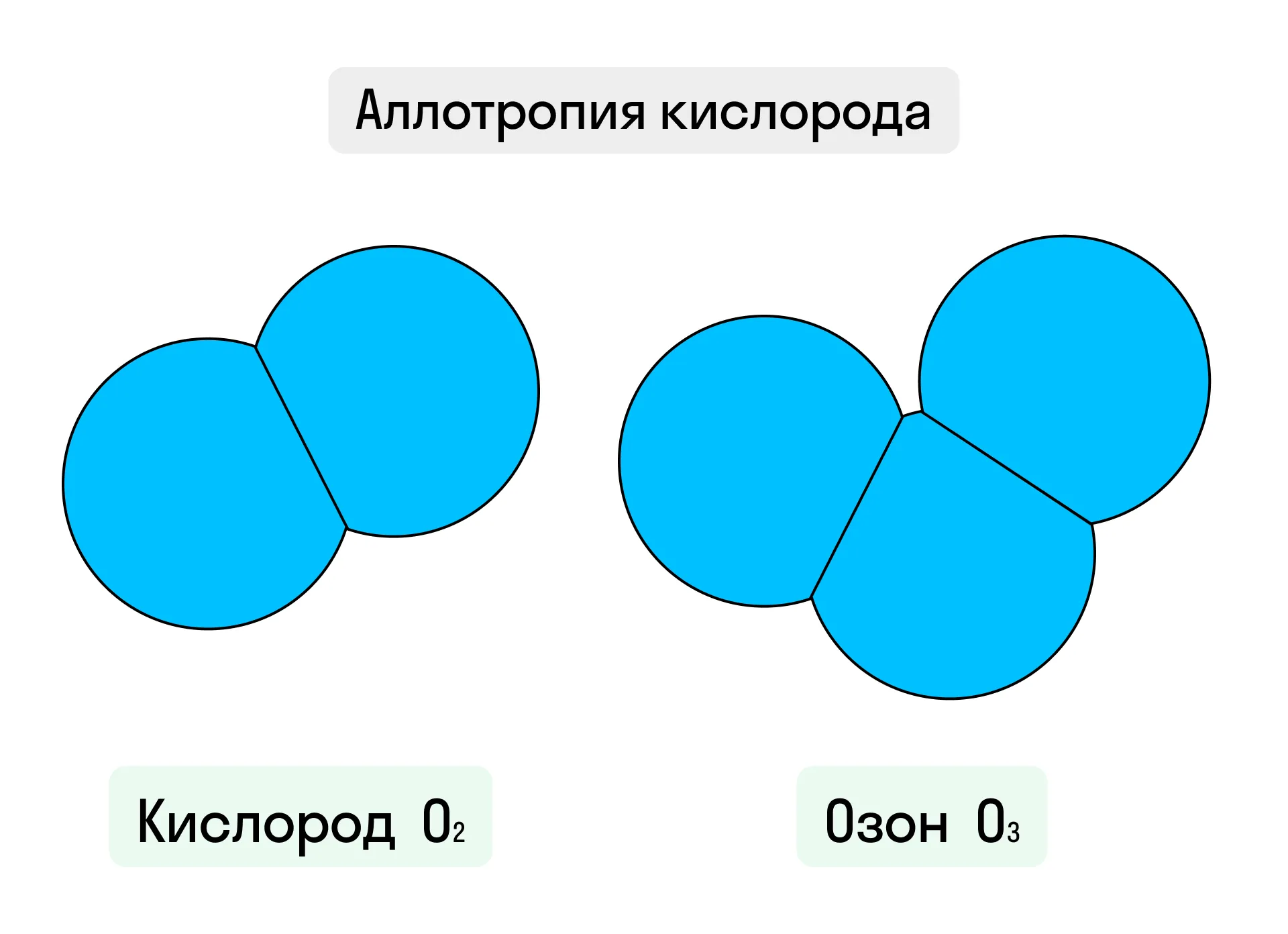
Обычно названия простых веществ аналогичны названию образовавших их химических элементов. Однако бывают случаи, когда один и тот же элемент способен образовывать несколько простых веществ. Такое явление называется аллотропией, а все созданные таким образом вещества — аллотропными модификациями. К примеру, элемент кислород может образовать две аллотропные формы: кислород O2, содержащий два атома, и озон O3, в котором три атома. Рекордсменом в аллотропии считается углерод С, который образует алмаз, графит, фуллерен и множество других простых веществ.
Простые вещества можно разделить на две группы: металлы и неметаллы. Для металлов свойственны некоторые особенности, такие как металлический блеск, тепло- и электропроводность, ковкость и пластичность. Агрегатное состояние всех металлов, помимо ртути, — твердое. Неметаллы могут быть и твердыми (кремний Si, сера S), и газообразными (кислород O2, водород H2), и жидкими (бром Br2). Они плохо проводят электрический ток и являются достаточно хрупкими.
Сложные вещества — это вещества, состоящие из атомов нескольких химических элементов (CH4, CH3COOH, Na2SO4). Разделить их можно на две крупные категории: органические и неорганические вещества.
В структуру органических веществ непременно включен атом углерода С. К ним относятся углеводороды и их производные, белки, жиры, углеводы.
К неорганическим веществам относят четыре класса: оксиды, основания, кислоты и соли. Рассмотрим детально каждый класс неорганических соединений.
Оксиды
Оксиды — это бинарные соединения, в состав которых включен атом кислорода O в степени окисления −2.
Общую формулу оксидов можно представить в виде ЭxOy, где Э — это атом металла или неметалла, x — количество атомов данного элемента, y — количество атомов кислорода.
Названия оксидов строятся так:
«Оксид» + название элемента в родительном падеже + (валентность элемента)
Отметим, что валентность в названии оксида указывается не всегда, а только в том случае, если элемент имеет переменную валентность.
- Na2O — оксид натрия;
- CuO — оксид меди (II);
- CO2 — оксид углерода (IV);
- N2O — оксид азота (I);
- Al2O3 — оксид алюминия.
По своей реакционной способности оксиды подразделяются на солеобразующие и несолеобразующие.
Несолеобразующих оксидов всего четыре:
- CO — оксид углерода (II);
- SiO — оксид кремния (II);
- NO — оксид азота (II);
- N2O — оксид азота (I).
Такие оксиды не способны вступать во взаимодействие с кислотами и основаниями и не образуют соли.
Солеобразующие оксиды делятся на три группы: основные, амфотерные, кислотные оксиды.
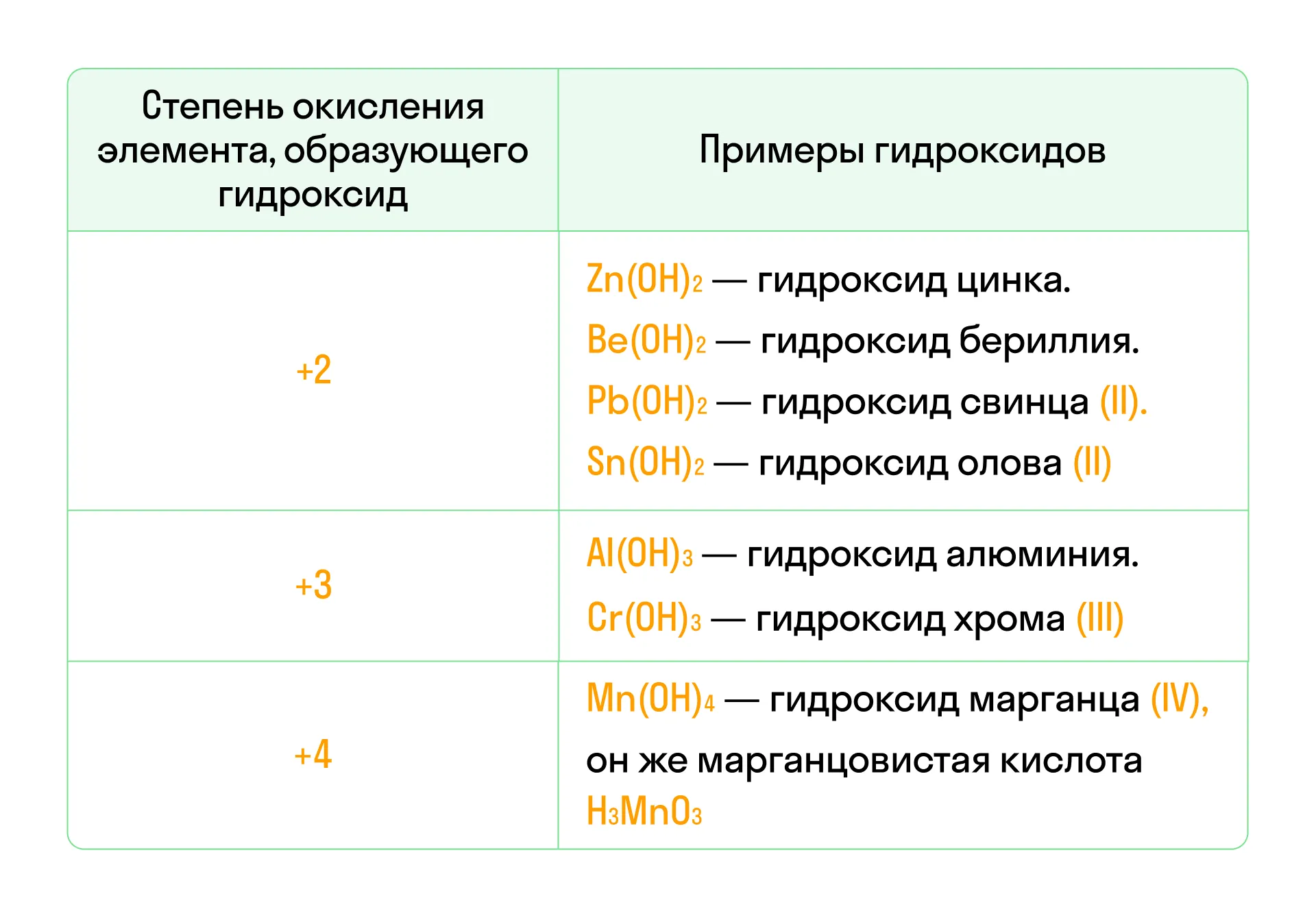
- Основные оксиды — это оксиды металлов в степени окисления +1 или +2. Им соответствуют основания в той же степени окисления. Например: CaO, MgO, Na2O. Проявляют основные свойства.
- Амфотерные оксиды — это оксиды, способные проявлять как основные, так и кислотные свойства. Образованы металлами в степени окисления +3 или +4 (Cr2O3, Fe2O3, MnO2), однако есть несколько исключений: ZnO, BeO, SnO, PbO, где степень окисления металлов равна +2. Амфотерным оксидам соответствуют амфотерные гидроксиды.
- Кислотные оксиды — это оксиды неметаллов (SO3, CO2 ) и некоторых металлов в их высшей степени окисления (Mn2O7). Им соответствуют кислоты. Важно помнить, что степень окисления элемента в оксиде и в соответствующей кислоте одинакова.
О химических свойствах оксидов можно больше узнать из статьи «Оксиды».
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Основания
Основания — это сложные вещества, состоящие из атомов металла и гидроксогруппы. Иными словами, это сложные вещества, при диссоциации которых в качестве катиона образуются ион металла, а в качестве аниона — гидроксогруппа OH−.
Общая формула имеет вид Me(OH)n, где n — количество гидроксогрупп.
Примечательно, что число гидроксогрупп равно модулю степени окисления металла, входящего в состав основания.
Названия оснований составляются по схеме:
«Гидроксид» + название металла в родительном падеже + (валентность металла)
Как и в случае с оксидами, валентность металла отмечается в случае, если она переменная.
- NaOH — гидроксид натрия;
- Cu(OH)2 — гидроксид меди (II).
Основания делятся на растворимые и нерастворимые. К растворимым основаниям относят щелочи: LiOH, NaOH, KOH, RbOH, CsOH, FrOH, Ba(OH)2, Ca(OH)2, Sr(OH)2. Примеры нерастворимых оснований: Fe(OH)2, Mg(OH)2.
Классифицировать основания также можно по кислотности, то есть по количеству гидроксогрупп. Различают однокислотные (одна группа -OH), двухкислотные (две группы -OH) и трехкислотные основания (три группы -OH). Например: гидроксид калия KOH — однокислотное основание; гидроксид стронция Sr(OH)2 — двухкислотное основание.
По способности к диссоциации основания разделяют на сильные (к ним относятся исключительно щелочи) и слабые (нерастворимые основания и гидроксид аммония).
Химические свойства оснований, а также способы их получения рассмотрены в статье «Основания».
Амфотерные гидроксиды
Вещества, взаимодействующие и с кислотами, и с основаниями — амфотерные гидроксиды.
Общая формула и названия таких соединений аналогичны основаниям: Al(OH)3 — гидроксид алюминия, Zn(OH)2 — гидроксид цинка.
Кислоты
Кислоты — это сложные вещества, состоящие из атома водорода и кислотного остатка. При диссоциации кислот в качестве катиона образуется ион водорода.
В общем виде кислоты представляют как HnA, где n — это количество атомов водорода, А — кислотный остаток.
Кислоты классифицируют по ряду признаков:
- По наличию атома кислорода кислоты делят на кислородсодержащие (HNO3) и бескислородные (HF);
- В зависимости от количества атомов водорода выделяют одноосновные (HNO2) и многоосновные кислоты (H2SO4);
- Кислоты также разделяются по устойчивости. Устойчивые кислоты способны существовать в свободном состоянии (HNO3, H2SO4, HCl), в то время как неустойчивые разлагаются на газ и воду (H2CO3 → CO2 + H2O);
- По летучести, т. е. способности быстро переходить в газообразное состояние, определяют кислоты летучие (HCl) и нелетучие (H2SO4);
- В зависимости от способности к электролитической диссоциации кислоты могут быть сильными — способными полностью диссоциировать в водных растворах и расплавах, и слабыми — распадающиеся на ионы частично. К сильным бескислородным кислотам относят HCl, HBr, HI. Силу кислородсодержащих кислот можно определить следующим образом:
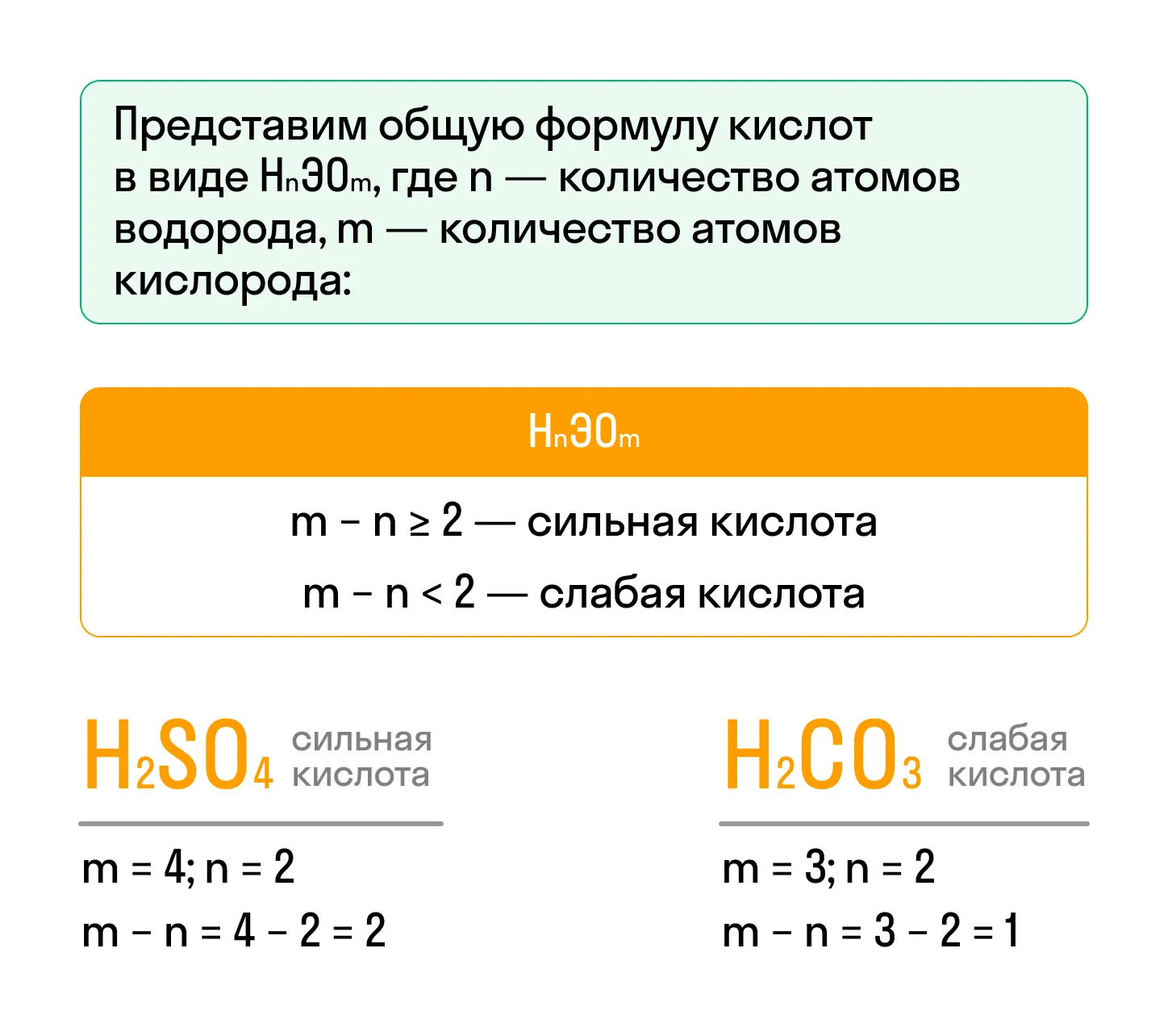
Номенклатура бескислородных и кислородсодержащих кислот различается.
Чтобы назвать бескислородную кислоту, необходимо добавить к корню русского названия элемента суффикс -о-, а потом «-водородная кислота»:
- HCl — хлороводородная кислота,
- HBr — бромоводородная кислота.
Для названия кислородсодержащей кислоты следует руководствоваться схемой:
Название кислотообразующего элемента + окончание (если элемент в высшей степени окисления, то -ная/-овая, при понижении степени окисления элемента соблюдается последовательность окончаний: -оватая → -истая → -оватистая) + слово «кислота»
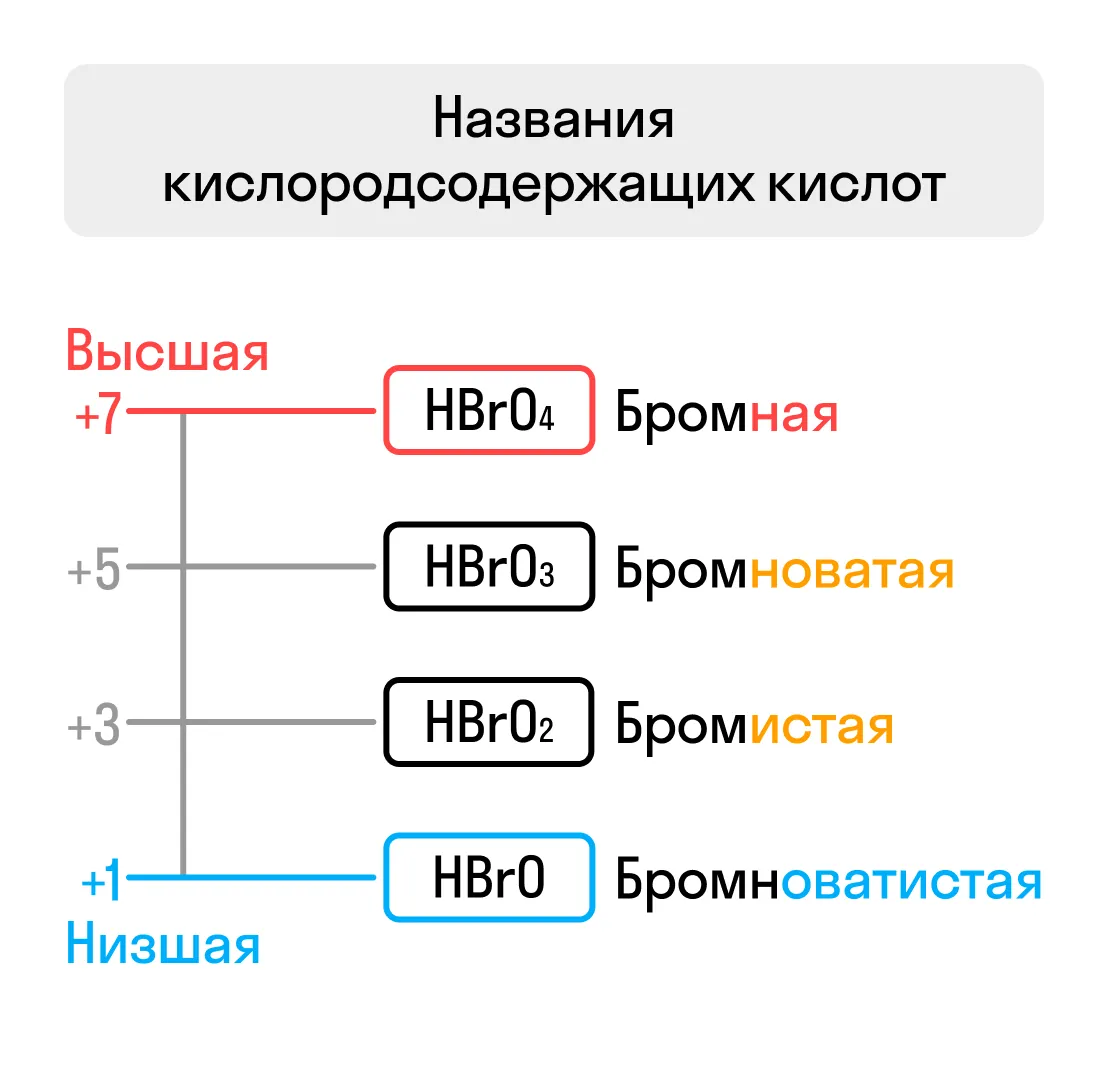
Иногда одному и тому же кислотному оксиду могут соответствовать несколько кислот. В таком случае к названию кислоты добавляются приставки:
- мета-, если в кислоте наименьшее количество атомов кислорода,
- орто-, если количество атомов кислорода максимально.
Так, оксиду кремния (IV) SiO2 соответствуют метакремниевая кислота H2SiO3 и ортокремниевая кислота H4SiO4.
Химические свойства кислот подробно рассмотрены в этой статье.
Соли
Соли — это сложные вещества, состоящие из атомов металла и кислотного остатка. С точки зрения теории электролитической диссоциации, при диссоциации солей в качестве катиона образуется ион металла, а в качестве аниона — ион кислотного остатка.
Различают следующие виды солей:
- Средние соли. Продукты полного замещения ионов H+ в кислоте катионами металлов. Например: NaCl, KNO2, CaSO4.
- Кислые соли образуются в случае неполного замещения ионов H+ в многоосновной кислоте катионами металлов: NaHSO4, Ca(HCO3)2.
- Основные соли — это продукты неполного замещения гидроксид-ионов OH- многокислотных оснований на анионы кислотных остатков: CaOHCl, Al(OH)2Cl.
- Комплексные соли, содержащие комплексные ионы: K3[Fe(CN)6] — гексацианоферрат (III) калия, Na[Al(OH)4] — тетрагидроксоалюминат натрия.
- Двойные соли, образованные катионами двух металлов и анионом одной кислоты: KAl(SO4)2 — сульфат алюминия-калия.
- Смешанные соли, образованные катионом одного металла и двумя разными анионами кислотных остатков: PbFCl — фторид-хлорид свинца (II).
Номенклатура солей зависит от вида, к которому соль относится. Так, названия средних солей строятся следующим образом:
Название кислотного остатка + название металла в родительном падеже + (валентность металла, если она переменная)
- NaCl — хлорид натрия;
- FeSO4 — сульфат железа (II).
Для кислых солей:
Приставка «гидро-» или «дигидро-» + название кислотного остатка + название металла в родительном падеже + (валентность металла, если она переменная)
- NaHCO3 — гидрокарбонат натрия;
- Cu(HS)2 — гидросульфид меди (II).
Для основных солей:
Приставка «гидроксо-» или «дигидроксо-» + название кислотного остатка + название металла в родительном падеже + (валентность металла, если она переменная)
- CaOHCl — гидроксохлорид кальция;
- Al(OH)2Cl — дигидроксохлорид алюминия.
Названия комплексных солей начинаются с обозначения комплексного иона, а затем добавляется название металла: Na3[Al(OH)6] — гексагидроксоалюминат натрия. Для двойных солей: сначала называем кислотный остаток, а затем оба металла. В названии смешанных солей наоборот: необходимо назвать оба аниона, а затем катион.
О том, какие химические свойства проявляют соли, можно узнать из статьи «Химические свойства солей».
Итак, мы рассмотрели классификацию простых и сложных соединений, встречающихся в неорганической химии. Благодаря этой классификации становится возможно глубже понять свойства и принципы взаимодействия различных веществ, что имеет важное значение для научных исследований и практического применения в различных областях.
Пора проверить себя
Кислотным оксидом является:
- CaO
- CO
- CO2
- Al2O3
Гидроксид меди (II) — это…
- KOH
- CuOH
- Ca(OH)2
- Cu(OH)2
Двухосновной бескислородной кислотой является:
- H2S
- HNO3
- HCl
- H2SO4
К кислым солям относят:
- KNO2
- Ca(HCO3)2
- Al(OH)2Cl
- Na3[Al(OH)6]
Ответы
1 — c, 2 — d, 3 — a, 4 — b.