Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Для кого эта статья:
- студенты и школьники, изучающие химию
- специалисты в области химии и материаловедения
- люди, интересующиеся свойствами металлов и химическими реакциями
Ряд активности металлов
| Li, K, Na, Ca, Ba | Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb | H2 | Cu, Hg, Ag, Pt, Au |
Советуем прочитать нашу статью о теории Бутлерова, которая подробно объясняет химическое строение органических соединений.
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
4Li + O2 = 2Li2O
натрий образует пероксид
2Na + O2 = Na2O2
калий, рубидий и цезий — надпероксид
K + O2 = KO2
Остальные металлы с кислородом образуют оксиды:
2Mg + O2 = 2MgO
2Al + O2 = Al2O3
2Zn + O2 = 2ZnO (при нагревании)
4Cr + 3O2 = 2Cr2O3
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
4Fe + 3O2 (воздух) + 6H2O(влага) = 4Fe(OH)3
С галогенами металлы образуют галогениды:
2Na + Cl2 = 2NaCl
Mg + Cl2 = MgCl2
2Al + 3Br2 = 2AlBr3
Zn + Cl2 =ZnCl2
2Cr + 3Cl2 = 2CrCl3
Медный порошок реагирует с хлором и бромом (в эфире):
Cu + Cl2 = CuCl2
Cu + Br2 = CuBr2
При взаимодействии с водородом образуются гидриды:
2Na + H2 = 2NaH
Ca + H2 +СaH2
Zn + H2 =ZnH2
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
2K + S = K2S
Сa + S = CaS
2Al + 3S = Al2S3
2Cr + 3S = Cr2S3
Cu +S = CuS
Реакции с фосфором протекают до образования фосфидов (при нагревании):
3K + P = K3P
3Mg + 2P = Mg3P2
3Zn + 2P = Zn3P2
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li2C2
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
Ca + 2C = CaC2
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N2 = 2Li3N
3Mg + N2 = Mg3N2
2Al + N2 = 2AlN
2Cr + N2 = 2CrN
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
2Li + 2H2O = 2LiOH + H2
Ca + 2H2O = Ca(OH)2 + H2
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Cr + H2O = Cr2O3 + H2
Zn + H2O = ZnO + H2
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
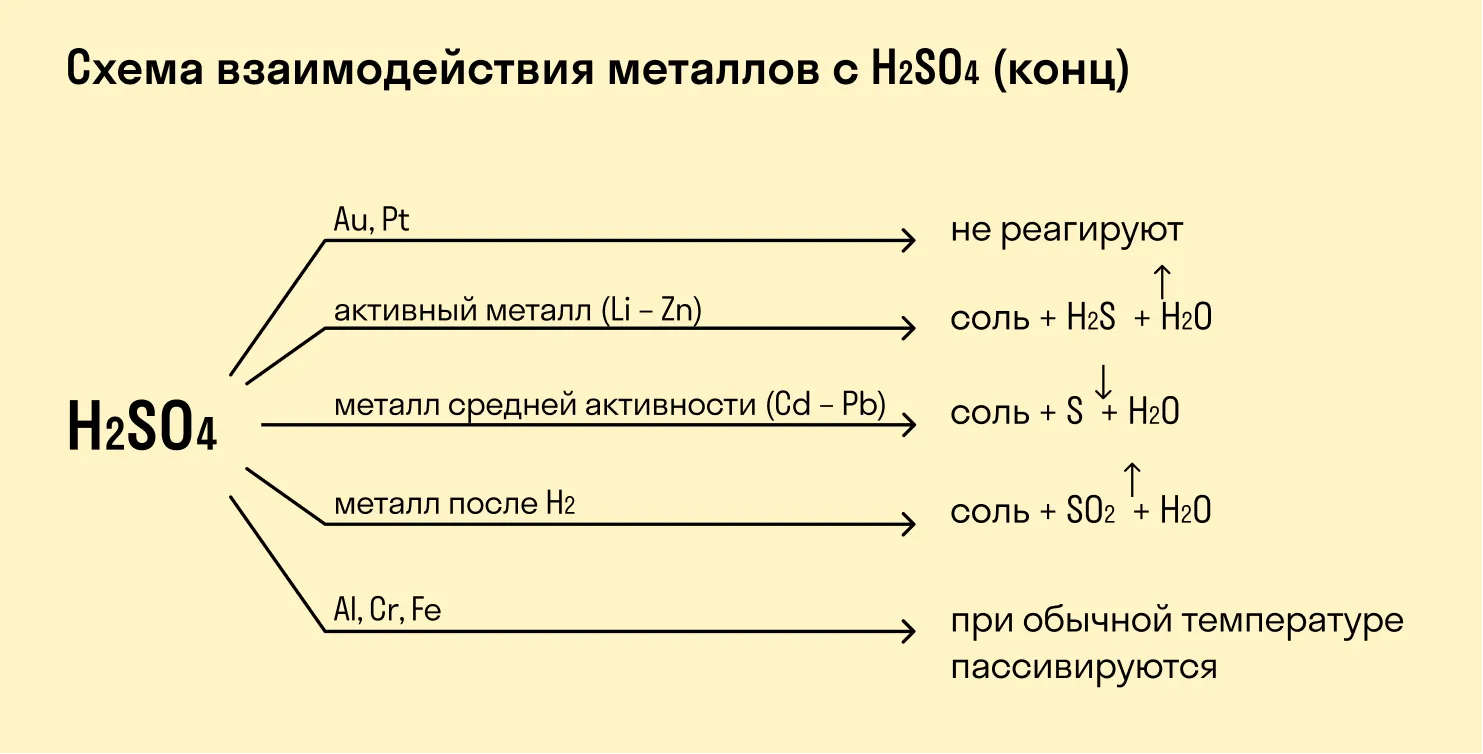
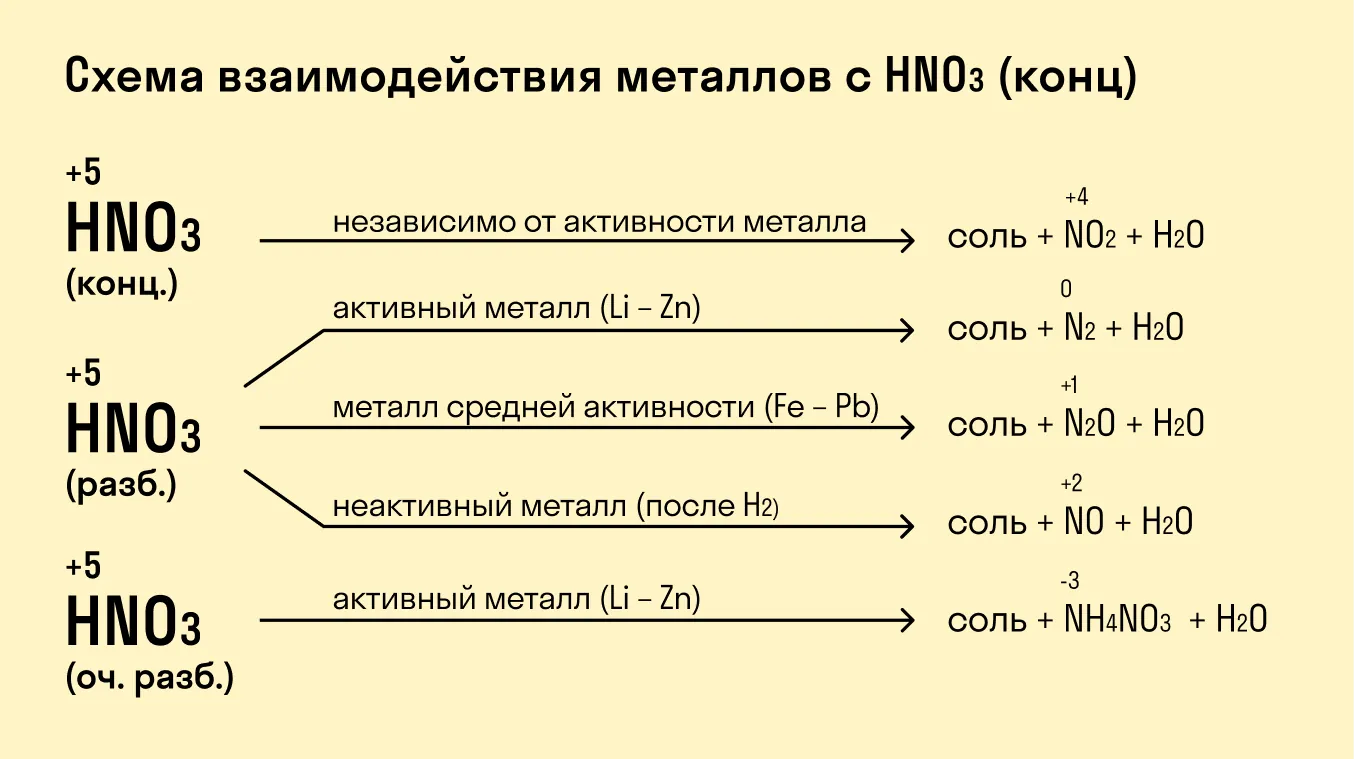
Металлы IА группы:
2K + H2SO4 (раствор) = K2SO4 + H2
8K + 5H2SO4 (конц) = 4K2SO4 + H2S + 4H2O
8Na + 10HNO3 (раствор) = 8NaNO3 + NH4NO3 + 3H2O
3Na + 4HNO3 (конц) = 3NaNO3 + NO + 2H2О
Металлы IIА группы
Mg + H2SO4 (раствор) = MgSO4 + H2
4Mg + 5H2SO4 (конц) = 4MgSO4 + H2S + 4H2O
Mg+ 4HNO3 (конц) = Mg(NO3)2 + 2NO2 + 2H2O
4Mg + 10HNO3 (раствор) = 4Mg(NO3)2 + 2N2O + 5H2O
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
2Li + 2NH3 = 2LiNH2 + H2
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
2Na + 2C2H5OH = 2C2H5ONa + H2
2K + 2C6H5OH = 2C6H5OK + H2
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
При изучении химических свойств металлов важно учитывать их реакции с разными видами оксидов. Например, металлы часто взаимодействуют с основными оксидами, образуя соли и выделяя газы.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
8Al + 3Fe3O4 = 4Al2O3 + 9Fe (алюмотермия)
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Li, K,Ca, Na, |
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb |
H2 |
Cu, Hg, Ag, Pt, Au |
|
|---|---|---|---|---|
Восстановительная способность металлов в свободном состоянии |
|
|||
Взаимодействие металлов с кислородом |
Быстро окисляются при обычной температуре |
Медленно окисляются при обычной температуре или при нагревании |
Не окисляются |
|
Взаимодействие с водой |
Выделяется водород и образуется гидроксид |
При нагревании выделяется водород и образуются оксиды |
Водород из воды не вытесняют |
|
Взаимодействие с кислотами |
Вытесняют водород из разбавленных кислот (кроме HNO3) |
Не вытесняют водород из разбавленных кислот |
||
Реагируют с концентрированными азотной и серной кислотами |
С кислотами не реагируют, растворяются в царской водке |
|||
Взаимодействие с солями |
Не могут вытеснять металлы из солей |
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей |
||
Взаимодействие с оксидами |
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов |
|||