Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Для кого эта статья:
- Читатели, интересующиеся темой статьи
- Специалисты в данной области знаний
- Студенты или школьники, стремящиеся углубить свои знания
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Малодиссоциирующие (слабые): H2CO3, H2SO3, H2SiO3.
H2SO4 = H+ +HSO4−
HSO4− = H+ + SO42−

Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
H2CO3 = CO2 + H2O
2HCl = H2 + Cl2
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

Mg + 2HCl = MgCl2 + H2
Zn + H2SO4 = ZnSO4 + Н2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
|
Na |
Mg |
Al |
Zn |
Fe |
Cu | |
|---|---|---|---|---|---|---|
HNO3(разб) |
NaNO3 + NH4NO3 +H2O |
Mg(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O |
Al(NO3)3 + в зависимости от разбавления кислоты N2O, NH4NO3 + H2O |
Zn(NO3)2 + в зависимости от концентрации +NO2, NO, N2O, N2, NH4NO3 + H2O |
Fe(NO3)3 + NO + H2O |
Cu(NO3)2 + NO + H2O |
HNO3(конц) |
NaNO3 + N2O + H2O |
На холоду — пассивация |
На холоду — пассивация |
Cu(NO3)2 + NO2 + H2O |
||
H2SO4(разб) |
Na2SO4 + H2 |
MgSO4 + H2 |
При нагревании Al2(SO4)3 + H2 |
ZnSO4 + H2 |
При нагревании FeSO4 +H2 |
Реакция не проходит |
H2SO4(конц) |
Na2SO4 + H2S + H2O |
MgSO4 + H2S + H2O |
На холоду — пассивация |
ZnSO4 + SO2 + H2O |
На холоду — пассивация |
CuSO4 + SO2 + H2O |
При нагревании Al2(SO4)3 + SO2 + H2O |
При нагревании ZnSO4 +H2S + H2O |
При нагревании Fe2(SO4)3 + SO2 + H2O |
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Fe(OH)2 + 2HBr → FeBr2 + 2H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Сильные кислоты – это кислоты, которые полностью диссоциируют в воде, обеспечивая высокую концентрацию ионов H+.
Примеры сильных кислот:
- соляная кислота (HCl)
- бромоводородная кислота (HBr)
- иодоводородная кислота (HI)
- хлорная кислота (HClO₄)
- серная кислота (H₂SO₄)
- азотная кислота (HNO₃)
H2SO4 + BaCl2 = BaSO4↓ + HCl
HCl + CaCO3 = CaCl2 + H2O + CO2
Узнать больше о взаимодействии кислот и солей можно из статьи «Соли в химии».
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
ZnO + H2SO4 → ZnSO4 + H2O
2HCl + MgO = MgCl2 + H2O
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
4HCl + MnO2 =MnCl2 + Cl2 + 2H2O
14HBr + K2Cr2O7 = 2CrBr3 + 3Br2 + 2KBr + 7H2O
16HI + 2KMnO4 = 2MnI2 + 5I2 + 2KI + 8H2O
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
6HI + Fe2O3 = 2FeI2 + I2 + 3H2O
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
2H2S + SO2 = 3S + 2H2O
Взаимодействие кислот с углекислым газом может привести к образованию новых соединений — сложных веществ. Подробнее о том, что такое сложные вещества, можно узнать в нашей статье «Простые и сложные вещества в химии. Что это такое?».
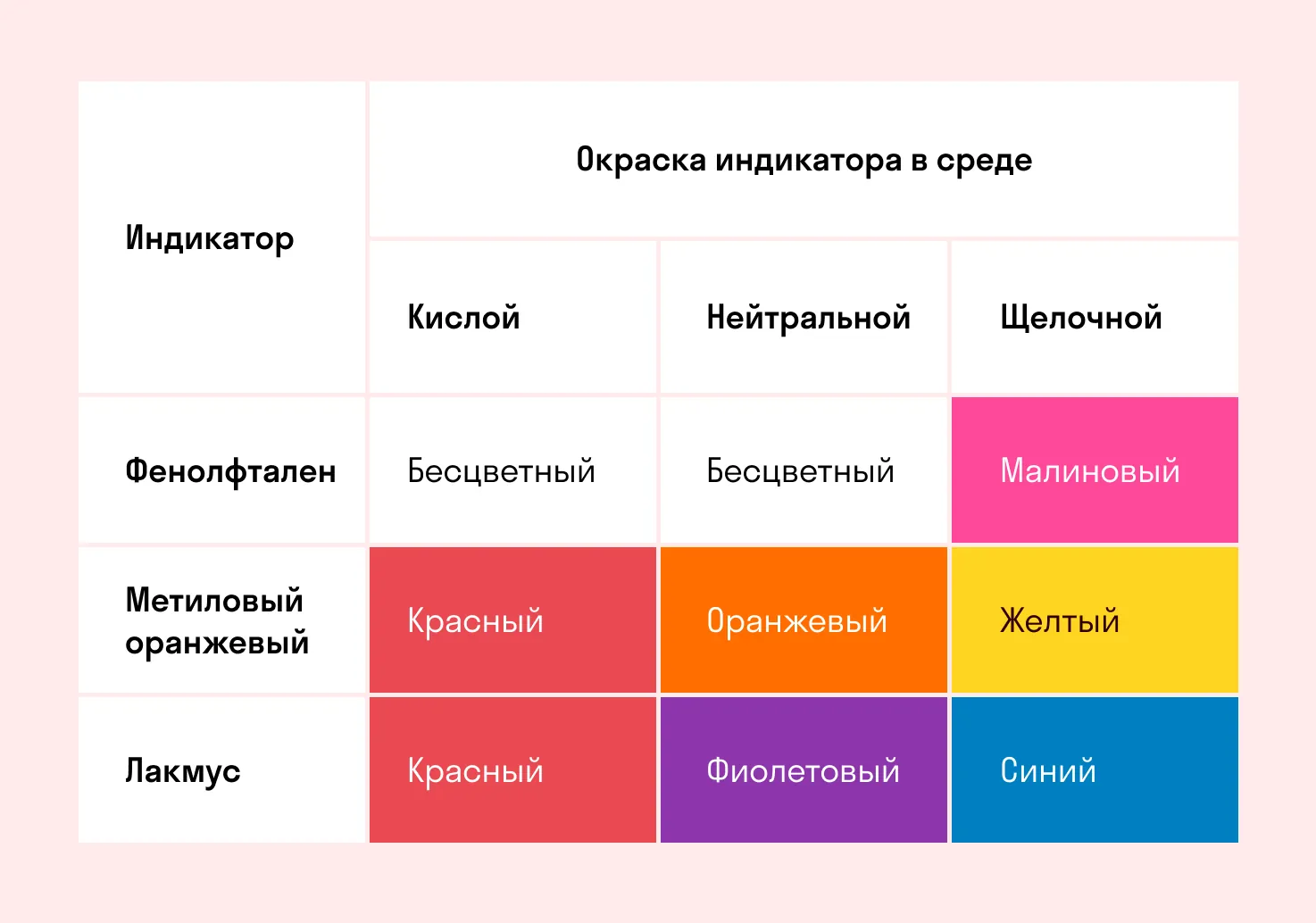
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Ca + HCl
Na + H2SO4
CaO + HNO3
Fe2O3 + H2SO4
KOH + HNO3
Al(OH)3 + HF
HNO3 + CaCO3
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
а. водой и цинком;
б. магнием и оксидом серы (IV);
в. железом и оксидом кальция;
г. сульфатом натрия и углеродом.