Для кого эта статья:
- Студенты или школьники, изучающие химию
- Специалисты и профессионалы в области химии и биохимии
- Любители науки, интересующиеся органической химией
Что такое амины
Примем во внимание, что амины — производные аммиака, значит, они должны либо быть очень схожи по строению, либо повторять его полностью. Ниже на картинке можно рассмотреть строение аммиака и первичного амина:
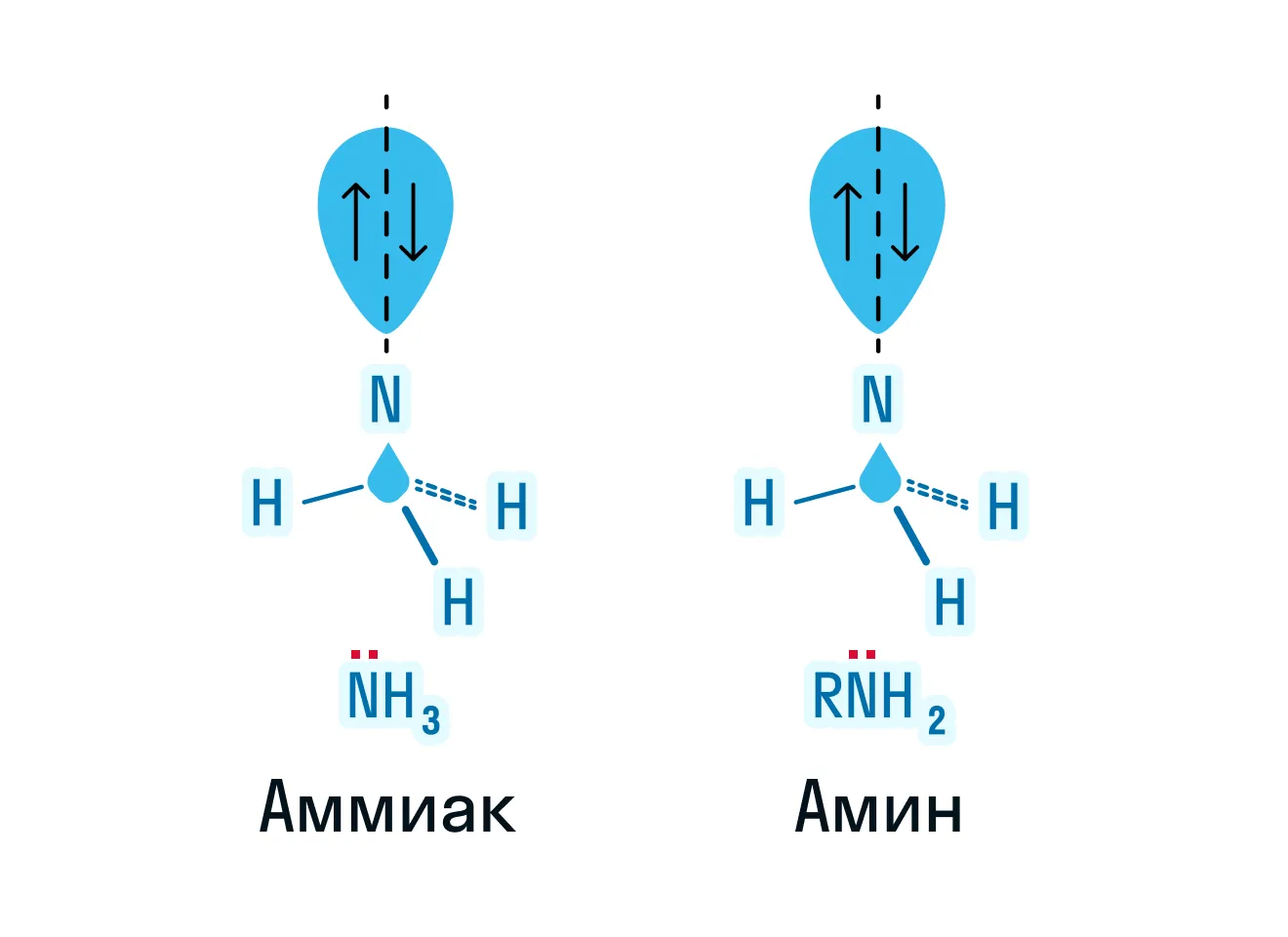
Обратим внимание на то, что в строении обеих молекул есть азот с неподеленной электронной парой, из-за чего амины обладают осно́вными свойствами. Теперь обратимся к пространственной формуле аммиака и представителя первичных аминов — метиламина.
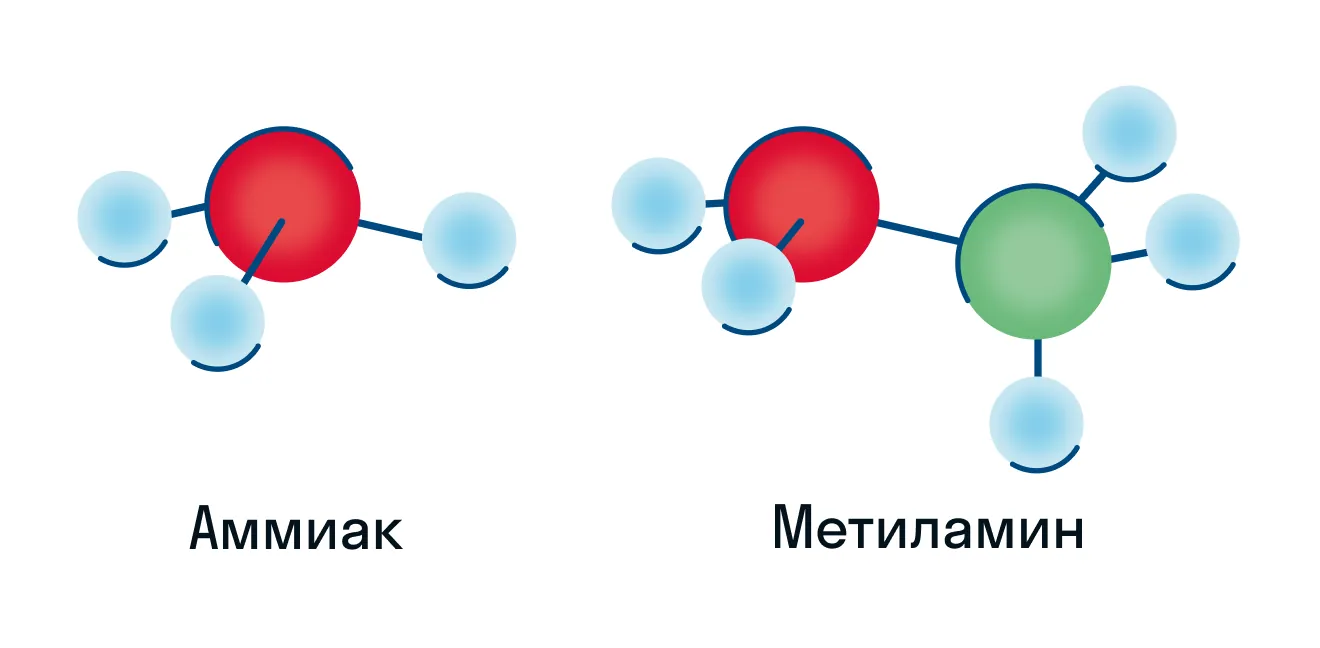
На основе пространственной формулы можно сделать вывод, что обе эти молекулы имеют форму тетраэдра, что подтверждает нам sp3-гибридизацию атома азота.

Классификация аминов
Амины разделяют по двум основным категориям:
число углеводородных групп у атома азота;
природа углеводородных заместителей.
Рассмотрим каждую более подробно.
По числу углеводородных групп
По числу углеводородных групп, которые заместили водород в молекуле аммиака, амины делятся на первичные, вторичные и третичные. Тут возникает аналогия с классификацией одноатомных спиртов. Она четко дает понять, что в других классах органических веществ такая классификация означает положение функциональной группы у атомов углерода. Но в случае аминов все иначе. Если на какой-либо радикал замещен один водород, то это первичный амин. При замещении двух водородов амин становится вторичным. Если в молекуле аммиака вообще не остается водородов, только один азот, то такие амины называют третичными.
Сравним две молекулы:
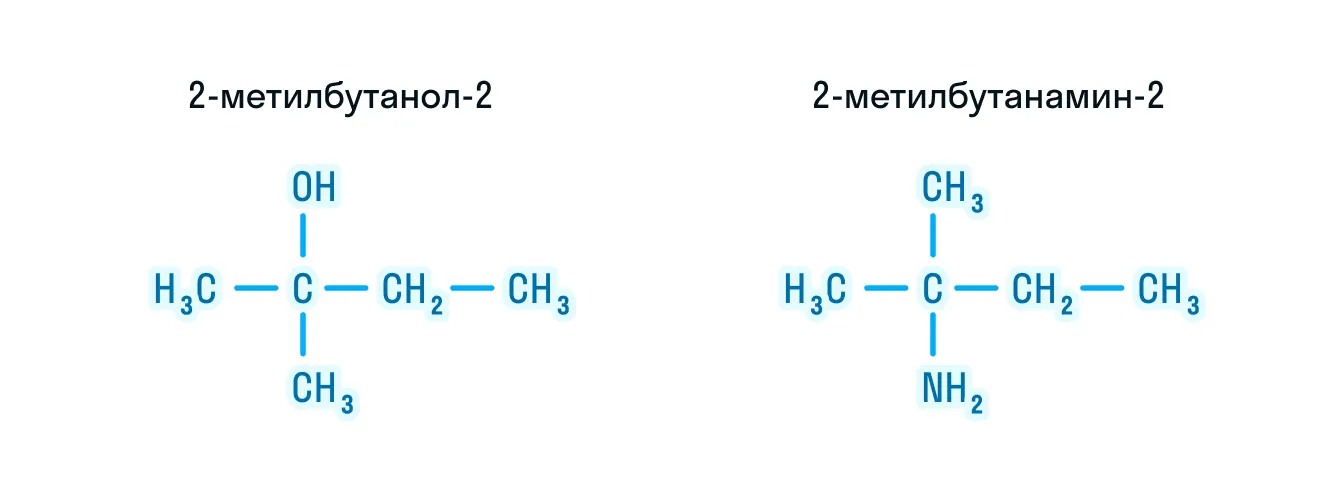
Единственное, чем они отличаются, это наличие разных функциональных групп: у молекулы слева имеется гидроксогруппа, а у молекулы справа — аминогруппа. Спирт будет третичным, так как функциональная группа находится у третичного атома углерода. В то же время амин будет первичным, так как у него замещен один атом водорода на довольно разветвленный углеводородный радикал.
По природе углеводородных заместителей
По природе углеводородных заместителей амины бывают алифатическими, ароматическими, смешанными, алициклическими и гетероциклическими. В последних двух пока что будет сложно разобраться. Давайте пропустим их и рассмотрим в другой раз.
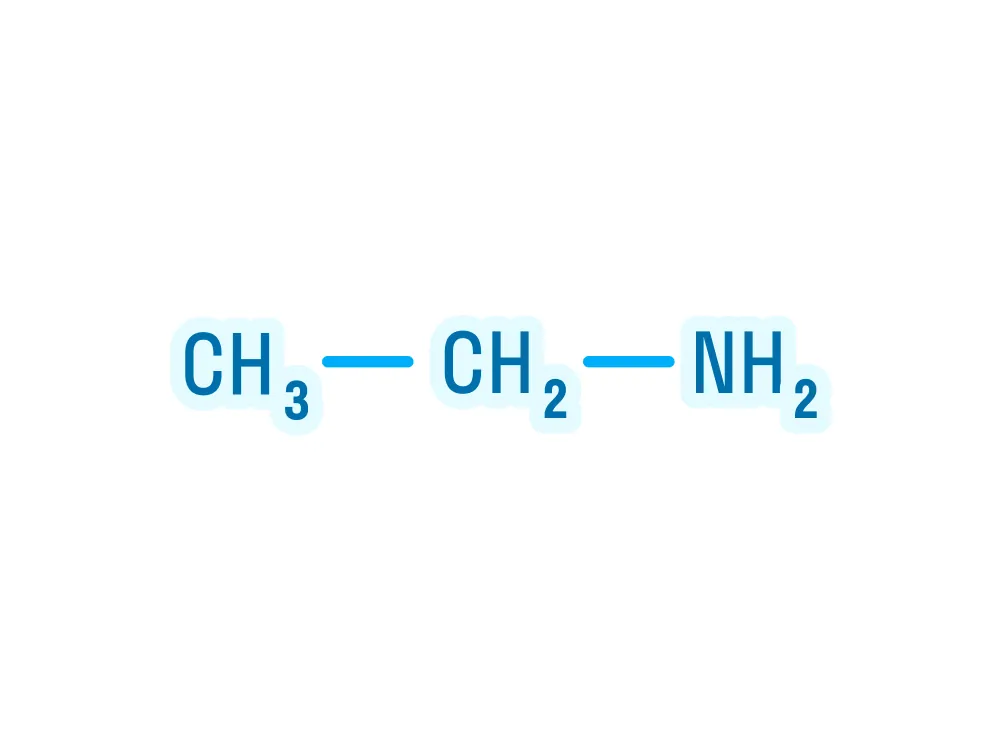
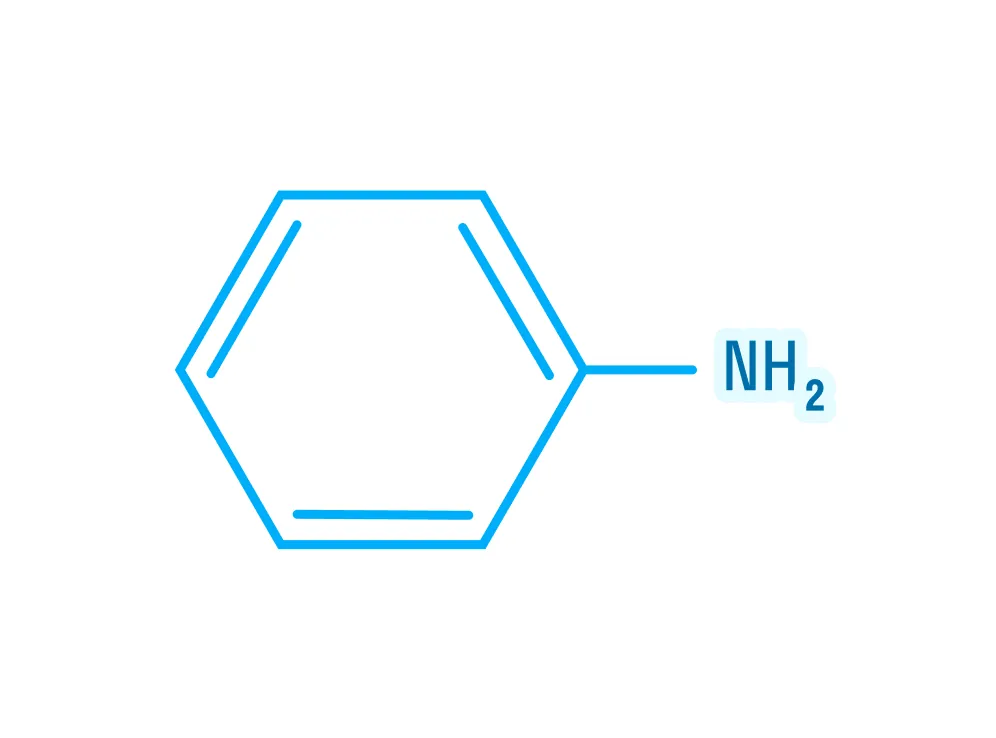
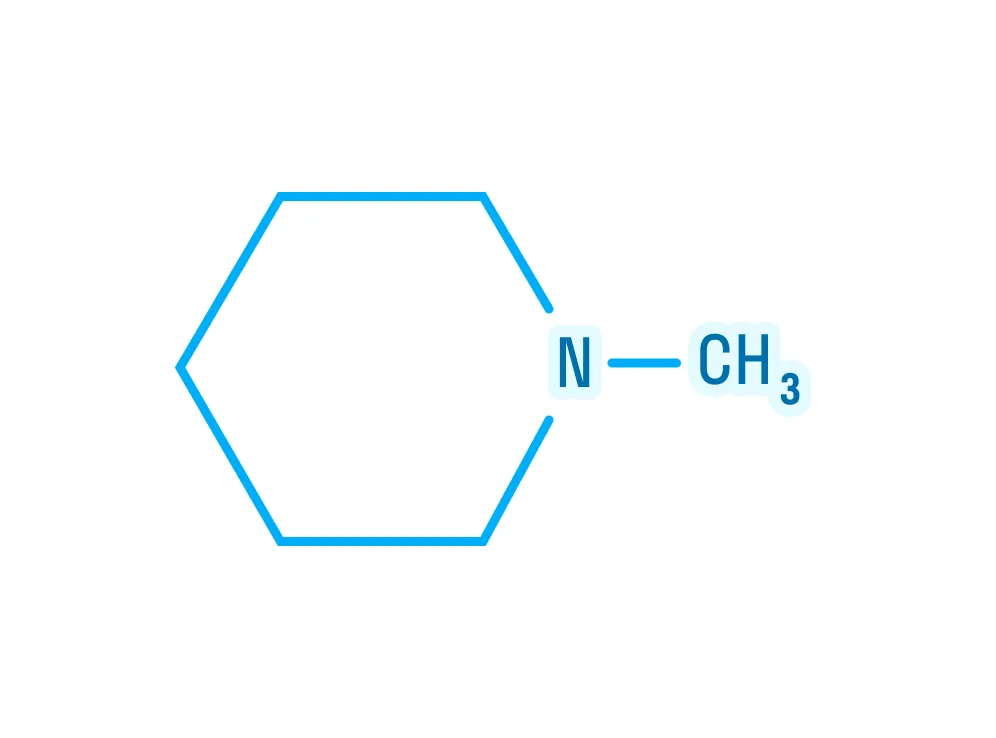
Теперь разберемся, чем первые три отличаются друг от друга. У алифатических аминов в составе есть заместитель, атомы углерода которого соединены между собой в прямые или разветвленные цепи. Ароматический амин содержит ароматическую систему связей. Смешанный амин представляет собой комбинацию из нескольких видов углеводородных заместителей.
Природа углеводородных заместителей |
Структурная формула |
Название |
|---|---|---|
Алифатические |
|
Этиламин |
Ароматические |
|
Анилин |
Смешанные |
|
N, N-диметиланилин |
Ниже в таблице мы собрали все, что можем сказать о классификации аминов.
Амины |
Первичные |
Вторичные |
Третичные |
|---|---|---|---|
Алифатические (жиры) |
CH3NH2 Метиламин |
(CH3)2NH Диметиламин |
(CH3)3N Триметиламин |
Ароматические |
C6H5NH2 Фениламин (анилин) |
(C6H5)2NH Дифениламин |
(C6H5)3N Трифениламин |
Смешанные |
— |
C6H5–NH–CH3 Метилфениламин |
C6H5–N(CH3)2 Диметилфениламин |
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Номенклатура аминов
Различать амины мы уже умеем, но называть — еще нет. Давайте это исправим! Так как видов аминов несколько, то и называют их по-разному.
Номенклатура первичных аминов
Чтобы назвать амин по номенклатуре ИЮПАК, нужно следовать такому алгоритму:
Укажите название углеводородного радикала, исходя из его количества углерода в цепи.
Добавьте к вышеназванному корню суффикс, который укажет на наличие или отсутствие кратных связей.
Обозначьте наличие аминогруппы, добавив к уже имеющемуся названию корень «амин».
После указанного названия поставьте дефис и укажите порядковый атом углерода, который связан с аминогруппой.
Как следовать всем этим пунктам, мы показали на рисунке ниже.
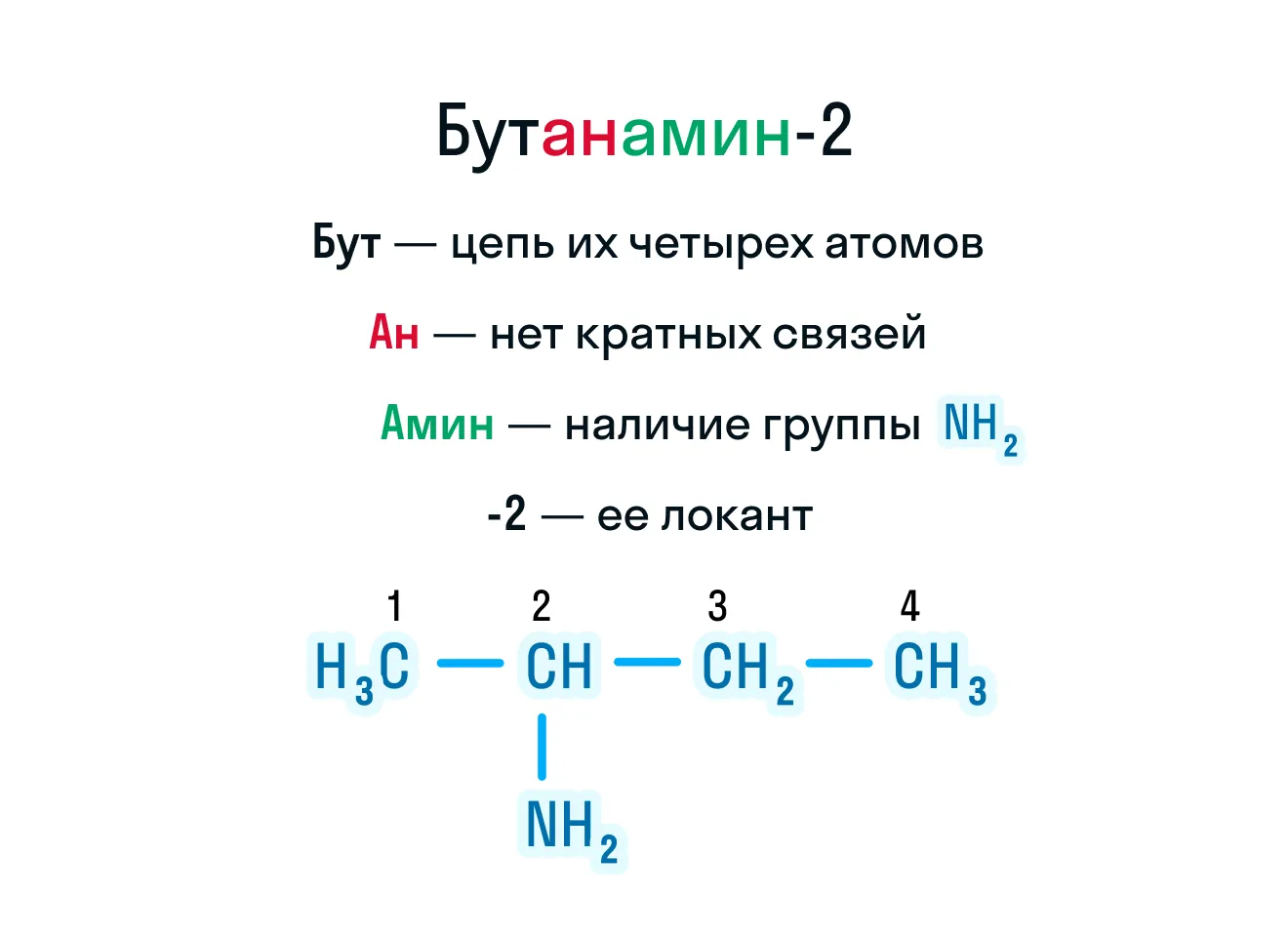
Но первичные амины можно назвать проще с помощью радикально-функциональной номенклатуры. Здесь за основу берут аминогруппу, а углеводородные радикалы являются заместителями: название радикала + «амин». Бутанамин-2 по радикально-функциональной номенклатуре будет называться бутиламином.
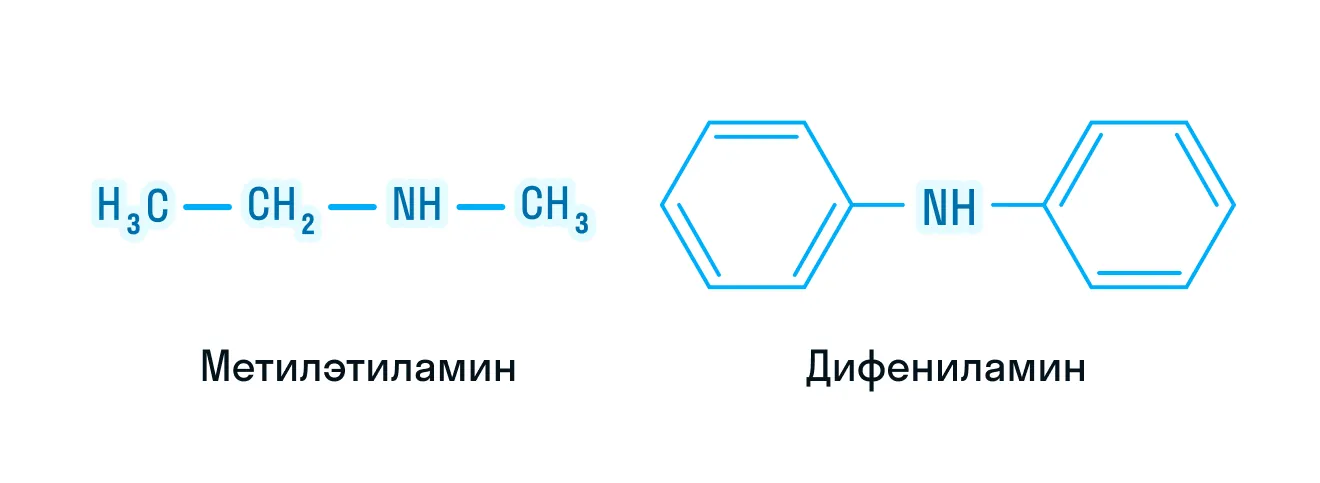
Номенклатура вторичных и третичных аминов
Эта номенклатура отличается только в радикально-функциональной номенклатуре. В основе лежит атом азота, углеводородные заместители указываются как радикалы в алфавитном порядке, либо с греческой приставкой при условии, что заместители одинаковы. Прилагаем пример на картинке ниже.
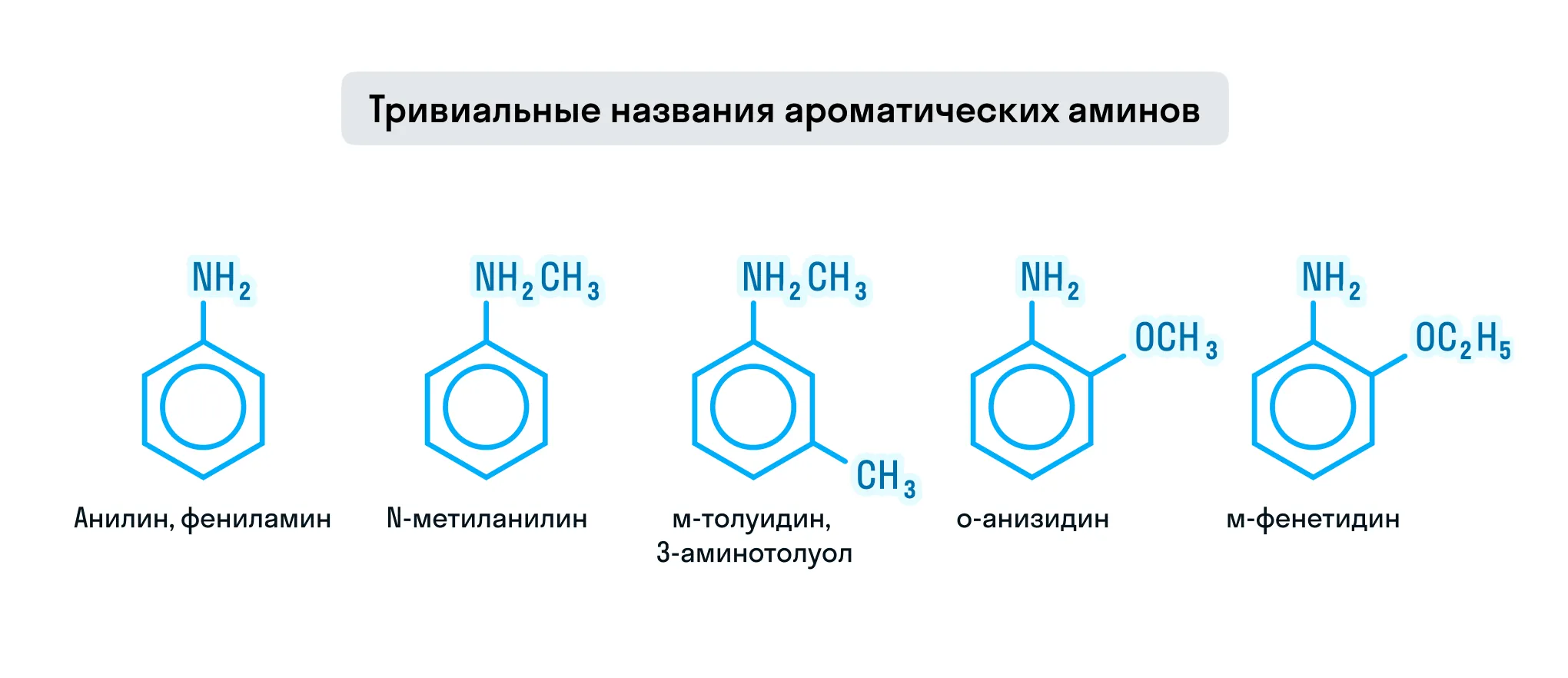
Изомерия аминов
Для аминов характерна:
- изомерия углеродного скелета;
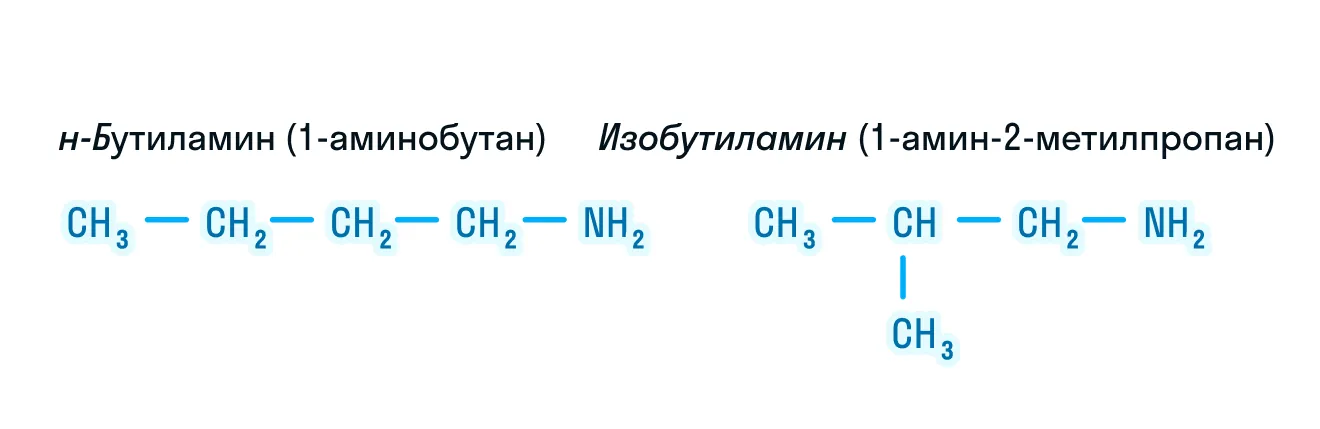
- изомерия положения функциональной группы;
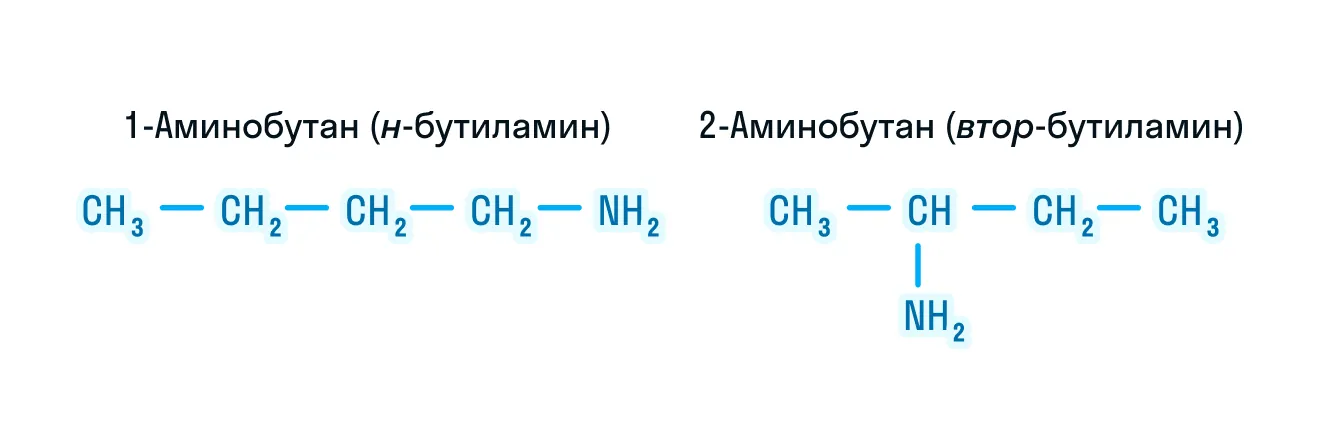
- изомерия между типами аминов.
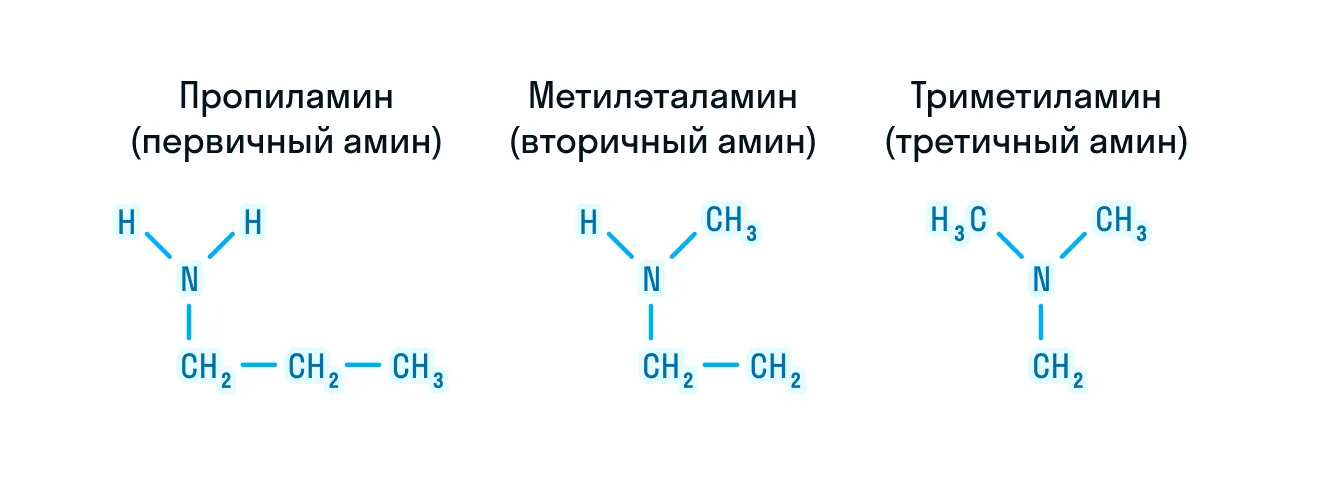
Физические свойства аминов

У аминов можно выделить такие физические свойства:
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи, что объясняет более высокие температуры кипения аминов относительно неполярных соединений с похожей молярной массой.
Амины способны образовывать межмолекулярные связи с водой, из-за чего низшие амины хорошо растворяются в воде При увеличении количества радикалов и их разветвленности растворимость в воде заметно снижается. Что касается ароматических аминов, то они в воде практически не растворяются.
Низшие алифатические амины (метиламин, диметиламин и триметиламин) — это газы с характерным запахом аммиака. Средние гомологи — это жидкости с резким рыбным запахом, а высшие амины — твердые вещества, у которых запаха нет.
Ароматические амины — это бесцветные жидкости с высокими температурами кипения или же твердые вещества.
Другая полезная статья по химии: «Типы изомерии».
Химические свойства аминов
Наличие у атома азота неподеленной электронной пары в значительной степени определяет химические свойства аминов. Алифатические амины — это более сильные основания, чем аммиак, из-за влияния алкильных групп. В свою очередь ароматические амины имеют более низкую основность, чем у аммиака, из-за своей стабильности.
1. Взаимодействие с водой.
При растворении аминов в воде образуется катион аммония и гидроксид-анион аналогично растворению аммиака в воде.
NH3 + H2O ⇌ NH4+ + OH–.
C3H7 – NH2 + H2O ⇌ (C3H7 – NH3)+ + OH–.
2. Взаимодействие аминов с кислотами.
Так как амины обладают оснóвными свойствами, то способны вступать в реакцию с кислотами с образованием солей.
H3C – CH2 – NH2 + HBr → [H3N+ – CH2 – CH3] Br –.
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей.
CH3 – NH – CH3 + H2SO4 → [H3C – N+H2 – CH3] HSO4–.
3. Алкилирование аминов.
Из первичного амина можно получить вторичный, а затем и третичный амин. Эта реакция проходит в две стадии:
Амины алкилируют галогеналканом с образованием соли:
CH3 – NH2 + CH3 – CL → [H3C – N+H2 – CH3] CL– .
Затем высвобождаем новый амин с помощью более сильного основания (щелочи):
[H3C – N+H2 – CH3] Cl– + NaOH → CH3 – NH – CH3 + NaCl + H2O.
4. Взаимодействие с азотистой кислотой.
Качественная реакция на первичные амины:
H3C – CH2 – NH2 + NaNO2 + HCl → H3C – CH2 – OH + N2 + NaCl + H2O.
5. Горение аминов.
Все амины горят с образованием углекислого газа, газообразного азота и воды, независимо от состава и структуры амина.
4C2H5 – NH2 + 15O2 → 8CO2 + 2N2 + 14H2O.
Способы получения аминов
Существует несколько способов получить амины в ходе химических реакций. Сегодня мы рассмотрим два из них. Остальные вы подробно разберете в 11-м классе.
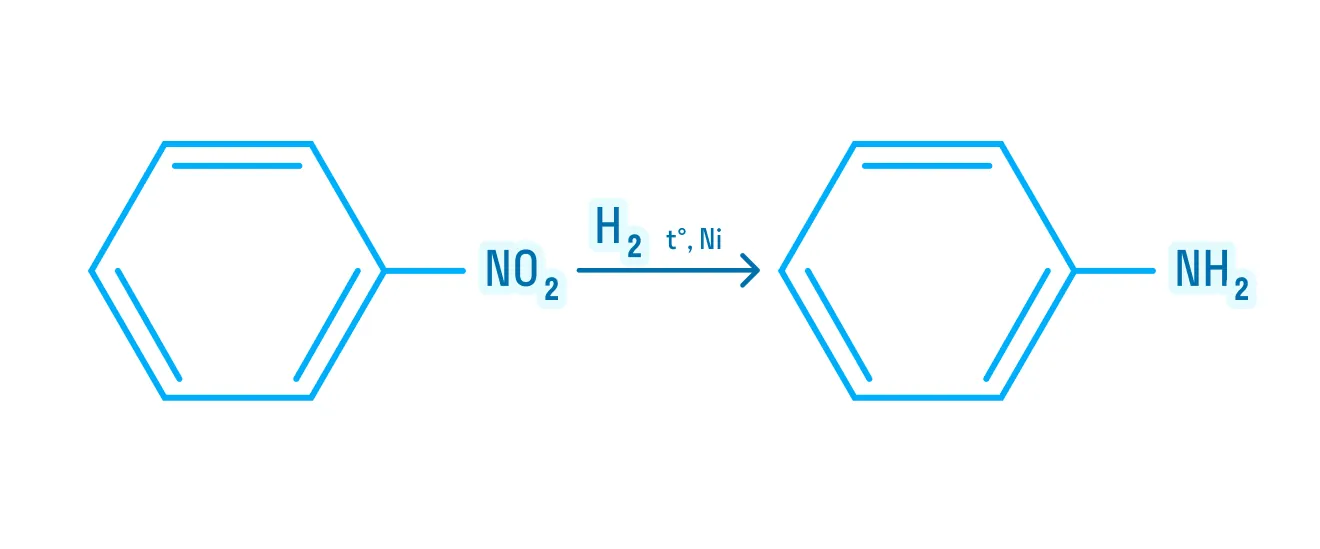
- Гидрирование нитросоединений.
Общий вид протекания реакции:
Частный случай гидрирования нитросоединения — промышленное получение анилина:
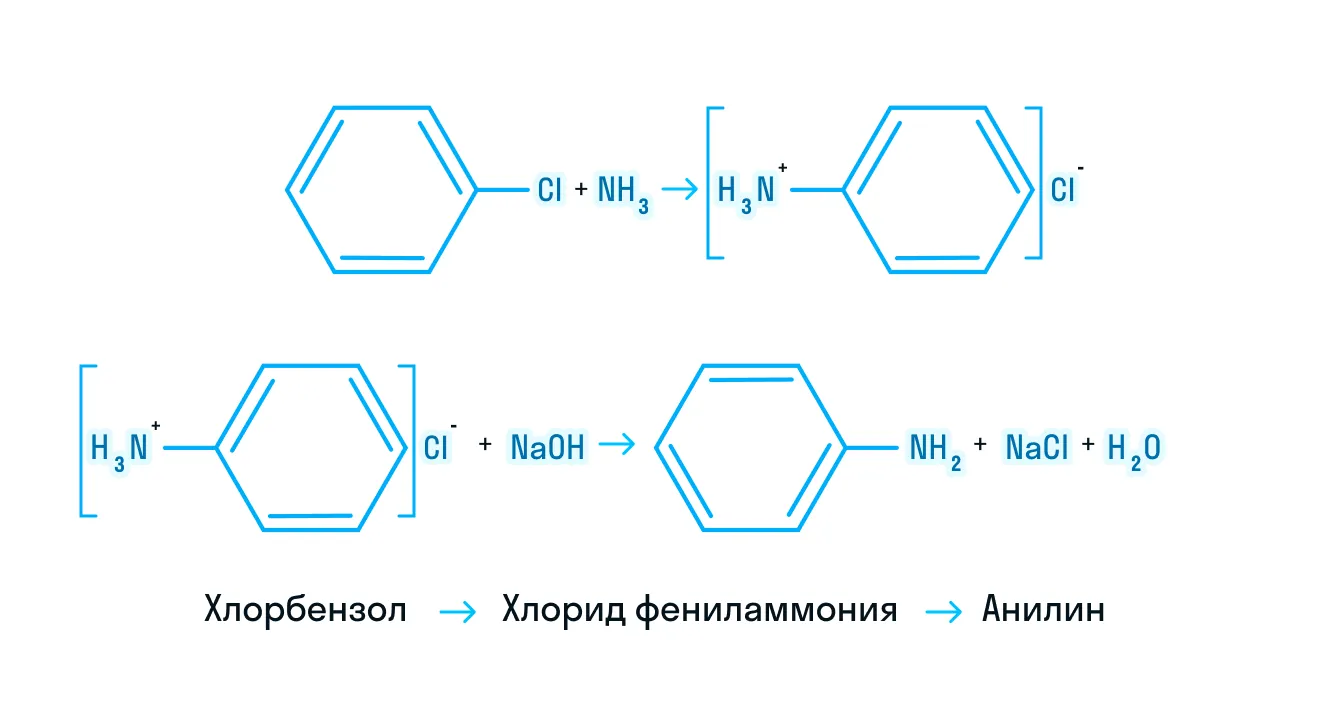
- Получение из галогеналканов.
Реакция идет в две стадии: сначала получение соли алкиламмония, а затем вытеснение амина более сильным основанием:
Если вы хотите еще глубже изучить свойства аминов и закрепить знания на практике, подумайте о дополнительных занятиях. На уроках онлайн-курсов химии в Skysmart вы сможете разобрать любую тему — даже ту, что, казалось бы, никогда не получится осилить. Например, свойства анилина и другие. Наши преподаватели объяснят ее простым языком, а интерактивные задания и опыты расскажут, как работает химия на самом деле. Начните с бесплатного вводного занятия — там мы познакомим вас с онлайн-платформой и поможем определить уровень знаний.