Азот - это двухатомный газ с химической формулой N₂, без цвета, вкуса и запаха. Основной компонент воздуха (78% объёма). Химически инертен, но реагирует с комплексными соединениями переходных металлов.
- Пример: аммиак (NH₃) образуется при реакции азота с водородом.
Азот (N2) — первый представитель V группы главной подгруппы и 2 периода периодической системы химических элементов Д. И. Менделеева. Если рассматривать местоположение азота в длиннопериодной таблице Менделеева, то там он занимает лидирующее место в 15 группе. Для представителей этой группы было предложено название пниктогены (от греческого корня πνῑ́γω — удушливый, плохо пахнущий). Явно это относится к водородным соединениям представителей данной группы.
Для кого эта статья:
- студенты и школьники, изучающие химию
- педагоги по химии
- интересующиеся химическими свойствами элементов и соединений
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
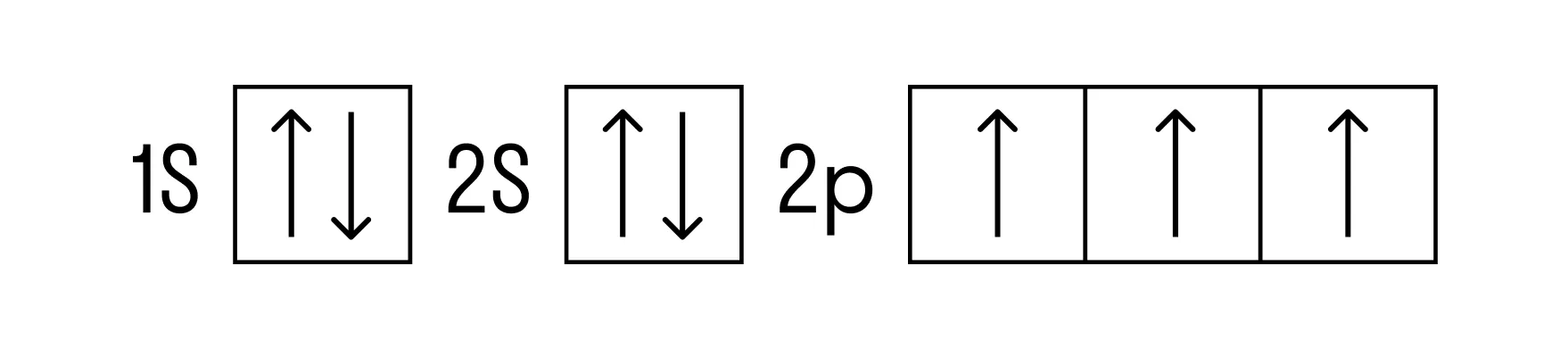
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Валентность азота - это способность атома азота образовывать химические связи с другими атомами, определяемая числом неспаренных электронов в валентной оболочке. В большинстве соединений валентность азота равна трем.
- Примеры:
- NH3 (аммиак)
- NCl3 (трихлорид азота)
Для азота характерен весь спектр возможных степеней окисления от −3 до +5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.

Строение молекулы азота
Азот — двухатомная молекула, атомы которой связаны между собой прочной тройной связью. Длина связи — 0,110 нм.
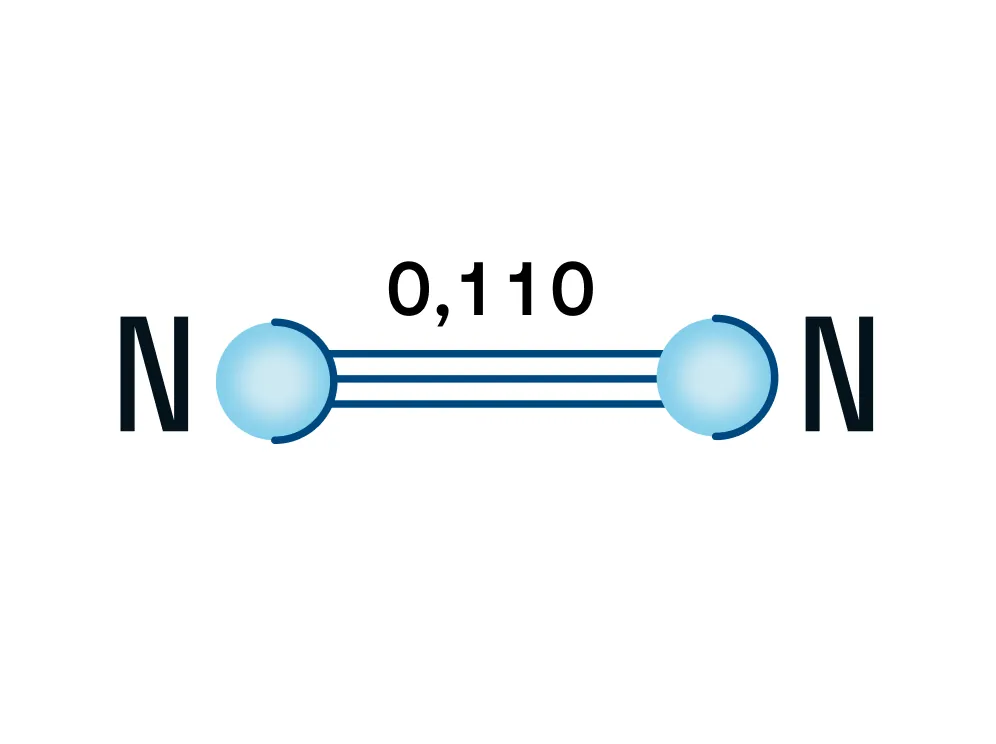
Почему именно тройная связь и из чего она состоит?
Напомним, что у каждого атома в молекуле азота 3 неспаренных электрона, которые и образуют впоследствии тройную связь, которая, в свою очередь, состоит из одной сигма-связи и двух пи-связей.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Физические свойства азота
Азот как простое вещество — бесцветный газ, который не имеет запаха и плохо растворяется в воде. По своей молярной массе азот легче, чем воздух. Благодаря наличию тройной неполярной связи и относительно маленьким радиусам атомов азот имеет низкие температуры кипения и плавления: tпл = −210 °С и tкип = −196 °С. Аллотропных модификаций азот не имеет. Несмотря на то, что основное состояние азота — газообразное, он бывает еще и жидким. Например, 1 литр жидкого азота при нагревании до 20 °С превращается в 700 литров газообразного азота. Более подробную информацию можно узнать в нашем видео:
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
с фтором
N2 + F2 = 2NF3с кислородом
N2 + O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 + 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 +3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 + NH4Cl = N2 + NaCl + 2H2Oразложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 + 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Важнейшие соединения азота
Аммиак
В первую очередь поговорим о водородном соединении азота — аммиаке. Аммиак — бесцветный газ с характерным резким запахом. Давайте рассмотрим строение молекулы аммиака:
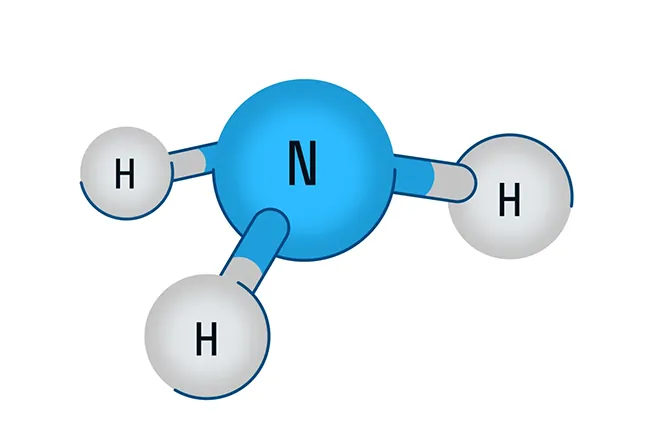
Аммиак имеет форму тригональной пирамиды. Этот газ очень ядовит и способен вызывать химический ожог глаз, а пары сильно раздражают слизистые оболочки органов дыхания. В то же время аммиак обладает достаточно высокой растворимостью в воде из-за образования водородных связей с молекулами воды. Вас когда-нибудь приводили в чувства после потери сознания ваткой, смоченной чем-то гадко пахнущим? Поздравляю, это было ваше первое знакомство с раствором аммиака в воде.
Поговорим теперь о химических свойствах этого газа.
В отличие от самого азота, аммиак является крайне реакционноспособным соединением. Так как азот находится в аммиаке в своей низшей степени окисления (−3), то аммиак проявляет только восстановительные свойства.
Например, аммиак реагирует с кислородом (при нагревании):
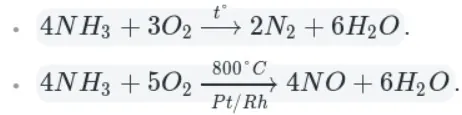
Как видно из уравнений, аммиак вступает в реакции окисления, а продукты его окисления напрямую зависят от силы окислителя и условий проведения реакций.
Со сложными веществами — окислителями аммиак реагирует следующим образом:
6NH3 + 8KClO3 + 6NaOH = 6NaNO3 + 8KCl + 12H2O
10NH3 + 6KMnO4 + 9H2SO4 = 5N2 + 6MnSO4 + 3K2SO4 + 24H2O
С кислотами аммиак реагирует благодаря своим оснóвным свойствам, что приводит к образованию различных солей:
NH3 + HCl = NH4Cl
NH3 + H2SO4 = NH4HSO4
А теперь рассмотрим получение аммиака. Различают два типа способов: промышленный и лабораторный.
Промышленный способ — синтез из простых веществ:
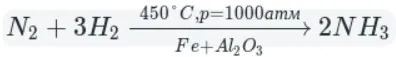
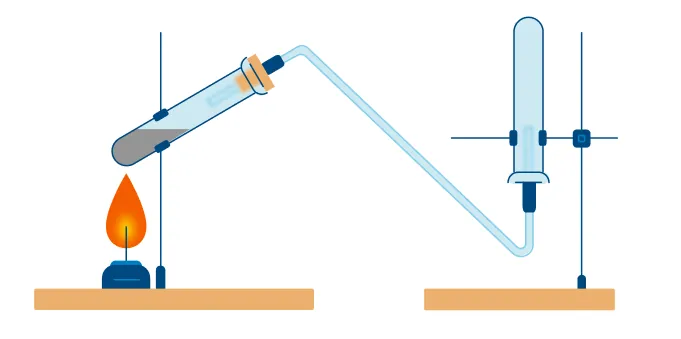
Лабораторный способ:
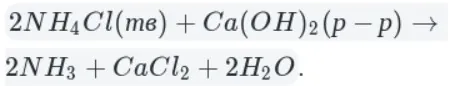
В данном способе аммиак собирают в перевернутую вверх дном колбу, так как аммиак легче воздуха.
Азотная кислота
Азотная кислота — одна из важнейших неорганических кислот. Это летучая бесцветная жидкость с резким запахом, которая способна смешиваться с водой в любых пропорциях.
Получают ее в промышленности в несколько этапов. Рассмотрим подробнее каждый из них:
Окисление аммиака кислородом воздуха на платиновом катализаторе
4NH3 + 5O2 = 4NO + 6H2OОкисление оксида азота (II)
2NO + O2 = 2NO2Поглощение образующегося оксида азота (IV) водой в избытке воздуха
4NO2 + O2 + 2H2O = 4HNO3
Для азотной кислоты характерны особые химические свойства исходя из ее концентрации.
Например, с металлами данная кислота никогда не будет реагировать с выделением газообразного водорода. Рассмотрим таблицу с примерами металлов с различными концентрациями азотной кислоты:
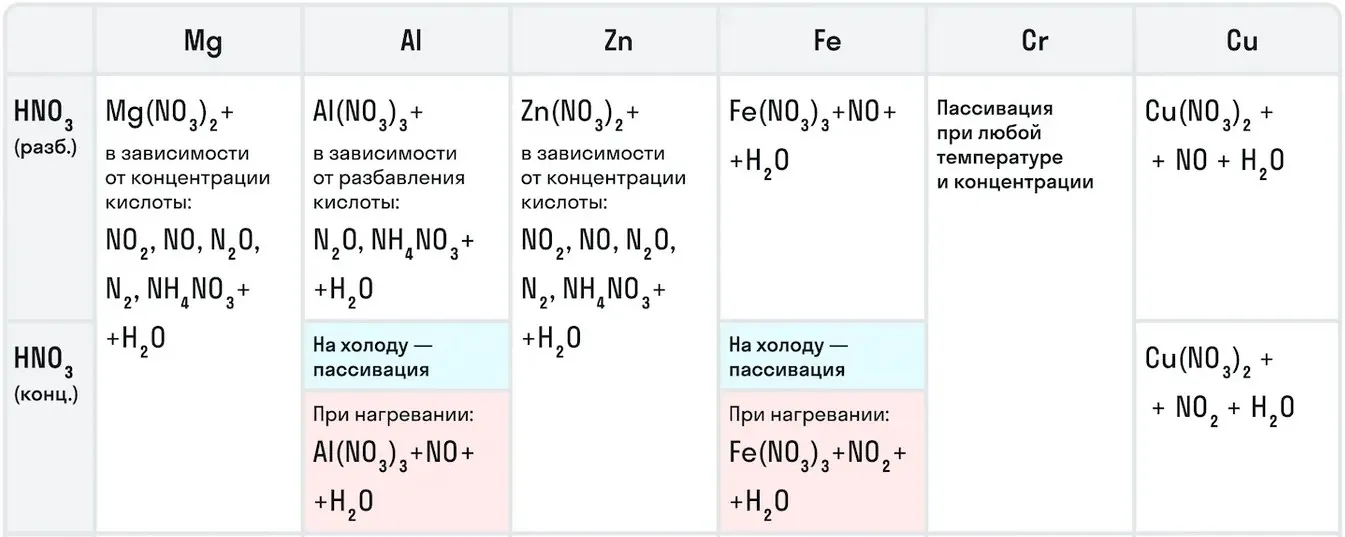
Также азотная кислота как сильный окислитель способна окислять некоторые неметаллы до их кислот. Давайте рассмотрим примеры:
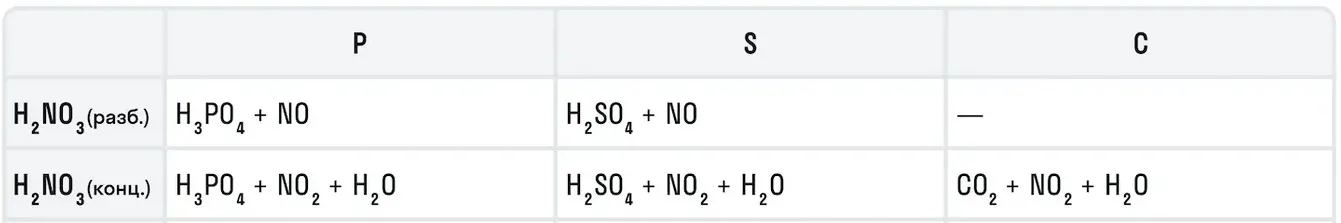
Азотная кислота в соотношении 1:3 с соляной кислотой образуют смесь под названием царская водка. Это желтовато-оранжевая дымящаяся жидкость, которая получила свое название от алхимиков благодаря способности растворять «царские» металлы — золото и платину.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
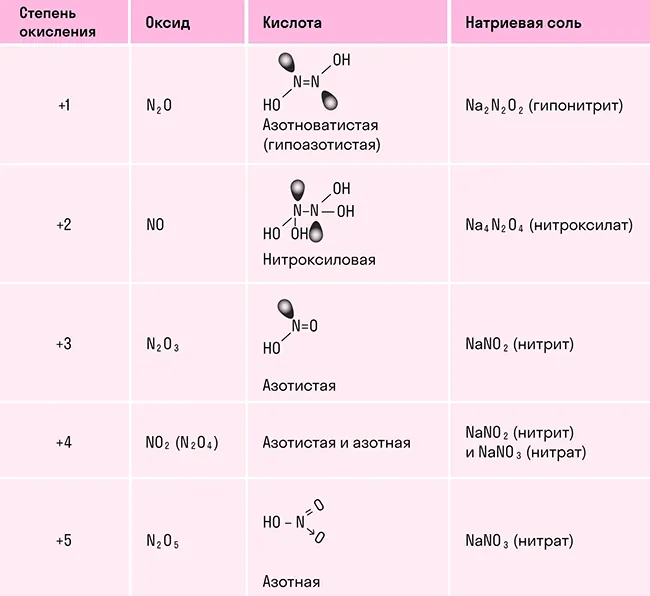
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота. Оксид азота (I) применяли в медицине в качестве наркоза более 200 лет назад. При вдыхании этого газа человека охватывает радость и безудержный смех, отчего оксид получил еще одно название — веселящий газ.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.
Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и +5,
−5 и +3,
0 и +4,
−3 и +3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.
Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Ответы
-
c
-
a
-
c
-
b
-
c