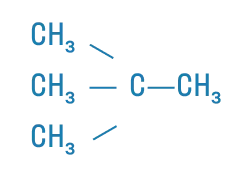
Алканы - это углеводороды с общей формулой CnH2n+2, неразветвленная цепь которых состоит исключительно из одинарных связей. Например:
- Метан - CH4
- Этан - C2H6
- Пропан - C3H8
- Бутан - C4H10
- Пентан - C5H12
- Гексан - C6H14
- Гептан - C7H16
- Октан - C8H18
Этот класс относится к алифатическим соединениям, так как не имеет ароматических связей. К тому же алканы — предельные углеводороды, то есть они содержат максимально возможное число атомов водорода. Поэтому общая формула алканов — CnH2n+2.
Другая важная тема по биохимии — функции белка.
Для кого эта статья:
- студенты и школьники, изучающие химию
- преподаватели и научные работники в области химии
- все, интересующиеся химическими структурами и свойствами углеводородов
Строение алканов
Основные химические связи у алканов — это ковалентная неполярная связь между атомами углерода (С—С) и ковалентная полярная связь между атомами углерода и водорода (С—Н).
Так как алканы — это предельный класс, делаем вывод, что все связи между атомами являются одинарными, то есть σ-связями.
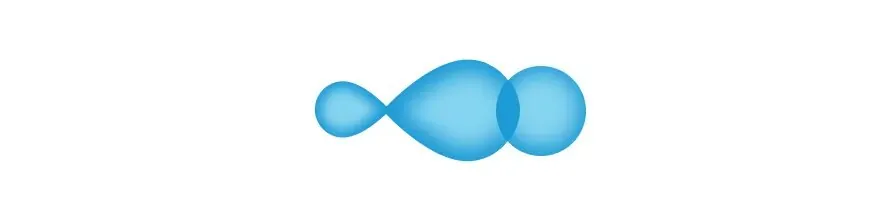
Разберемся с типом гибридизации атомов углерода в алканах, но сначала вспомним, что такое гибридизация. Упрощенное определение гибридизации звучит так: это смешение различных орбиталей в многоатомной молекуле для выравнивания формы и энергии, которое приводит к изменению формы орбитали. Гибридизация атомов углерода в алканах — sp3. Рассмотрим, как она образуется.
При образовании связи между углеродами происходит смешение их орбиталей — вот так:

В то время как образование связи между углеродом и водородом происходит следующим образом:
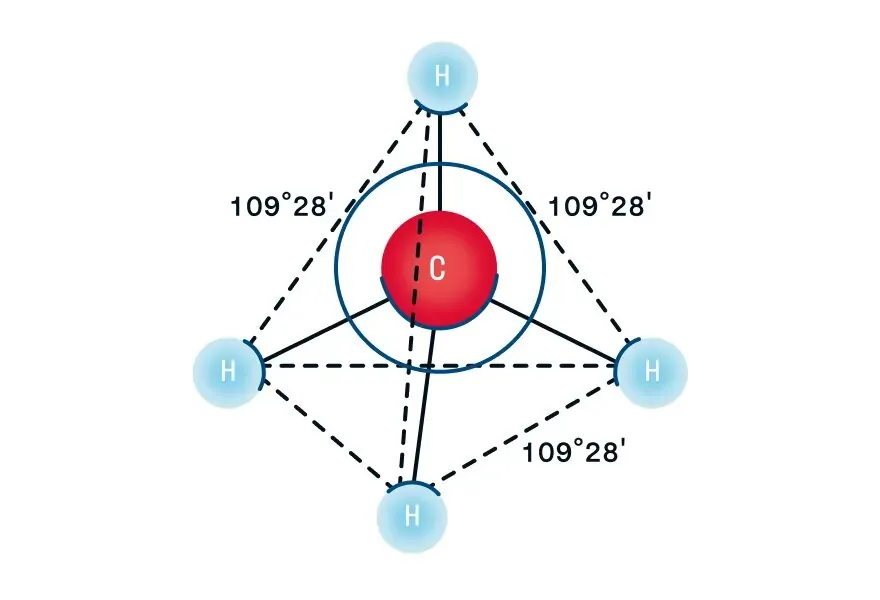
Рассмотрим пространственное строение алканов на примере метана — первого представителя гомологического ряда алканов. При наличии четырех атомов водорода и одного атома углерода в молекуле образуются четыре гибридизованные орбитали, которые взаимно отталкиваются друг от друга, но не произвольно, а под определенным углом. Максимальный угол взаимного отталкивания — это валентный угол, для алканов он равен 109°28′. Таким образом, молекула метана в пространстве выглядит как тетраэдр:
Номенклатура алканов
Познакомьтесь с номенклатурой гомологического ряда алканов (ее необходимо выучить):
Название алкана |
Формула алкана |
|---|---|
Метан |
CH4 |
Этан |
C2H6 |
Пропан |
C3H8 |
Бутан |
C4H10 |
Пентан |
C5H12 |
Гексан |
C6H14 |
Гептан |
C7H16 |
Октан |
C8H18 |
Нонан |
C9H20 |
Декан |
C10H22 |
Названия первых четырех представителей этого ряда сложились исторически. Названия остальных алканов образованы от греческих числительных, которые обозначают количество атомов углерода, с помощью суффикса -ан-.
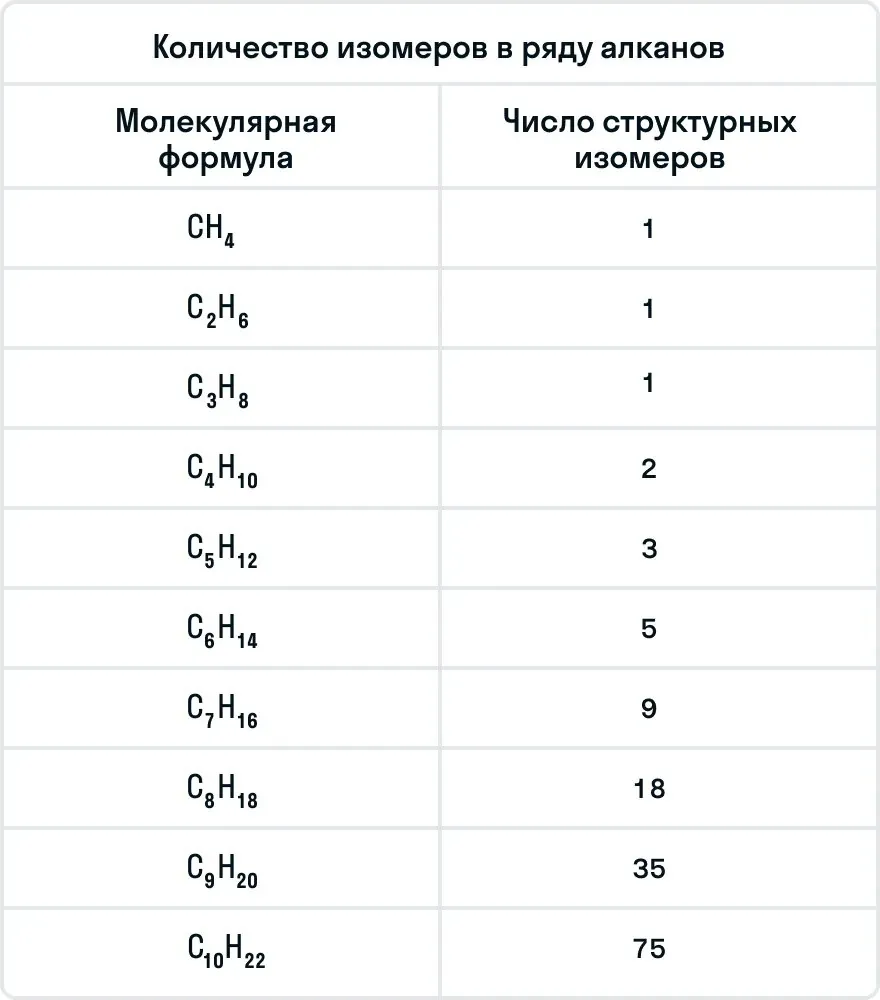
Важно помнить, что бутан и следующие за ним алканы могут иметь изомеры. Ниже в таблице указано количество изомеров у каждого представителя алканов:
Помимо структурной изомерии, для алканов характерна изомерия оптическая. Но для ее реализации нужно одно условие — наличие хирального атома углерода, то есть атома с четырьмя различными заместителями.
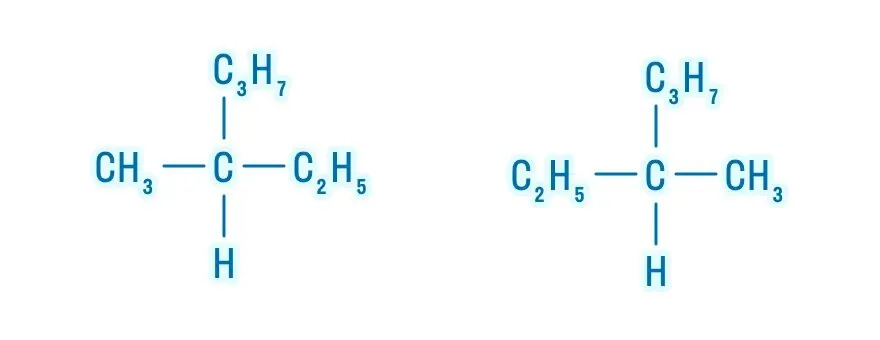
Молекулы таких соединений относятся друг к другу как предмет и его зеркальное отражение. Как бы мы ни вращали эти молекулы, нельзя получить из одной другую.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Физические свойства алканов
Свойства этих соединений меняются по мере продвижения по гомологическому ряду:
первые четыре представителя алканов являются газами;
алканы, в составе молекулы которых от 5 до 15 атомов углерода, являются жидкостями;
алканы, в составе молекулы которых от 16 атомов углерода, — твердые вещества.
С увеличением количества атомов углерода в структуре молекулы и с ее формой в пространстве связана одна особенность: у линейных молекул, в отличие от разветвленных, температура кипения и плавления выше. В таблице собрали справочные данные о температуре плавления и составе алканов.
Физические свойства алканов - это характеристики, определяющие их физическое состояние и взаимодействие с окружающей средой:
- Все алканы бесцветны;
- Метан и этан не имеют запаха;
- Жидкие алканы обладают характерным запахом;
- Твёрдые не имеют запаха;
- Алканы малополярны, не смачиваются водой, практически нерастворимы в ней, но хорошо растворимы в органических растворителях.
Примеры:
- Метан (CH₄) - газ без цвета и запаха.
- Гексан (C₆H₁₄) - бесцветная жидкость с характерным запахом.
- Парафин - твёрдое вещество без запаха.
Название вещества |
Молекулярная формула |
Структурная формула |
Температура плавления, °С |
|---|---|---|---|
Метан |
CH4 |
CH4 |
−182 |
Этан |
С2Н6 |
СН3—СН3 |
−183 |
Пропан |
С3Н8 |
СН3—СН2—СН3 |
−188 |
Бутан |
С4Н10 |
СН3—(СН2)2—СН3 |
−138 |
Изобутан (2-метилпропан) |
С4Н10 |
(СН3)2—СН—СН3 |
−160 |
Пентан |
С5Н12 |
СН3—(СН2)3—СН3 |
−130 |
Изопентан (2-метилбутан) |
С5Н12 |
(СН3)2—СН—СН2—СН3 |
−160 |
Неопентан (2,2-диметилпропан) |
С5Н12 |
|
−17 |
Гексан |
С6Н14 |
СН3—(СН2)4—СН3 |
−95 |
Гептан |
С7Н16 |
СН3—(СН2)5—СН3 |
−91 |
Октан |
С8Н18 |
СН3—(СН2)6—СН3 |
−57 |
Нонан |
С9Н20 |
СН3—(СН2)7—СН3 |
−51 |
Декан |
С10Н22 |
СН3—(СН2)8—СН3 |
−30 |
Гексадекан |
С16Н34 |
СН3—(СН2)14—СН3 |
18 |
Эйкозан |
С20Н42 |
СН3—(СН2)18—СН3 |
36,7 |
Все алканы бесцветны, легче воды и нерастворимы в ней, однако хорошо растворяются в органических растворителях. Жидкие алканы, такие как пентан и гексан, сами широко используются как растворители.
Вам может быть полезна наша статья по химии «Теория Бутлерова».
Химические свойства алканов
Для алканов характерны реакции замещения. Для всех реакций замещения алканов нужно соблюдать правило: сначала замещается водород у третичного атома углерода, затем — у вторичного, в последнюю очередь — у первичного атома углерода.
Рассмотрим все возможные реакции, характерные для алканов.
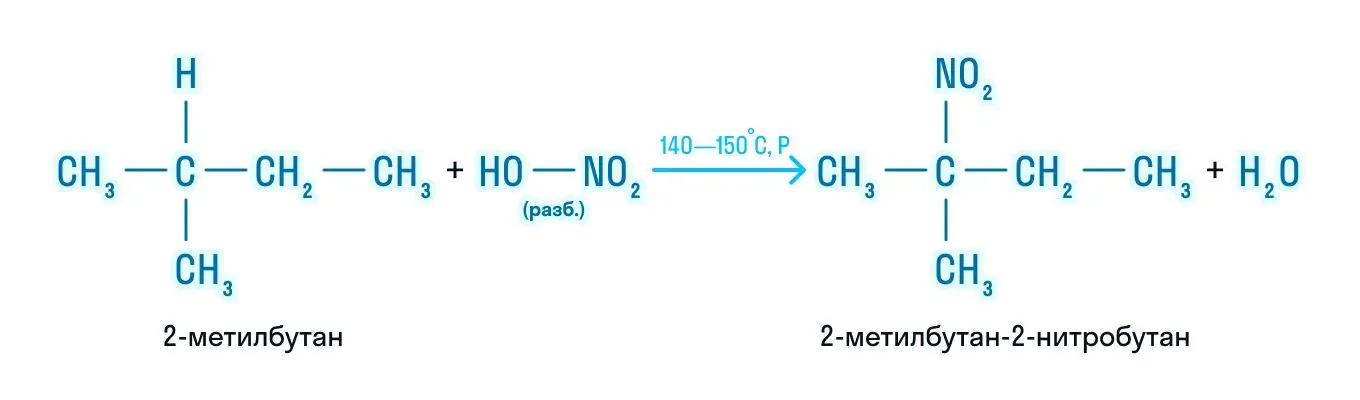
Реакция нитрования (реакция Коновалова)
Галогенирование
Реакция может продолжаться до полного замещения атомов водорода на хлор.
Дегидрирование (отщепление водорода)
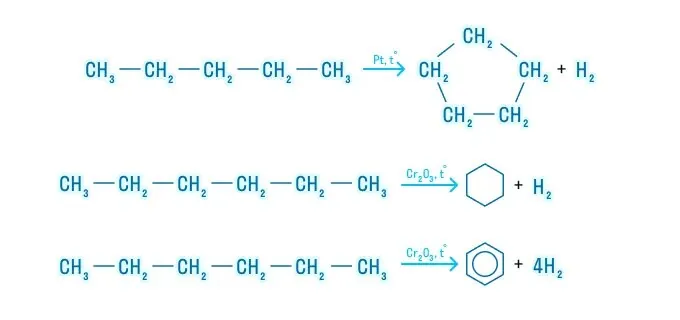
Катализаторы для дегидрирования: Ni, Pt, Pd, Cr2O3, Fe2O3, ZnO и другие.
Реакции разложения
Крекинг:
C8H18 → C4H10 + C4H8.
Пиролиз метана:
Реакция окисления (горение)
Все алканы, кроме метана, горят с образованием углекислого газа и воды. Метан горит с образованием угля и воды.
Алканы не окисляются сильными окислителями, такими как перманганаты, дихроматы и хроматы.
Вопросы для самопроверки
Выберите алкан с наибольшей молярной массой.
Пентан
Бутан
Октан
Гексан
Какая гибридизация у атомов углерода в предельных углеводородах?
sp3
sp2
sp
Гибридизации нет
Какие виды изомерии характерны для алканов?
Оптическая и пространственная
Цис-транс-изомерия
Углеродного скелета и геометрическая
Углеродного скелета и оптическая
Вспомните общую формулу алканов.
CnH2n
CnH2n−2
CnH2n+2
CnH2n−6
Какой тип реакций характерен для алканов?
Присоединение
Замещение
Присоединение и замещение
Любые типы реакций
Какая именная реакция удвоит углеродный скелет у алканов?
Реакция Коновалова
Реакция Вюрца — Фиттинга
Реакция Вюрца
Реакция Зинина
Подготовиться к ЕГЭ на онлайн-курсах по химии, пожалуй, лучший вариант. Можно заниматься дома и не тратить время на дорогу — нужен лишь компьютер и стабильный интернет. Преподаватели онлайн-школы Skysmart помогут не только упорядочить знания, но и подготовиться к экзамену психологически. Пройти вводное тестирование и получить рекомендации по самостоятельному обучению можно бесплатно!
Ответы на вопросы
c
a
d
c
b
c