Для кого эта статья:
- Школьники, готовящиеся к экзаменам по химии (ЕГЭ/ОГЭ)
- Студенты химических факультетов и специалистов в области химии
- Преподаватели и учителя химии, ищущие материал для объяснения химического равновесия
Что такое химическое равновесие
Прежде чем мы раскроем суть понятия «химическое равновесие», давайте рассмотрим одну и ту же химическую реакцию, но с единственным отличием в условиях. Вот первая реакция:
Это разложение карбоната кальция в открытой системе. Иными словами, в такой, где обмен энергией и веществом с окружающим миром, будет необратимым. В ходе этой реакции углекислый газ улетучится.
Теперь рассмотрим ту же самую реакцию, но с одним отличным условием: система будет закрытая, то есть без обмена веществом и энергией с окружающим миром. Как мы видим из записи уравнения, обозначение необратимой реакции поменялось на обозначение обратимой. Давайте сразу разберемся, что это такое.
В данном случае направление прямой реакции — это разложение карбоната кальция, а направление обратной реакции — образование карбоната кальция из оксида кальция и углекислого газа. Давайте рассмотрим на графике, как изменяются скорости протекания противоположных по направлению химических реакций.
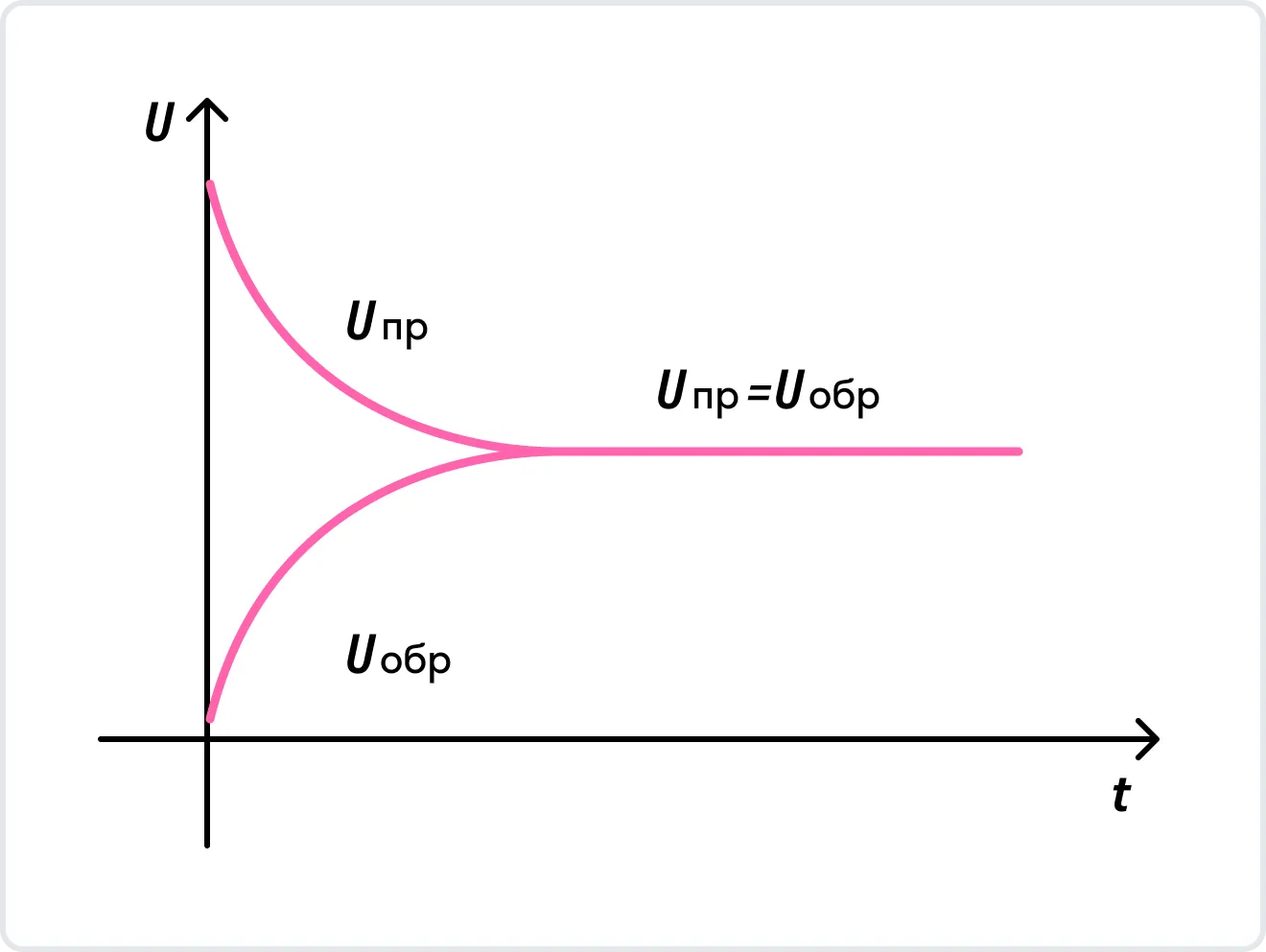
Как видно на графике, в начальный момент времени скорость образования продуктов химической реакции максимальна, в то время как скорость разложения продуктов реакции равна нулю из-за отсутствия тех самых продуктов реакции. Через какое-то время скорость образования продуктов и скорость разложения продуктов реакции становятся численно равны. Наступает химическое равновесие. Закрепим это в определении.
Вам может стать интересно, как же получаются продукты реакции, а затем снова исходные вещества. Чтобы понять это, рассмотрим график, на котором показано как изменяется концентраций исходных реагентов в течение времени, и как изменяется концентрация продуктов реакции.
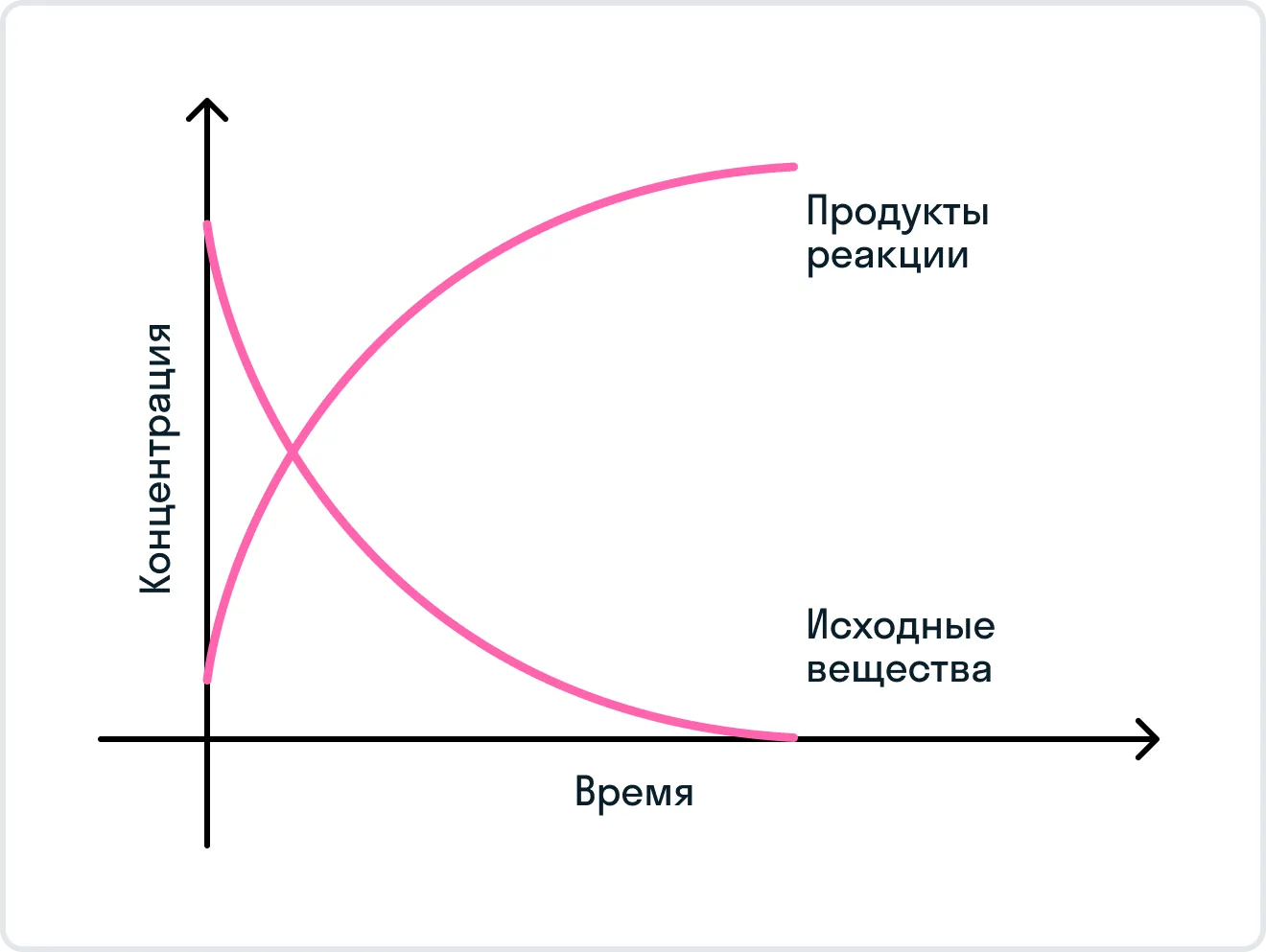
Резюмируем: в начальный момент времени концентрация, показывающая содержание исходных веществ, максимальна, поскольку реакция только начинается, и кроме исходных реагентов в системе ничего нет. В этот же момент скорость прямой реакции, отвечающая за образование продуктов реакции, является максимальной, так как система стремится к созданию продуктов реакции. По мере того, как концентрация и скорость исходных веществ уменьшаются вследствие образования некоторых веществ, являющихся продуктами реакции, скорость обратной реакции и концентрация продуктов реакции возрастают. В некоторый момент времени скорость образования продуктов реакции и разложения продуктов реакции становятся равными друг другу. Наступает химическое равновесие.
При рассмотрении концепции химического равновесия важно также учитывать различные способы выражения концентрации реагентов и продуктов, такие как массовая доля. Узнайте больше о том, что такое массовая доля и как её найти, в нашей подробной статье.
Следует отметить, что при достижении состояния химического равновесия продолжают протекать как образование продуктов, так и разложение продуктов в рамках одной химической реакции. Но концентрации, являющиеся равновесными, всех веществ при этом остаются незименными благодаря равенству скоростей. Хочется отметить, что изменение внешних условий может повлиять на скорость как прямой и обратной реакций, что влечет за собой смещение химического равновесия. В результате воздействия система переходит в новое состояние равновесия с новыми концентрациями реагирующих веществ и продуктов реакции.
Принцип Ле Шателье

Анри Луи Ле Шателье — это французский химик, который родился в семье ученых. Он изучал химические реакции, которые связаны с несчастными случаями на шахтах и в металлургическом производстве, участвовал в исследовании детонации рудничного газа. Ле Шателье разработал термоэлектрический пирометр (оптический прибор для определения температуры раскаленных тел по цвету) и гидравлические тормоза для железнодорожных составов, изобрел кислородно-ацетиленовую сварку.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
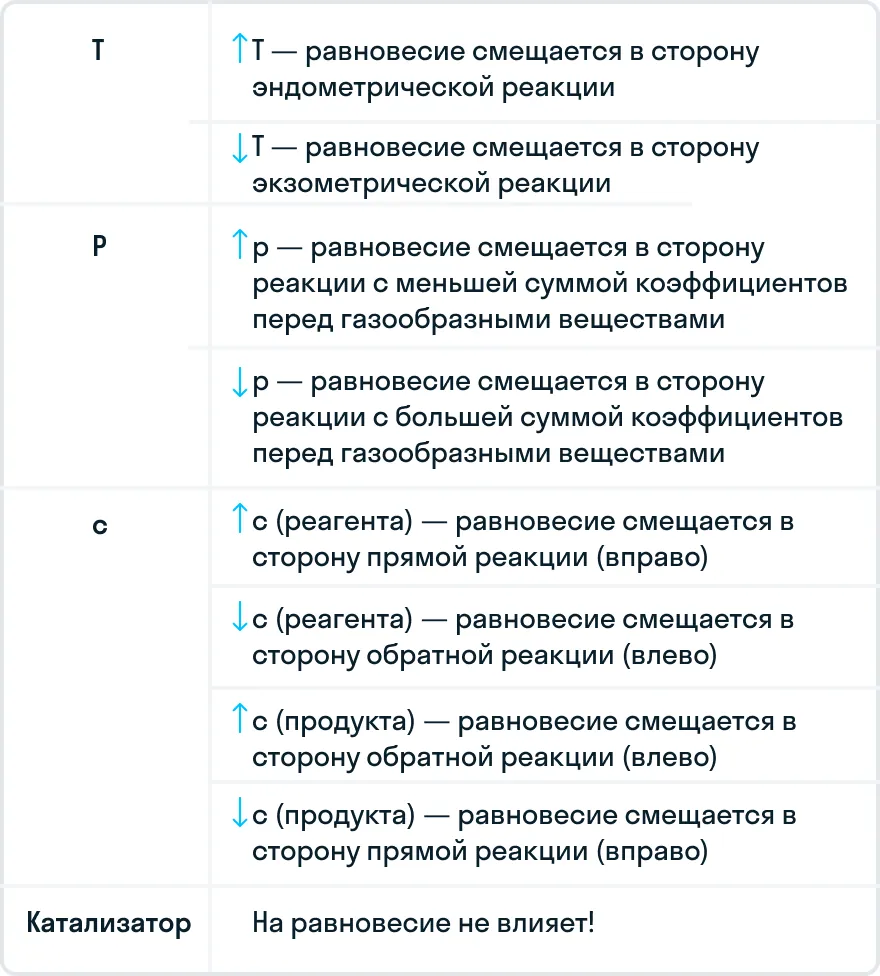
Факторы, которые влияют на смещение равновесия
1. Перемена температуры
Отметим, что прямая и обратная химические реакции имеют одинаковые по величине, но разные по знаку тепловые эффекты. Если повысить температуру системы, то химическое равновесие будет смещаться в сторону охлаждения системы, соответственно при понижении — в сторону нагрева системы. Если прямая реакция — экзотермическая (Q > 0), то равновесие при нагревании смещается влево, а если прямая реакция — эндотермическая (Q < 0), то вправо.
2. Перемена давления
Давление влияет только на обратимые процессы с участием газообразных веществ с изменением количества моль в системе. Для того чтобы понять, влияет ли давление на смещение химического равновесия, посчитайте все коэффициенты только у газообразных соединений в левой и правой частях.
3. Перемена объема
Изменение объема напрямую связано с изменением давления. Если увеличивать объем реакционного сосуда, то давление будет уменьшаться. Если уменьшать объем реакционного сосуда, то давление будет увеличиваться. Как только мы узнаём поведение давления в реакционном сосуде, делаем вывод на основании п. 2.
Давайте разберемся, как это работает, на примере из жизни. Решили мы, например, заварить чай во френч-прессе. В момент наполнения кипятком поршень поднят к самому верху, то есть давления на листики заварки нет, а объем максимальный. По мере того, как мы будем опускать поршень, объем уменьшается, а давление увеличивается. К тому же, листья чая уже не могут свободно плавать по всему объему френч-пресса. Соответственно при поднятии поршня объем увеличивается, а давление уменьшается. Значит, заварка снова может занимать весь предоставленный ей объем. Зная, как меняется давление, делаем выводы на основании п. 2.
4. Перемена концентрации веществ
При добавлении или удалении некоторого количество веществ, участвующих в реакции, меняются концентрации всей системы. Вследствие этого происходит смещение химического равновесия. Если из равновесной системы удалить небольшое количество участника химической реакции, то равновесие сместится в сторону протекания такой реакции, в результате которой это вещество образуется. При добавлении участника реакции в систему, равновесие будет смещаться в сторону той химической реакции, в результате которой это вещество расходуется.
5. Добавление катализатора или ингибитора
Напомним, что катализатор — это вещество, которое ускоряет химическую реакцию, но не участвует в ней. В свою очередь, ингибитор — вещество, которые замедляет реакцию и тоже в ней не участвует.
Это связано с тем, что катализатор ускоряет как прямую, так и обратную химические реакции. Следовательно, состояние равновесия не изменяется.
Константа химического равновесия
При неизменной температуре константа равновесия остается неизменной величиной. Она рассчитывается из экспериментальных данных и определяет равновесные концентрации как исходных веществ, так и продуктов реакции при определенной температуре.
Если константа равновесия численно больше единицы, то значит концентрации продуктов реакции преобладают над исходными веществами. Если константа меньше единицы, то выход продукта мал, концентрация исходных веществ выше.
Рассмотрим обратимую реакцию образования иодоводорода из йода и водорода:
Запишем для реакции константу равновесия с учетом всех стехиометрических коэффициентов:
Также можно выразить константу равновесия для обратной химической реакции:
Зная численные значения для каждой концентрации, можно выразить константу в виде числа.
В случае гетерогенных реакций для этого используют концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Рассмотрим на примере взаимодействия углекислого газа с углеродом:
Для данной реакции константу равновесия можно записать следующим образом:
От присутствия катализатора константа не зависит, поскольку он изменяет скорость и прямой, и обратной реакции на одну и ту же величину. Катализатор может лишь ускорить наступление равновесия, но не влияет на значение константы равновесия.
Изменения температуры могут смещать равновесие в сторону продуктов или реагентов. Более подробно о зависимости химических реакций от тепловых эффектов читайте в статье «Тепловой эффект реакции».
Коротко о главном
Теперь, когда основная часть статьи позади, давайте подведем итоги:
Химическое равновесие — это отношение скоростей прямой реакции к обратной в случае обратимых реакций.
Значение константы равновесия характеризует полноту протекания химической реакции.
Из принципа Ле Шателье делаем вывод: система всегда стремится противодействовать влиянию извне в противоположную сторону, равновесие смещается в ту же сторону.
Чтобы лучше запомнить всю информацию о факторах, которые влияют на смещение химического равновесия, смотрите таблицу ниже. Сохраняйте ее и пользуйтесь!
Проверьте себя
Задание 1
Вычислите константу равновесия реакции А + 2В ⇄ С, если равновесные концентрации [А] = 0,3 моль/л, [В] = 1,1 моль/л, [С] = 2,1 моль/л.
Задание 2
В реакции каталитического окисления оксида серы (IV) до оксида серы (VI) при некоторой температуре и давлении равновесие устанавливается при следующих концентрациях веществ: [SO2] = [O2] = 1,25 моль/дм3, [SO3] = 2,4 моль/дм3. Рассчитайте константу равновесия при данных условиях.
Задание 3
Рассчитайте равновесную концентрацию йодоводорода, если известно, что Кр = 0,0156, [I2] = [H2] = 0,1 моль/дм3.
Задание 4
Напишите выражение константы равновесия для следующих обратимых процессов:
Fe (тв) + 4Н2О (г) ⇄ Fe3О4 (тв) + 4Н2 (г).
2А (г) + В (г) ⇄ С (г).
С (тв) + СО2 (г) ⇄2СО (г).
СаО (тв) + СО2 (г)⇄ СаСО3 (тв).
Задание 5
Исходные концентрации оксида углерода (II) и паров воды равны 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО + Н2О ⇄ СО2 + Н2, если равновесная концентрация СО2 оказалась равной 0,01 моль/л. Вычислите константу равновесия.
Задание 6
При температуре 625 К протекает реакция СО + Cl2 ⇄ COCl2. Равновесные концентрации: [Cl2] = 0,3 моль/л; [CО] = 0,2 моль/л и [СОCl2] = 1,2 моль/л. Вычислите константу равновесия и начальные концентрации хлора и оксида углерода (II).
Задание 7
Вычислите константу равновесия системы N2 + 3H2 ⇄ 2NH3, если в состоянии равновесия концентрация аммиака составляет 0,4 моль/л, азота 0,03 моль/л, а водорода 0,1 моль/л.
Задание 8
Укажите, как надо изменить температуру и давление (увеличить или уменьшить), чтобы равновесие в реакции разложения карбоната кальция: CaCO3 (к) ⇄ CaO (к) + СО2 (г) - 178 кДж сместить в сторону продуктов разложения.
Надеемся, что эта статья помогла вам разобраться в нюансах химического равновесия. Если вы хотите более глубоко погрузиться в эту тему и решить еще больше связанных с ней интересных задач, ждем вас на онлайн-курсах химии в Skysmart. Познакомьтесь с платформой на бесплатном вводном уроке — там мы поможем определить уровень знаний и составим индивидуальный план под цель ученика.























