Основания в химии – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксильных групп (ОН^-). Они диссоциируют в воде с образованием гидроксид-ионов. Примеры:
- NaOH (гидроксид натрия)
- KOH (гидроксид калия)
Для кого эта статья:
- ученые и исследователи
- студенты и преподаватели в области химии
- люди, которые хотят узнать, как протекают химические процессы на примере их жизни
Основания — это сложные вещества. Если подзабыли определение этого термина, прочитайте нашу соответствующую статью.
Основания (гидроксиды) — это сложные вещества, которые состоят из катиона металла и гидроксильной группы (OH).
Общая формула оснований: Me(OH)n, где Me — химический символ металла, n — индекс, который зависит от степени окисления металла.
Примеры оснований: NaOH, Ba(OH)2, Fe(OH)2.
Названия оснований
Названия гидроксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «гидроксид».
Указываем название второго химического элемента в родительном падеже.
Если второй элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оснований:
Ni(OH)2 — гидроксид никеля (II);
Al(OH)3 — гидроксид алюминия.
У некоторых оснований существуют и тривиальные названия. Собрали их в таблице.
Тривиальные названия некоторых оснований
Формула |
Название |
|---|---|
| KOH | Едкое кали |
| NaOH | Едкий натр, каустическая сода |
| Ca(OH)2 | Гашеная известь |
| Ca(OH)2 (прозрачный раствор) | Известковая вода |
| Ca(OH)2 (мутный раствор) | Известковое молоко |
| Ba(OH)2 | Едкий барит |

Классификация оснований
По растворимости в воде
В зависимости от растворимости в воде выделяют:
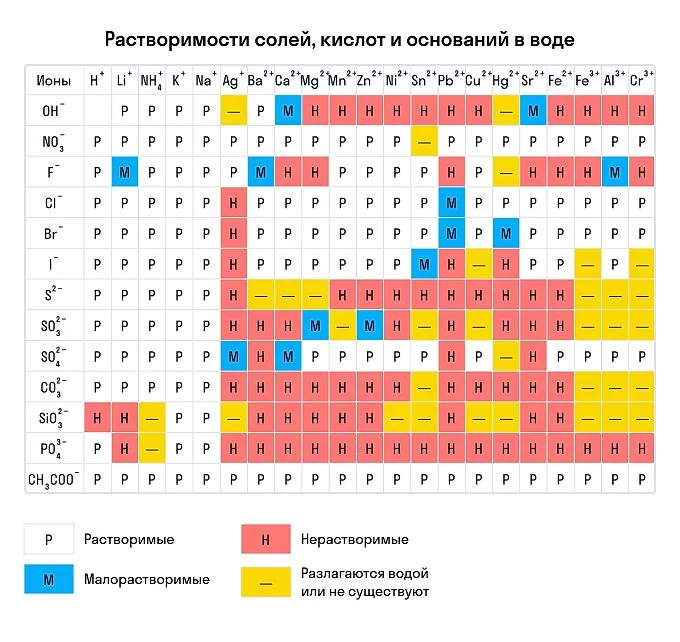
щелочи. Эти основания растворимы в воде: NaOH, KOH, Ba(OH)2 и другие. Ca(OH)2, хотя малорастворим, тоже относится к щелочам из-за своей едкости;
нерастворимые основания. К таким основаниям относятся Fe(OH)2, Cu(OH)2 и другие;
амфотерные гидроксиды. К амфотерным относятся те основания, которые образованы металлами со степенью окисления +3 или +4. Эти основания отличаются тем, что проявляют как основные свойства, так и кислотные.
Также есть основания, которые относятся к амфотерным, но образованы металлом с иной степенью окисления: Zn(OH)2, Pb(OH)2, Sn(OH)2, Be(OH)2.
Напомним, что растворимость мы проверяем по таблице растворимости кислот и оснований в воде.
По числу гидроксогрупп
В зависимости от количества гидроксильных групп, способных замещаться на кислотный остаток, выделяют следующие виды оснований:
однокислотные: KOH, NaOH;
- двухкислотные: Fe(OH)2, Ba(OH)2;
трехкислотные: Al(OH)3, Fe(OH)3.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Физические свойства оснований
Основания при обычных условиях — это твердые кристаллические вещества без запаха, нелетучие, чаще всего белого цвета. В таблице приведены основания, которые имеют иную окраску.
Цвет основания |
Примеры |
|---|---|
| Белый |
|
| Желтый | Гидроксид меди (I) CuOH |
| Светло-розовый (при соприкосновении с кислородом воздуха — коричневый) | Гидроксид марганца (II) Mn(OH)2 |
| Красно-коричневый | Гидроксид железа (III) Fe(OH)3 |
| Белый с зеленоватым оттенком (темнеет при соприкосновении с кислородом воздуха) | Гидроксид железа (II) Fe(OH)2 |
| Светло-зеленый | Гидроксид никеля (II) Ni(OH)2 |
| Синий | Гидроксид меди (II) Cu(OH)2 |
Химические свойства оснований
Растворы щелочей изменяют окраску индикатора
Гидроксид-ионы, которые содержатся в растворе щелочи, взаимодействуют с индикатором, образуя новые соединения. Признак реакции — окраска раствора.

Взаимодействие с кислотными оксидами
Щелочи вступают в реакцию с любыми кислотными оксидами. Нерастворимые основания взаимодействуют только с кислотными оксидами, которые соответствуют сильным кислотам.
Нерастворимые основания — основания, в составе которых отсутствуют активные металлы (подгруппы Ia и IIa ниже магния).
Примеры:
- гидроксид железа (III) (Fe(OH)₃)
- гидроксид меди (II) (Cu(OH)₂)
- гидроксид алюминия (Al(OH)₃)
Кислотный оксид + основание = соль + вода
Например: N2O5 + 2NaOH = 2NaNO3 + H2O
Взаимодействие с кислотами
Щелочи вступают в реакцию со всеми кислотами. Нерастворимые основания могут взаимодействовать только с сильными кислотами.
Основание + кислота = соль + вода
Например: Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
Взаимодействие основания с кислотой называют реакцией нейтрализации — это частный случай реакции обмена.
Взаимодействие с солями
Ещё один важный класс химических веществ — соли. О них мы подробно рассказывали в статье «Соли в химии — это...».
Основания взаимодействуют с растворимыми солями по обменному механизму. В результате такой реакции должен выделиться осадок или газ (CO2, SO2, NH3).
Основание + соль = другое основание + другая соль
Например: KOH + MgSO4 = Mg(OH)2↓ + K2SO4
Термическое разложение
При нагревании нерастворимые основания разлагаются на соответствующий оксид (степень окисления металла остается неизменной) и воду.
Нерастворимое основание
Взаимодействие амфотерных гидроксидов со щелочами
Продукты реакции зависят от условий ее проведения.
При сплавлении двух оснований:
Амфотерный гидроксид (тв) + щелочь (тв) = средняя соль + вода
Например: Al(OH)3 + KOH = KAlO2 + 2H2O
Если реакция проводится в растворе:
Амфотерный гидроксид (р-р) + щелочь (р-р) = комплексная соль
Например: Al(OH)3 + KOH = K[Al(OH)4]
Получение оснований
Взаимодействие металла с водой
Активные металлы (металлы групп IA и IIA, кроме Be и Mg) активно взаимодействуют с водой при обычных условиях с образованием щелочей.
Нерастворимые основания данным способом получить невозможно, за исключением Mg(OH)2.
Металл + вода = гидроксид металла + водород
Например: Na + H2O = NaOH + H2↑
Гидроксид магния можно получить данным способом, но только при нагревании:
Взаимодействие оксидов щелочных и щелочноземельных металлов с водой
Этим способом получают только растворимые в воде основания.
Оксид металла + вода = щелочь
Например: CaO + H2O = Ca(OH)2
Электролиз
Гидроксид натрия и калия в промышленности получают с помощью электролиза — через раствор хлорида калия проводят постоянный электрический ток:
KCl + H2O = KOH + H2↑ + Cl2↑
Электролиз хлорида натрия протекает по аналогичной схеме.
Получение нерастворимых оснований при взаимодействии соли со щелочью
Растворимая соль + щелочь = нерастворимое основание + другая соль
Например: Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3
Вопросы для самопроверки
Вспомните определение оснований и приведите 2 примера этих веществ.
Какие виды оснований существуют? Чем они отличаются?
К какому виду оснований относится Zn(OH)2?
Взаимодействуют ли основания с основными оксидами? Приведите примеры веществ, с которыми основания вступают в реакцию.
Можно ли получить гидроксид алюминия с помощью взаимодействия алюминия с водой?
Основания и другие темы по химии изучать интереснее, когда понимаешь, как применять знания в реальной жизни. На онлайн-курсах по химии в Skysmart преподаватели приводят яркие примеры: от процессов в природе до использования химических реакций в промышленности. Приходите учиться — вводный урок бесплатный!




















