Для кого эта статья:
- Студенты и ученые в области химии
- Преподаватели и эксперты в области естественных наук
- Тем, кто интересуется основами химии
Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K+ (катион) + A- (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na+ + Cl-.

Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na+ и анионами хлора Cl-, которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
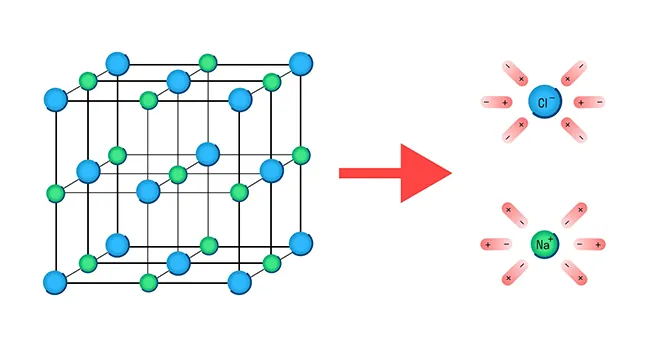
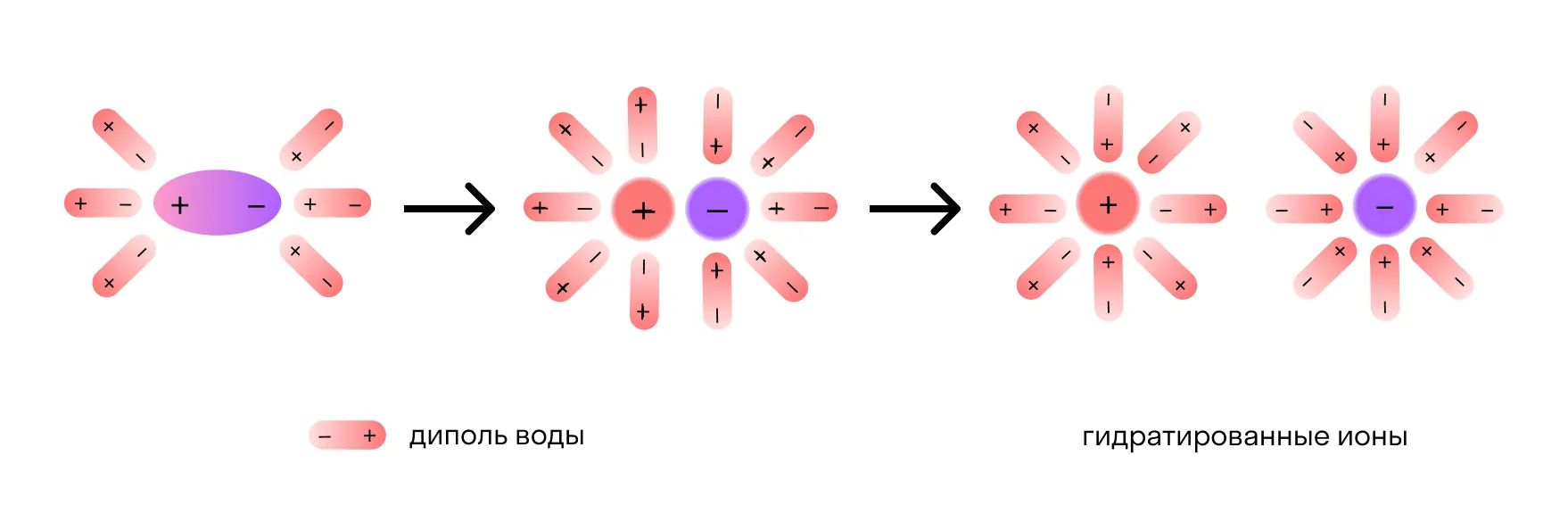
После распада хлорида натрия образовавшиеся ионы Na+ и Cl- окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
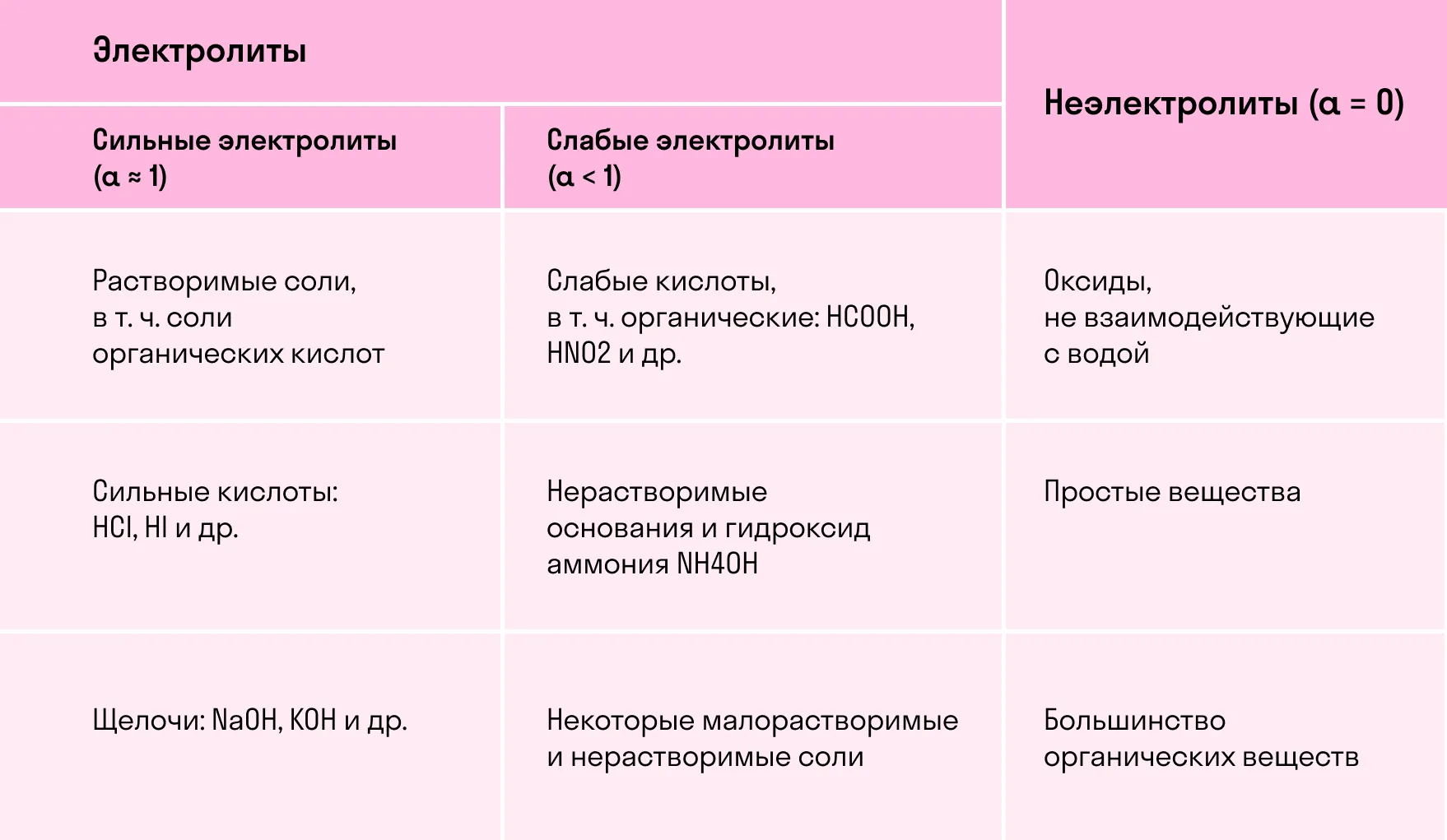
Электролиты и неэлектролиты
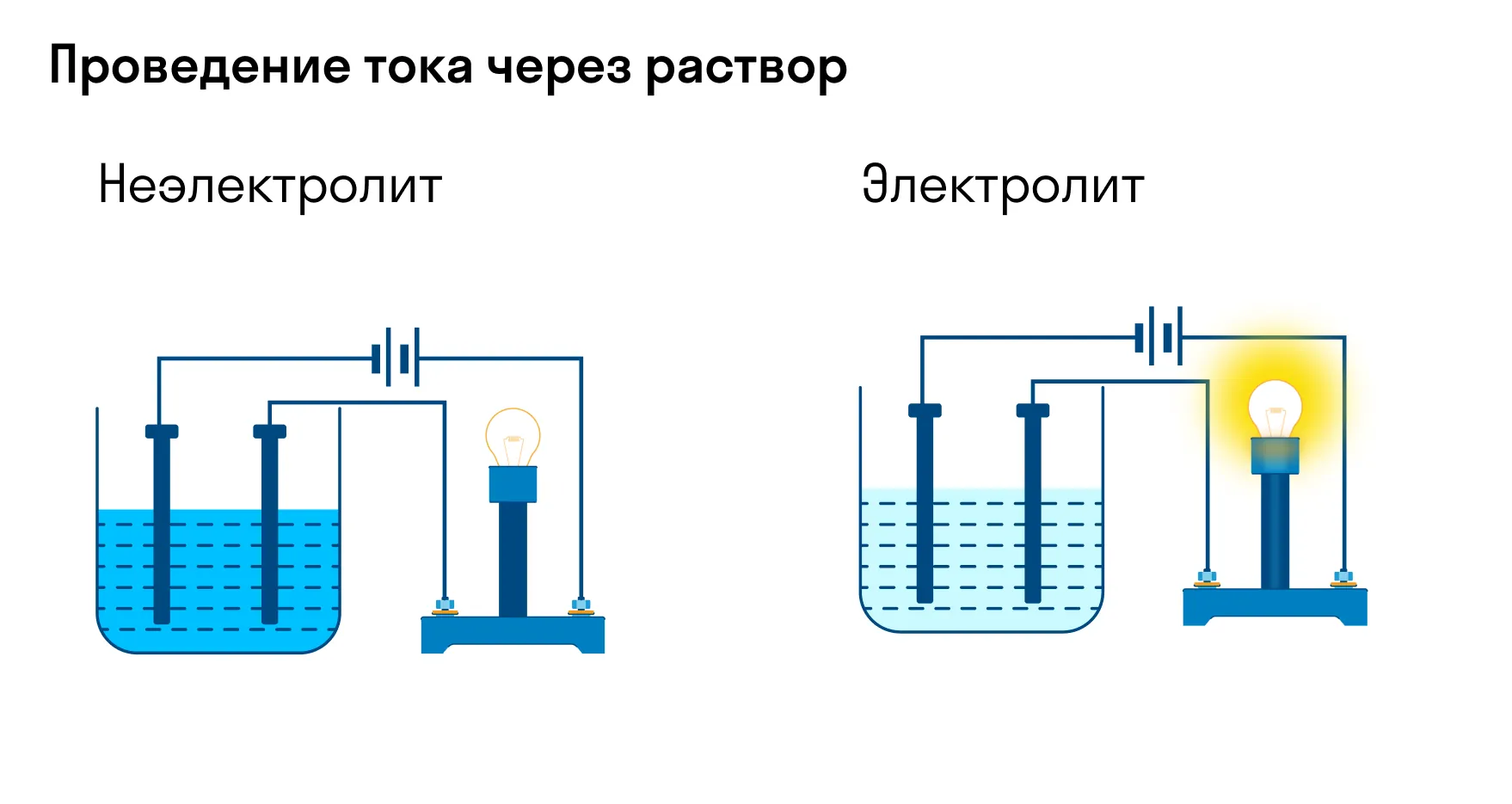
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита,
По силе электролиты делятся на следующие группы:
слабые —
средние —
сильные —
Ступенчатая диссоциация
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
H3PO4 ⇄ H+ + H2PO4-
H2PO4- ⇄ H+ + HPO42-
HPO42- ⇄ H+ + PO43-
Суммарное уравнение: H3PO4 ⇄ 3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3- и слабый электролит, поэтому реакция обратима.
Ca(HCO3)2 = Ca2+ + 2HCO3-
HCO3- ⇄ H+ + CO32-
H+ + H2O = H3O+
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Как диссоциируют разные группы веществ
Диссоциация кислот
Приводит к образованию катионов водорода H+ и отрицательно заряженных кислотных остатков:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO2 ⇄ H+ + NO2-
Многоосновные кислоты диссоциируют ступенчато:
AlOHCl2 = AlOH2+ + 2Cl-
AlOH2+ ⇄ Al3+ + OH-
Диссоциация оснований
Происходит с образованием гидроксильных групп OH- и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания:
NaOH = Na+ + OH-
Слабые основания:
Cu(ON)2 ⇄ CuOH+ + OH-
CuOH+ ⇄ Cu2+ + OH-
Диссоциация солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень.
Na3PO4 = 3Na + PO43-
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
KHSO4 = K+ + HSO4-
HSO4- ⇄ H+ + SO42-
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH-.
MgOHBr = MgOH+ + Br-
MgOH+ ⇄ Mg2+ + OH-
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты.
Не раскладывают на ионы:
слабые электролиты;
осадки;
газы.
Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Молекулярное уравнение: Pb(NO3)2 + H2SO4 → 2HNO3 + PbSO4↓
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb2+ + 2NO3- + 2H+ + SO42- → 2H+ + 2NO3- + PbSO4↓
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb2+ + SO42- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).

Основные положения теории электролитической диссоциации
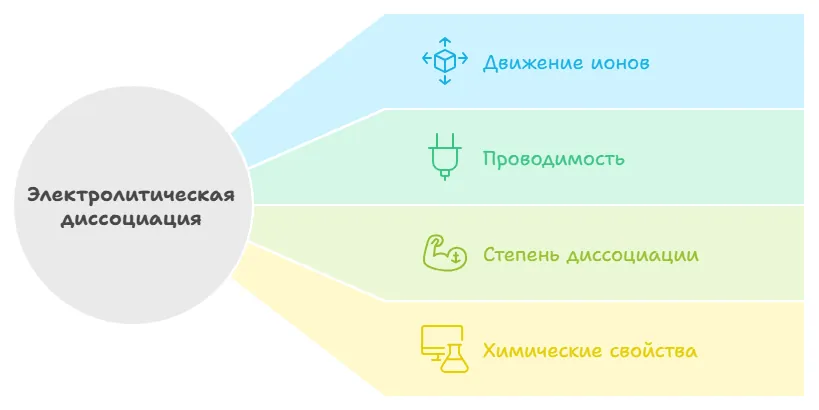
Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
Под действием электротока положительно заряженные ионы (катионы) перемещаются к отрицательно заряженному электроду (катоду), отрицательно заряженные ионы (анионы) — к положительно заряженному (аноду). Раствор электролита обладает проводимостью.
Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.
Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
Вопросы для самопроверки
Чем электролиты отличаются от неэлектролитов? Приведите примеры тех и других веществ.
Согласно теории диссоциации что является причиной распада электролитов на ионы?
Что такое степень диссоциации и как она измеряется?
В каких случаях электролитическая диссоциация кислот бывает ступенчатой?
При каких условиях в уравнении диссоциации ставится знак =, а при каких — знак ⇄?
Какие компоненты ионного уравнения не раскладываются на ионы?
Ещё одна полезная статья по химии — «Сложные эфиры».