Окислительно-восстановительные реакции - это химические реакции, при которых происходит передача электронов между веществами. Примеры:
- Fe + CuSO₄ → FeSO₄ + Cu
- 2H₂ + O₂ → 2H₂O
- Zn + 2HCl → ZnCl₂ + H₂
Эти реакции важны в процессах коррозии, энергетики.
Для кого эта статья:
- Студенты, изучающие химию
- Школьники на подготовительных курсах по химии
- Преподаватели химии, желающие использовать материал для уроков
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
Реакция окисления — это химический процесс, в котором вещество теряет электроны, что приводит к увеличению его степени окисления.
Пример: когда железо (Fe) взаимодействует с кислородом (O₂), образуется оксид железа (Fe₂O₃), и железо окисляется.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S+6 в серной кислоте (H2SO4), N+5 в азотной кислоте (HNO3) или солях-нитратах, Cr+6 в хроматах (CrO42−) и дихроматах (Cr2O72−) соответственно, а также Mn+7 (MnO4−).
В зависимости от среды проведения реакции Mn+7 и Cr+6 ведут себя по-разному. Рассмотрим на схемах:
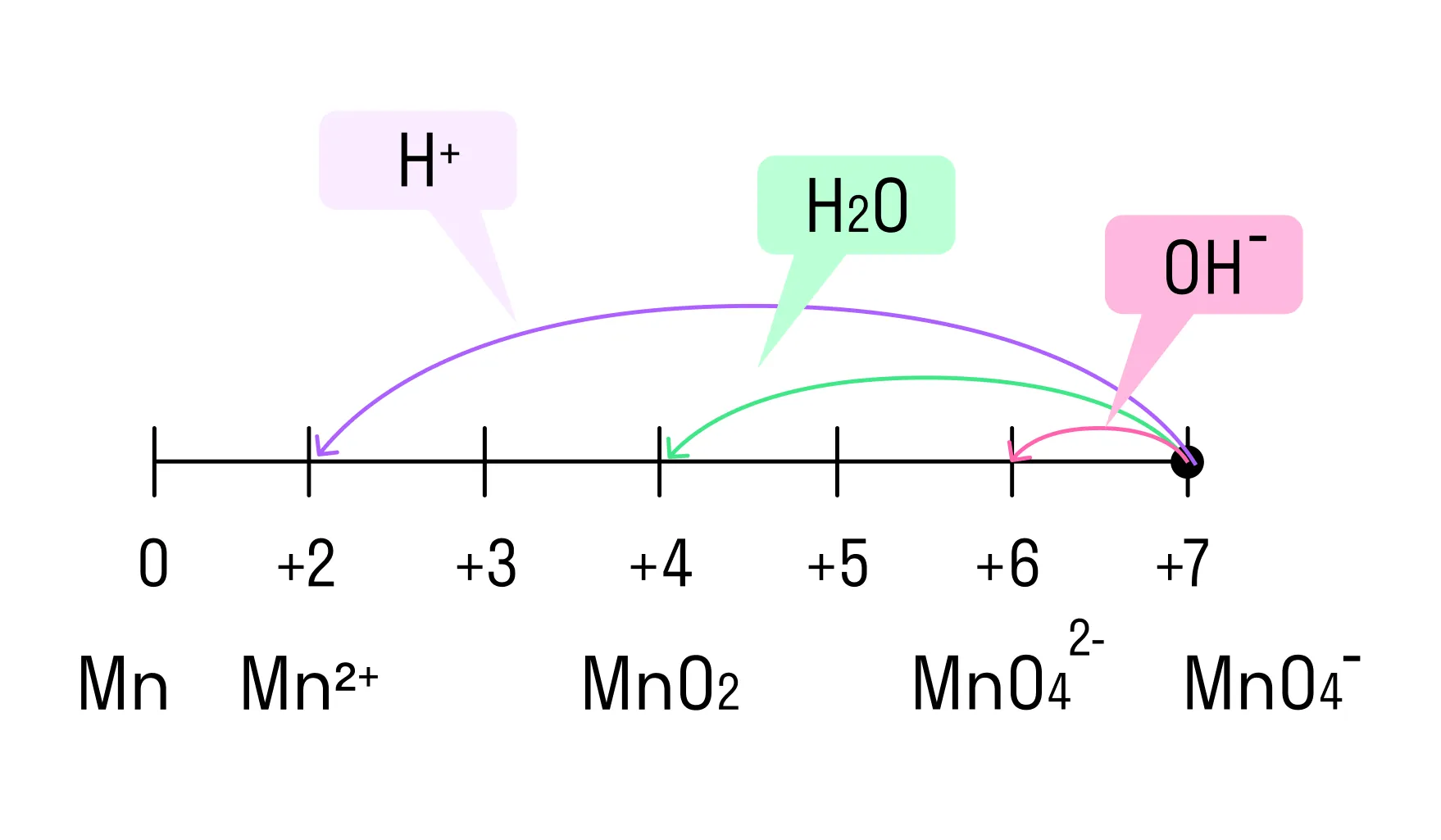
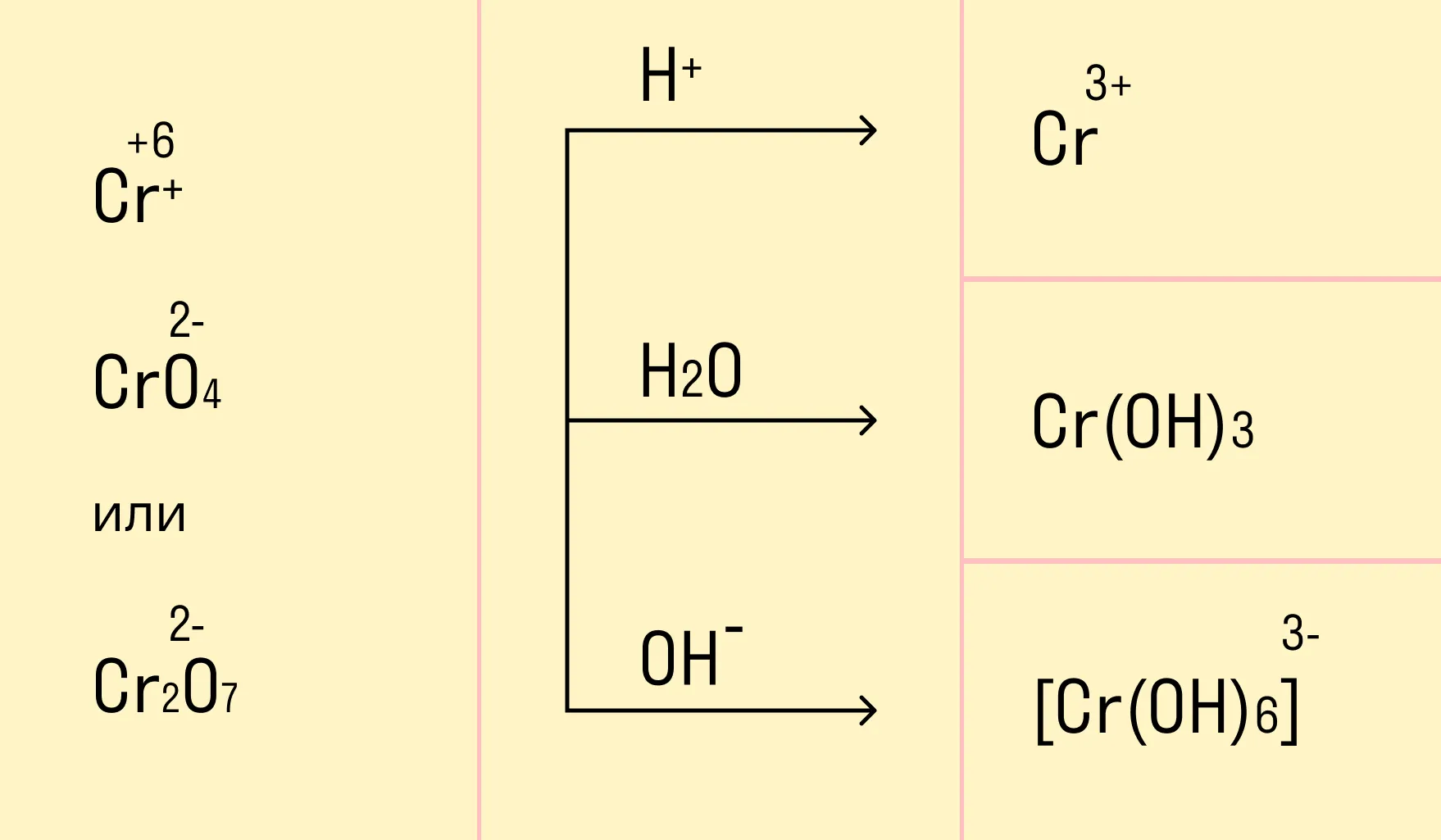
И марганец, и хром в кислой среде (H+) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH−) марганец превращается в манганат (MnO42−), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H+) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н+ при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
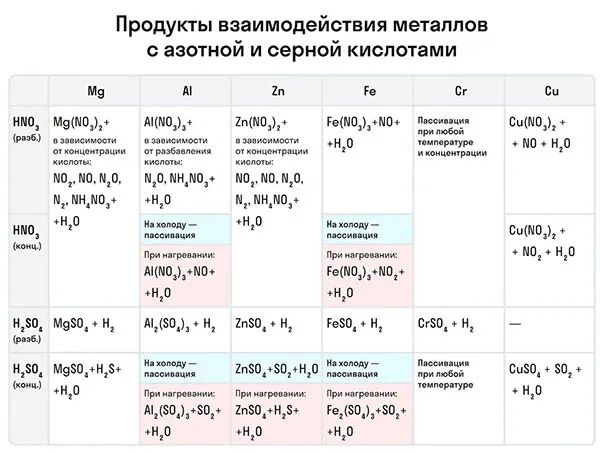
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
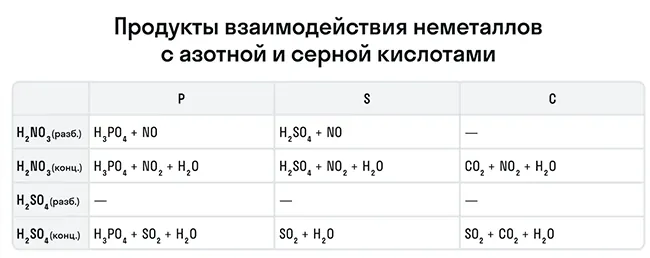
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Fe + H2SO4 (разб) = FeSO4 + H2
6СuCl + K2Cr2O7 + 14HCl (разб) = 6CuCl2 + 2CrCl3 + 2KCl + 7H2O.
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.

Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
Другая полезная статья по химии: «Сложные эфиры».
Сера
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.

Классификация окислительно-восстановительных реакций
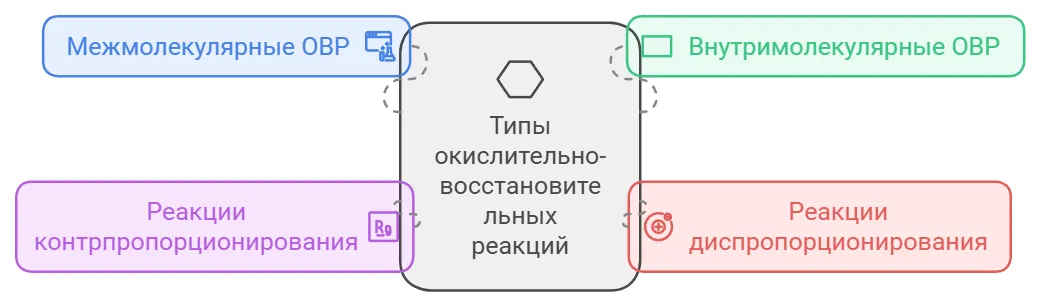
Окислительно-восстановительные реакции можно поделить на четыре типа:
межмолекулярные ОВР;
внутримолекулярные ОВР;
реакции диспропорционирования;
реакции контрпропорционирования.
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I−1).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
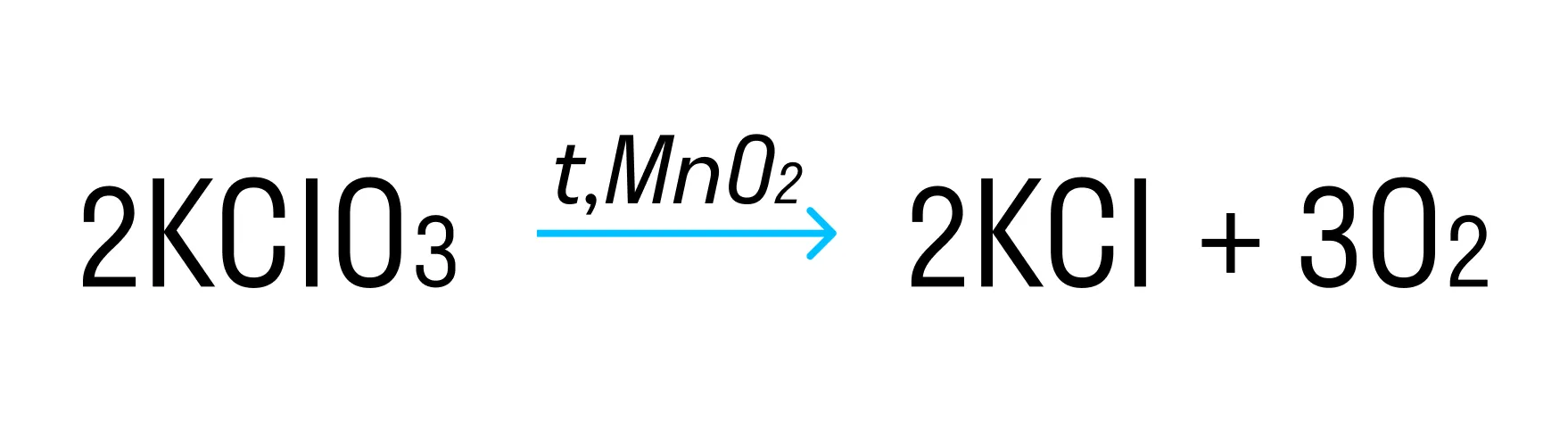
где Cl+5 — окислитель, а O−2 — восстановитель.
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
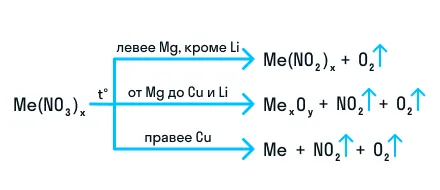
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N+3 переходит в N+5, являясь восстановителем, и N+3 переходит в N+2, являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Важным аспектом при изучении окислительно-восстановительных реакций (ОВР) является понимание степени окисления элементов в соединениях. Для более глубокого понимания этого вопроса можно ознакомиться с нашим материалом о том, как определить степень окисления элемента.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.