Агрегатное состояние вещества - это физическое состояние материи, характеризующееся определенными сочетаниями температуры и давления. Основные агрегатные состояния включают:
- Твердое (лед)
- Жидкое (вода)
- Газообразное (пар)
- Плазма (солнечная корона)
Изменение состояния сопровождается изменением энергии и других физических величин.
Для кого эта статья:
- Студенты и школьники, изучающие физику и химию
- Преподаватели и ученые, работающие в области естественных наук
- Люди, интересующиеся основами науки о материи и ее состояниях
Агрегатные состояния вещества
Чтобы разобраться с тем, какими бывают агрегатные состояния, предлагаю по ходу чтения статьи заполнять таблицу.
Агрегатные состояния | Свойства | Расположение молекул | Расстояние между молекулами | Движение молекулы |
Твердое | ||||
Жидкое | ||||
Газы |
Лед, вода и водяной пар — это все три агрегатных состояния одного вещества. Лед — твердое состояние, вода — жидкая, пар — газообразное. Для каждого вещества существует три состояния.
Твердое состояние
Его очень легко представить — это любой предмет, который мы встречаем в жизни. В этом состоянии тело сохраняет форму и объем. Расстояние между молекулами, приблизительно равно размеру самих молекул, которые, в свою очередь, расположены очень структурированно.
Такая структура называется кристаллической решеткой — из-за четкой структуры молекулам сложно двигаться, и они просто колеблются около своих положений равновесия.
Заполняем нашу табличку
Агрегатные состояния | Свойства | Расположение молекул | Расстояние между молекулами | Движение молекулы |
Твердое | сохраняет форму и объем | в кристаллической решетке | соотносится с размером молекул | колеблется около своего положения в кристаллической решетке |
Жидкое | ||||
Газы |
Жидкое состояние
В этом состоянии сохраняется объем, но не сохраняется форма. Например, если перелить молоко из кувшина в стакан, то молоко, имевшее форму кувшина, примет форму стакана. Кстати, в корове у молока тоже была другая форма.

Расстояние между молекулами в жидком состоянии чуть больше, чем в твердом, но все равно невелико. При этом частицы не собраны в кристаллическую решетку, а расположены хаотично. Молекулы почти не двигаются, но при нагревании жидкости делают это более охотно.
Вспомните, что происходит, если залить чайный пакетик холодной водой — он почти не заваривается. А вот если налить кипяточку — чай точно будет готов.
Заполняем таблицу
Агрегатные состояния | Свойства | Расположение молекул | Расстояние между молекулами | Движение молекулы |
Твердое | сохраняет форму и объем | в кристаллической решетке | соотносится с размером молекул | колеблется около своего положения в кристаллической решетке |
Жидкое | сохраняет объем | хаотично | близко друг к другу | малоподвижны, при нагревании скорость движения молекул увеличивается |
Газы |
Газообразное состояние
В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
|
Агрегатные состояния |
Свойства |
Расположение молекул |
Расстояние между молекулами |
Движение молекулы |
|
Твердое |
сохраняет форму и объем |
в кристаллической решетке |
соотносится с размером молекул |
колеблется около своего положения в кристаллической решетке |
|
Жидкое |
сохраняет объем |
хаотично |
близко друг к другу |
малоподвижны, при нагревании скорость движения молекул увеличивается |
|
Газы |
занимают предоставленный объем |
хаотично |
больше размеров молекул |
хаотичное и непрерывное |
С агрегатными состояниями разобрались, ура! Но до сих пор неясно, каким образом у каждого вещества их целых три, и как одно переходит в другое. Для этого узнаем, что такое фазовые переходы.

Фазовые переходы: изменение агрегатных состояний вещества
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
Фазовые переходы интересны тем, что все живое не Земле существует лишь благодаря тому, что вода умеет превращаться в лед или пар. С кристаллизацией, плавлением, парообразованием и конденсацией связаны многие процессы металлургии и микроэлектроники.
На схеме — названия всех фазовых переходов:
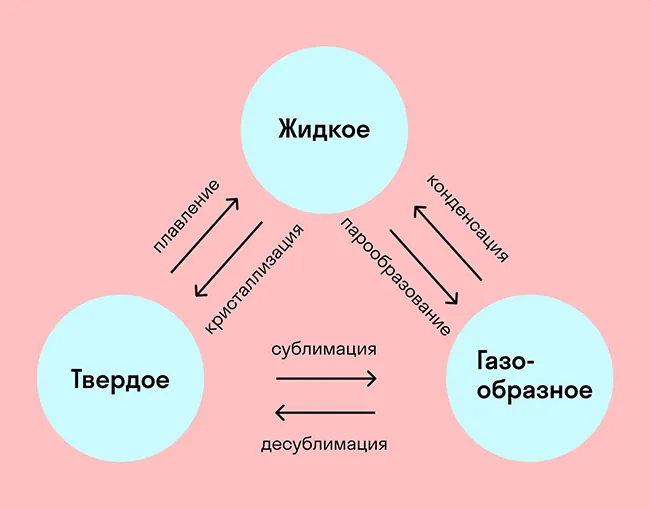
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
График фазовых переходов
Если взять процесс превращения льда в воду, воды — в пар, и обратные действия, то мы получим очень информативный график.
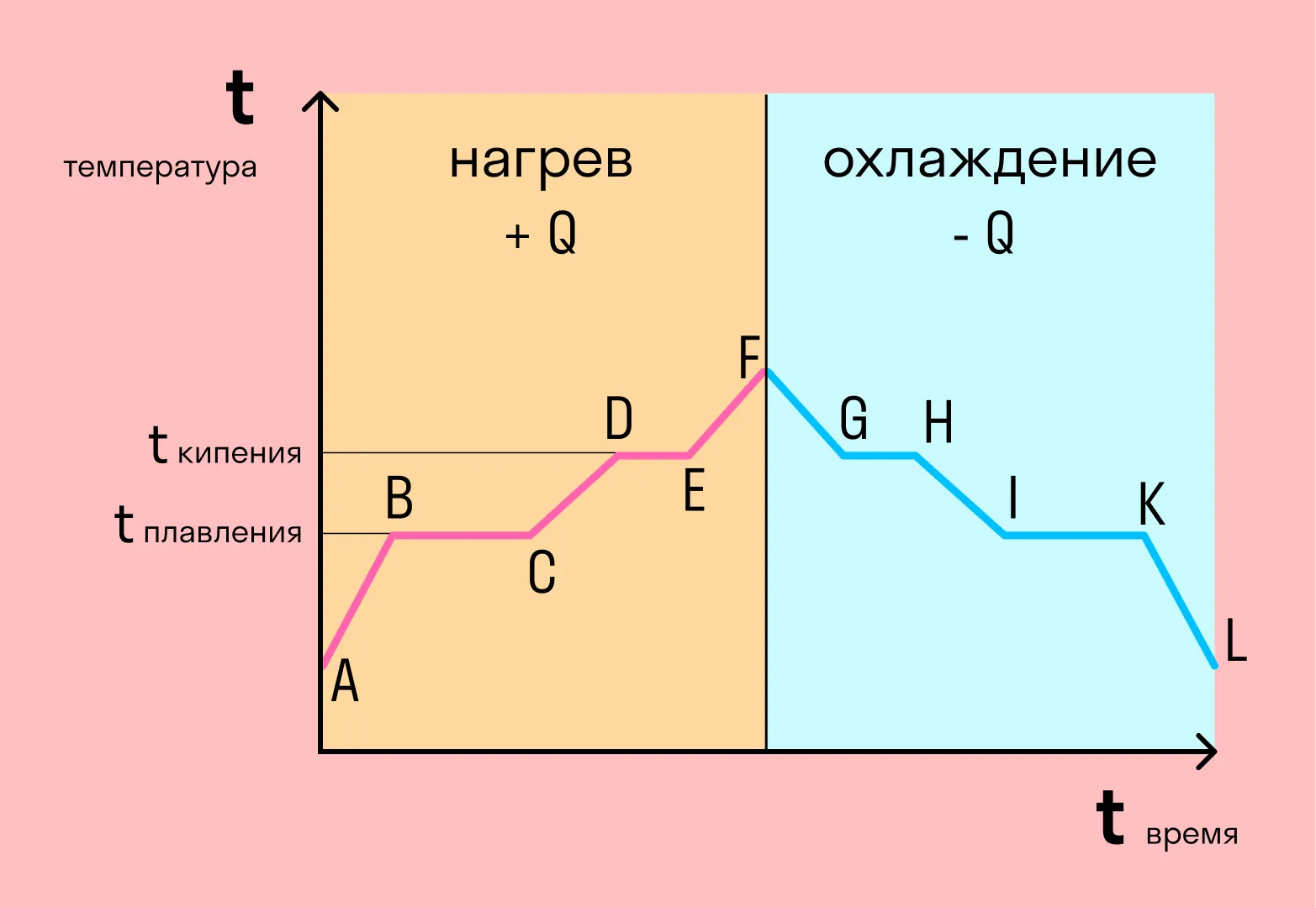
Разбираемся по шагам.
- AB — нагревание льда
Сначала взяли лед, конечно, при отрицательной температуре, потому что при нуле лед начинает плавиться. Нагрели лед до температуры плавления (до 0 градусов Цельсия).
- BC — плавление льда
После того, как лед нагрелся до температуры плавления, он начинает плавиться. В точке B это еще лед, а в точке C — уже вода. Плавление происходит при постоянной температуре и тем дольше длится, чем больше масса плавящегося вещества. Еще этот процесс зависит от свойств самого вещества, но об этом немного позже.
- CD — нагревание воды
Расплавленное вещество уже в жидком состоянии снова начинает нагреваться, и температура увеличивается, пока не достигает температуры кипения. В данном случае нагревается вода — это значит, что ее температура кипения равна 100 градусам Цельсия.
- DE — кипение (парообразование) воды
При 100 градусах вода кипит, пока не выкипит целиком. В данном случае процесс, как и плавление, происходит при постоянной температуре. Но парообразование нельзя путать с испарением, потому что парообразование происходит при конкретной температуре, а испарение — при любой.
- EF — нагревание пара
Далее полученный пар нагревается, но путем нагревания невозможно дойти до другого фазового перехода — можно пойти только обратно.
- FG — охлаждение пара
Первый шаг в обратную сторону — охлаждение до температуры кипения.
- GH — конденсация пара
Дойдя до температуры кипения (в данном случае 100 градусов), пар начинает переходить в жидкое состояние. Этот процесс также происходит при постоянной температуре.
- HI — охлаждение воды
Сконденсировавшись, вода охлаждается, пока не начнет замерзать.
- IK — кристаллизация воды
Кристаллизуется (замерзает) вода при той же температуре, что и плавится лед — 0 градусов. Кристаллизация также происходит при постоянной температуре.
- KL — охлаждение льда
После кристаллизации лед охлаждается.
С нагреванием и охлаждением все совсем просто — мы либо передаем теплоту телу (веществу), и оно идет на увеличение температуры, либо тело отдает тепло и охлаждается.
В остальных процессах температура не меняется. Это связано с тем, что количество теплоты не всегда зависит от температуры. Формулы для всех процессов выглядят так:
|
Нагревание Q = cm(tконечная − tначальная) Охлаждение Q = cm(tначальная − tконечная) Q — количество теплоты [Дж] c — удельная теплоемкость вещества [Дж/кг · ˚C] m — масса [кг] tконечная — конечная температура [˚C] tначальная — начальная температура [˚C] |
|
Плавление Q = λm Кристаллизация Q = −λm Q — количество теплоты [Дж] λ — удельная теплота плавления вещества [Дж/кг] m — масса [кг] |
|
Парообразование Q = Lm Конденсация Q = −Lm Q — количество теплоты [Дж] L — удельная теплота парообразования вещества [Дж/кг] m — масса [кг] |
Онлайн-уроки физики в Skysmart не менее увлекательны, чем наши статьи!
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по физике
-
Выбирай из 890+ репетиторов по физике
Записывайся на бесплатные курсы для детей
Решение задач по фазовым переходам
С теорией разобрались — а теперь давайте практиковаться!
Задачка раз. Температура медного образца массой 100 г повысилась с 20 °С до 60 °С. Какое количество теплоты получил образец? Удельную теплоёмкость меди считать равной 380 Дж/(кг · °С)
- Сначала нужно перевести массу в килограммы:
- Берем формулу количества теплоты для нагревания вещества:
- Подставляем числа:
100 г = 0,1 кг
Q = cm(tконечная − tначальная)
Q = 380 · 0,1 · (60 − 20) = 1520 Дж
Ответ: образец получил 1520 Дж
Задачка два. Какое количество теплоты необходимо для плавления 2,5 т стали, взятой при температуре плавления? Удельная теплота плавления стали λ = 80 кДж/кг. Теплопотерями пренебречь.
- Сначала нужно перевести массу в килограммы и удельную теплоту в Дж/кг:
- Берем формулу количества теплоты для плавления вещества:
- Подставляем числа:
2,5 т = 2500 кг
80 кДж/кг = 80 000 Дж/кг
Q = λm
Q = 80 000 · 2500 = 200 000 000 Дж = 200 МДж
Ответ: для плавления 2,5 т стали необходимо 200 МДж теплоты.
Сублимация и десублимация
Мы уже рассказали про такие процессы, как сублимация и десублимация.
- Переход из твердого состояния в газообразное, минуя жидкое — сублимация (возгонка);
- Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
|
Примерчики из жизни🤓 Про белье. Попробуйте повесить белье сушиться на улицу в мороз. Поскольку вода замерзает из-за низких температур, белье должно вернуться домой в виде большого айсберга, но этого не происходит — оно возвращается абсолютно сухим. В данном процессе произошла возгонка молекул воды (сублимация). Про принтеры. Цветные принтеры (только не лазерные) печатают путем сублимации. Вот как это работает: частицы краски быстро переходят из твердого состояния в газообразное и оседают на бумаге — так получается цветная картинка. Рисуночки на окнах. Если вы решите проехаться на автобусе в холодную погоду — увидете на стеклах чудесные узоры. Из-за огромной разницы температур между улицей и автобусом, мы можем наблюдать процесс десублимации в виде красивых рисунков на стеклах. Иней образуется похожим способом — резкое похолодание приводит к десублимации воздуха. |
Влажность воздуха: испарение и конденсация
Такие процессы, как испарение и конденсация, становятся более логичными и простыми, если их рассмотреть на примере влажности воздуха.
Влажность воздуха говорит нам о том, сколько в воздухе содержится водяного пара. Любое количество пара в воздух не запихнешь, поэтому, во-первых, его там очень мало, а во-вторых, при избыточном количестве водяного пара происходит конденсация — это когда образуется роса.
Допустим, зимой при температуре −20 градусов в 1 литре воздуха содержится 1 миллиграмм пара. Относительная влажность в таком случае равна 100% — испарения не будет, больше пара в этот воздух уже не запихнешь. Но если мы тот же воздух поместим в помещение с температурой +20 градусов, то в него может испариться уже до 17 миллиграмм пара. Значит, что его влажность будет равна 1/17 = 6%. Человеку комфортнее всего находиться при значении влажности 40–50%.
Как влажность влияет на человека
Для человека влажность очень важна, потому что мы состоим из воды на 90%. Если окружающей среде нечего испарять, она будет испарять нас. Поэтому при низкой влажности мы чувствуем сухость во рту, а при высокой — волосы впитывают влагу, разбухают и начинают виться. На этом принципе построены некоторые гигрометры — приборы для измерения влажности. Они так и называются — волосяные гигрометры. Только внутри не человеческий волос, а конский, но принцип от этого не меняется.
При высокой влажности холод и тепло воспринимаются более чувствительно. Это связано с потливостью человека при высокой температуре. Такой механизм помогает нам бороться с жарой, но при высокой влажности пот не может испариться. При испарении пота мы теряем избыточное тепло, а в данном случае этого не происходит.
При низкой влажности происходит нечто похожее. Как ни странно, в мороз мы тоже потеем (намного меньше, но все-таки это происходит). Если влажность на улице низкая, то пот испарится из-под куртки и нам будет комфортно, а при высокой влажности — он там задержится и будет проводить тепло наружу, забирая у нас драгоценные Джоули тепла. Поэтому зимой в Петербурге холоднее, чем в Москве.
Влажностью можно управлять. Существуют мешочки с шариками адсорбентами, которые кладут в коробки с обувью, чтобы впитать лишнюю влагу. Чтобы окна не запотевали, можно насыпать в рамы соль, которая также впитает влагу. А если вам наоборот нужно больше влаги — берем увлажнитель воздуха (классная вещь!): он добавляет в воздух водяной пар.