Для кого эта статья:
- Студенты и школьники, интересующиеся химией и физикой
- Преподаватели и научные работники в области естественных наук
- Любители науки и самоучки, изучающие атомную структуру
Что такое атом
Начиная изучать химию, мы понимаем, что все, что нас окружает — это вещества, состоящие из молекул, а молекулы, в свою очередь, образуются из атомов.
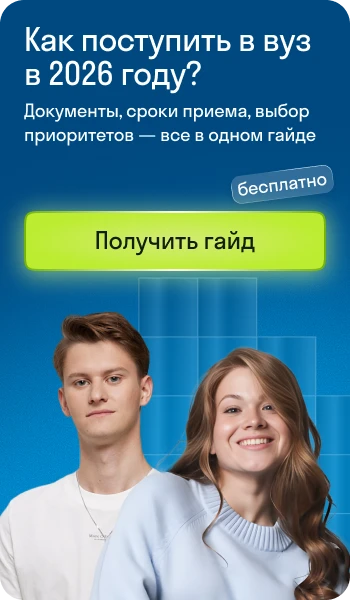
Атом — это мельчайшая частица химического элемента и источник его уникальных свойств. Эта фундаментальная единица материи играет ключевую роль в понимании химических реакций и взаимодействий, так как она определяет поведение и свойства различных веществ в природе.
Представление об атоме менялось на протяжении многих лет, и в конечном итоге современная модель строения атома включает следующие положения:
- В состав атома входит ядро и электроны.
- Ядро заряжено положительно и состоит из протонов, которые также заряжены положительно, и нейтрально заряженных нейтронов.
- Заряд ядра атома определяется количеством протонов.
- Масса ядра атома (массовое число) — это сумма нуклонов (протонов и нейтронов).
- Электроны — отрицательно заряженные частицы, которые вращаются вокруг ядра атома.
- Количество электронов в атоме равно количеству протонов.
- Атом электронейтрален.
Как выходит, что атом — это незаряженная частица? Все дело в том, что заряд ядра (а, соответственно, и количество протонов) численно равен количеству электронов в атоме, и таким образом они друг друга «компенсируют».
Выяснить состав атома очень просто: чтобы вычислить число нейтронов, необходимо вычесть из массового числа количество протонов. Заряд ядра атома, количество протонов и электронов определяется порядковым номером.
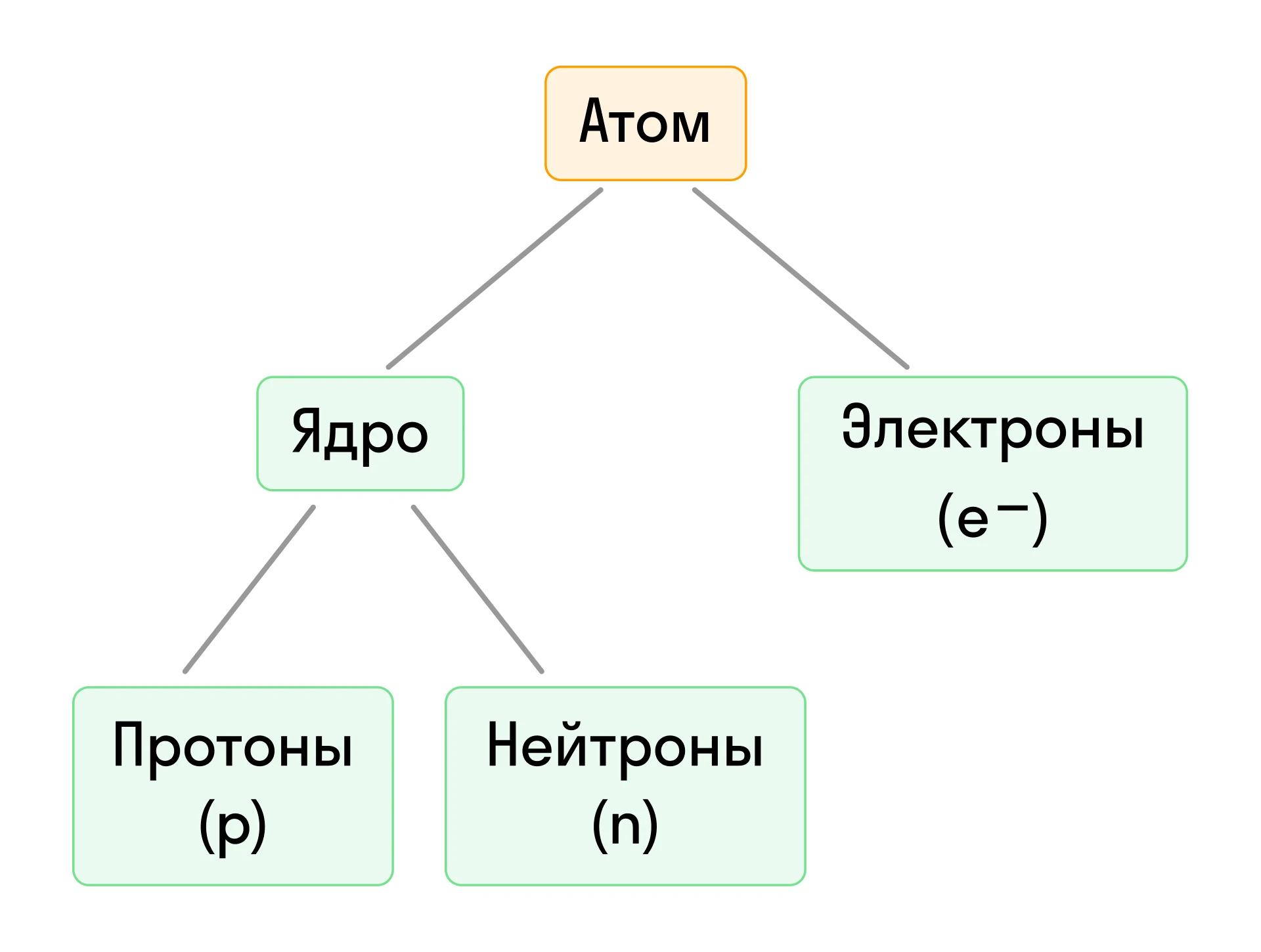
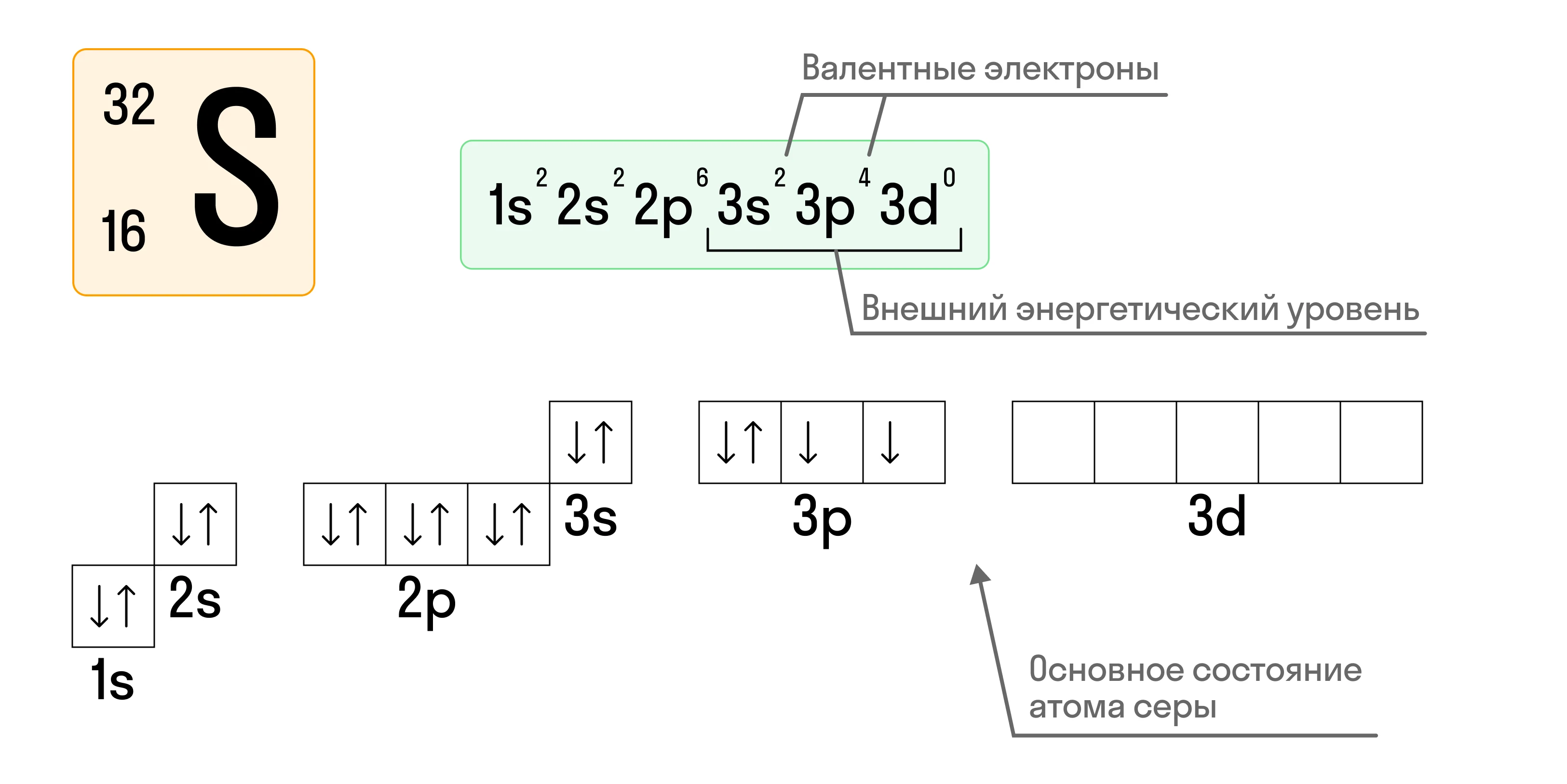
Для примера составим характеристику атома серы (S):
- Порядковый номер серы — 16, соответственно p = 16, e− = 16, +Z = +16.
- Относительная атомная масса серы Ar(S) = 32, значит n = 32 − 16 = 16.
Таким образом, атом серы содержит 16 протонов, 16 нейтронов и 16 электронов.
В разнообразных химических превращениях участвуют непосредственно электроны, которые содержатся в атоме. Атом химического элемента может либо отдавать, либо принимать электроны — так мы получаем новые соединения. Давайте узнаем подробнее, что же такое электроны и почему они играют в химии большую роль.

Электроны
Электроны — это отрицательно заряженные частицы, которые перемещаются с очень большой скоростью, образуя электронное облако. Масса электрона равна 9,1093 ⋅ 10−31 кг, а относительный заряд равен −1.
Для описания характеристики электронов применяются квантовые числа, с ними мы познакомимся по мере изучения электронов.
Атомные орбитали
Точное местоположение электрона в атоме определить невозможно, но существует пространство, в котором вероятность нахождения его максимальна. Такое место называется атомной орбиталью.
Атомная орбиталь — это участок, в котором вероятность нахождения электрона максимальна.
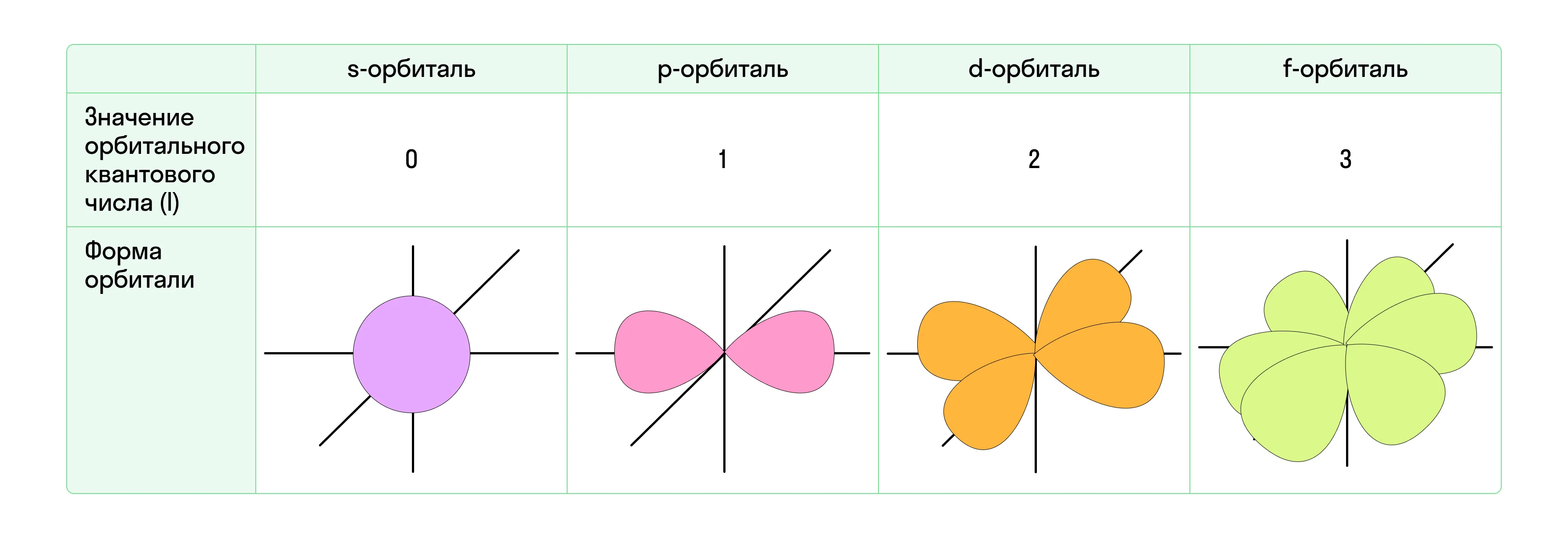
Атомные орбитали имеют четыре формы и различную ориентацию в пространстве. Форму орбитали, или, иначе, траекторию движения электрона, определяет орбитальное квантовое число l.
- s-орбиталь (шарообразная), l = 0;
- p-орбиталь (гантелеобразная или в форме восьмерки), l = 1;
- d-орбиталь (напоминает две скрещенные между собой p-орбитали), l = 2;
- f-орбиталь (орбиталь самой сложной формы, напоминает цветок), l = 3.
Энергетические уровни
Однако электроны могут перемещаться в атоме только в определенных ограниченных областях. Каждый электрон имеет свою энергию, и в зависимости от уровня этой энергии электроны располагаются на различном расстоянии от ядра, образуя электронные слои (энергетические уровни).
Энергетический уровень (ЭУ) — это совокупность электронов с близкой по значению энергией.
Энергетические уровни обозначаются номерами с 1 до 7, а определить количество уровней в атоме конкретного элемента можно по номеру периода, в котором он находится. Номер энергетического уровня также является главным квантовым числом — n.
Например, главное квантовое число для атома серы (S) равно 3, так как сера стоит в третьем периоде. Главное квантовое число всегда на единицу больше, чем орбитальное квантовое число: n = l + 1.
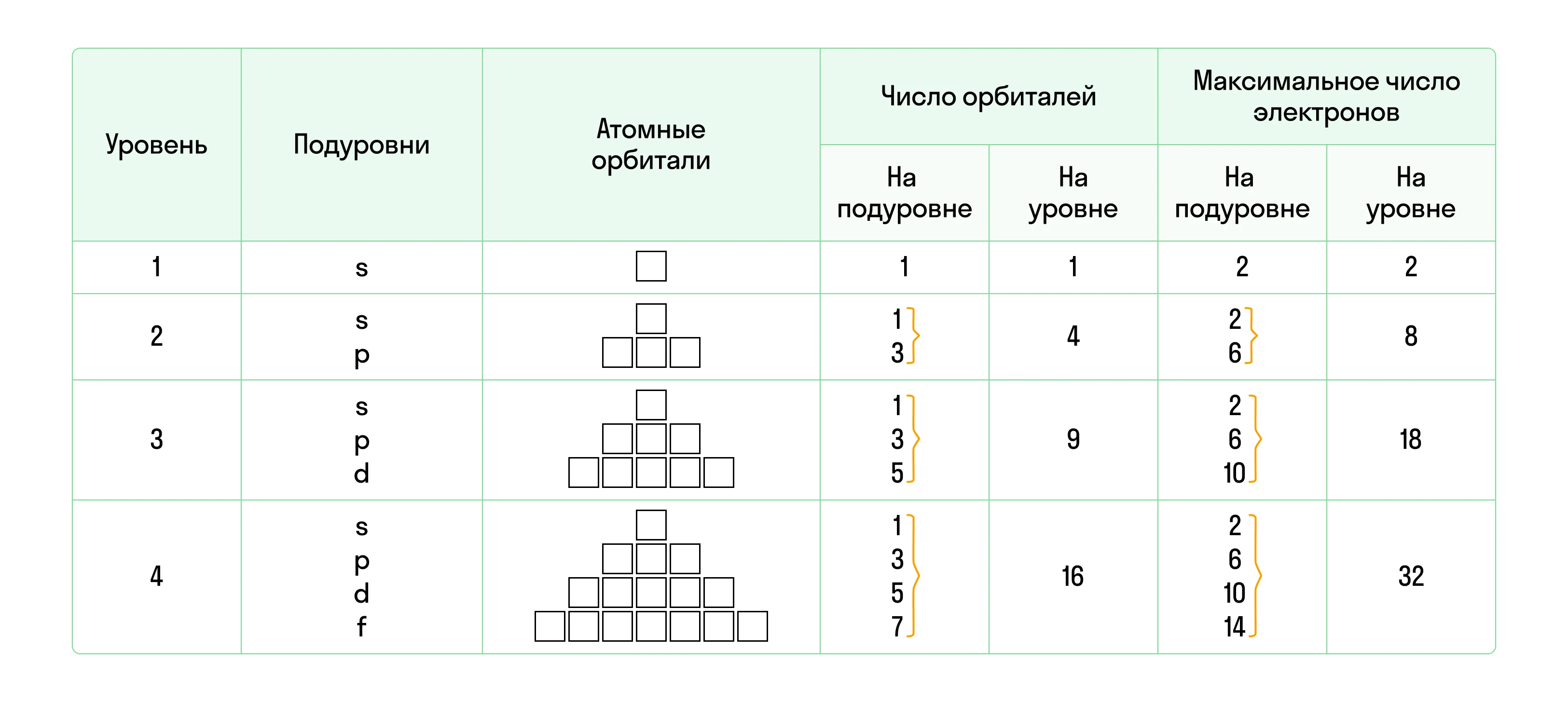
Каждый электронный слой делится на подуровни, которые образованы атомными орбиталями. Так, на первом энергетическом уровне могут располагаться только s-орбитали (s-подуровень), на втором — s- и p-орбитали (s- и p-подуровни), на третьем — s-, p- и d-орбитали (s-, p-, d-подуровни) и т. д.
Наибольшее число электронов, которое может вместить энергетический уровень, определяется по формуле:
N = 2n2, где N — количество e−, n — номер ЭУ (главное квантовое число).
Таким образом, на первом электронном слое максимально возможно расположить 2 электрона, на втором — 8 электронов, на третьем — 18 электронов и т. д. Если на уровне находится наибольшее возможное число электронов, он называется завершенным.
Электроны, находящиеся на внешнем (то есть последнем, самом дальнем от ядра атома) энергетическом уровне, называются валентными электронами, и именно они принимают участие в химических реакциях. Их число равно номеру группы, в которой расположен химический элемент.
Выходит, что
Рассмотрим все тот же атом серы (S):
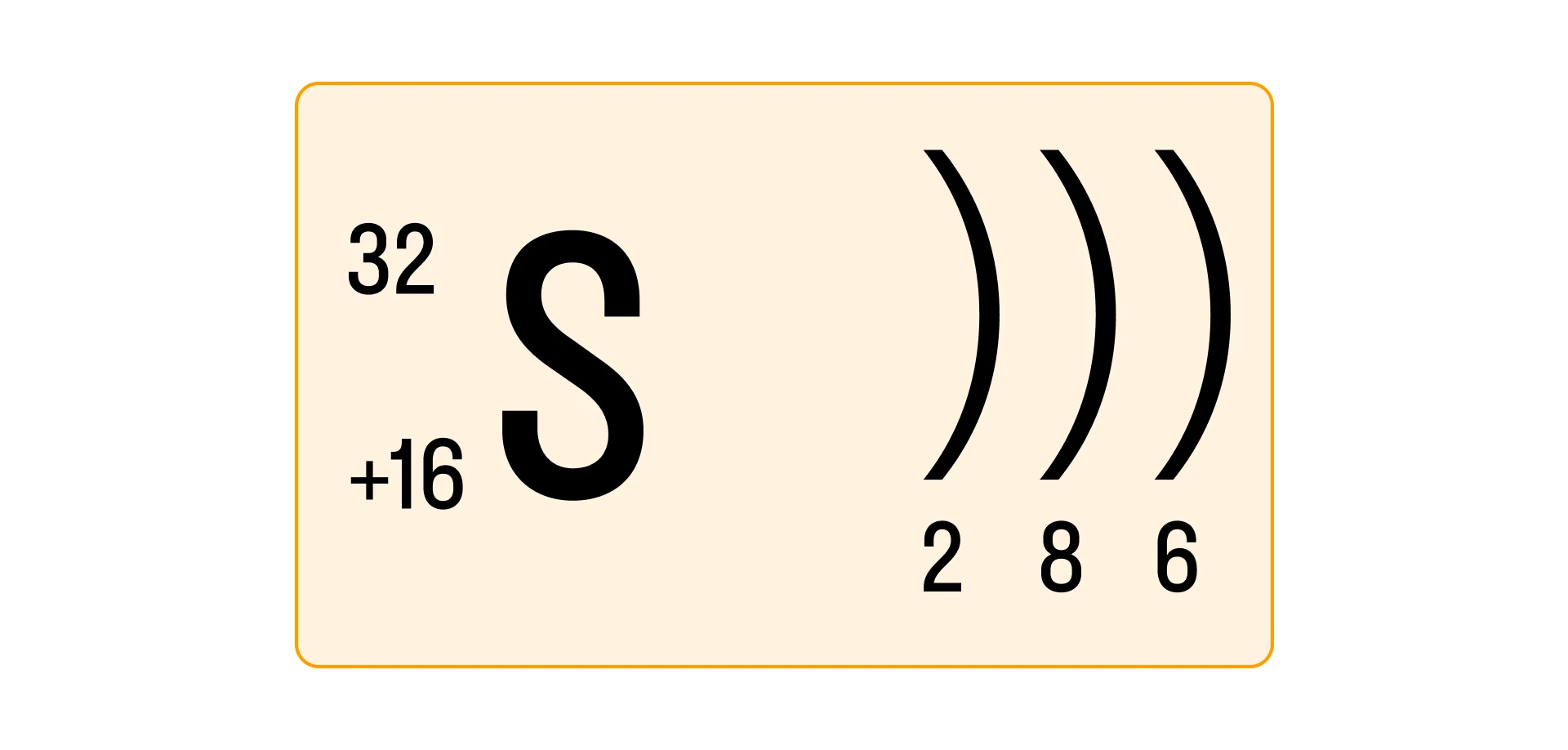
- Сера находится в VIA группе третьего периода, соответственно, атом серы содержит 3 энергетических уровня.
- Всего электронов в атоме серы 16, из которых 6 — валентные (т. е. находятся на внешнем ЭУ).
- На первом электронном слое всего одна атомная орбиталь (s), на втором — две, (s и p), на третьем — три (s, p, d).
Чтобы наглядно продемонстрировать, как именно располагаются в атоме электроны, необходимо составить своеобразный «паспорт» электрона — электронную конфигурацию.
Электронная конфигурация — это формула расположения электронов по энергетическим уровням и подуровням.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Составление электронной конфигурации
Известно, что электроны описываются квантовыми числами, но помимо уже знакомых нам орбитального и главного квантовых чисел, есть еще две немаловажные характеристики, учитывающиеся при составлении конфигураций, — магнитное и спиновое квантовое число.
Магнитное квантовое число (ml) обусловливает число орбиталей на каждом подуровне и описывает их взаимное расположение. Принимает значения от −1 до +1.
Спиновое квантовое число (ms) определяет вектор вращения электрона вокруг собственной оси и принимает значения +½ и −½.
В конфигурации обязательно учитывается номер энергетического уровня, форма орбитали и количество электронов, на ней находящихся.
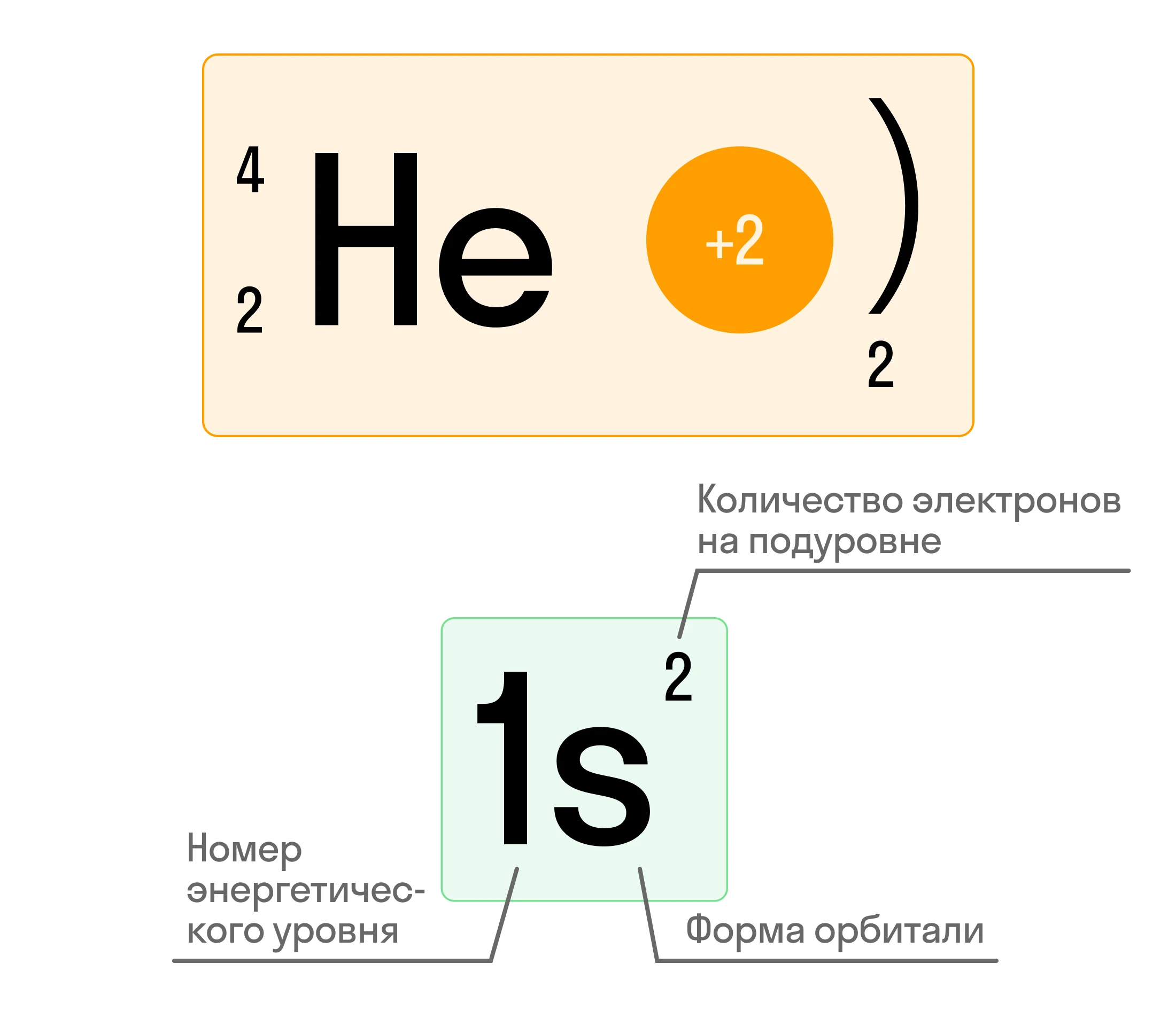
Электронная формула атома гелия (He) представляется в таком виде:
Приведем пример составления электронной конфигурации атома серы (S):
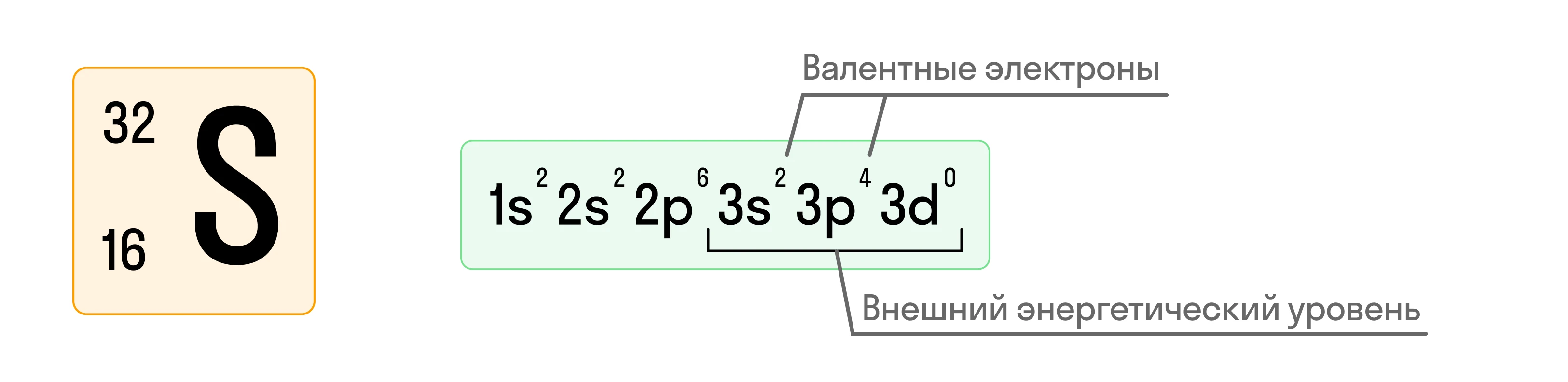
То есть сначала записывается номер ЭУ, затем — форма орбитали (подуровень) и количество электронов, находящихся на этой конкретной орбитали.
При составлении электронно-графической конфигурации необходимо соблюдать определенные правила:
- Электроны стремятся заполнить ЭУ с минимумом энергии. Поэтому заполнение начинается от первого, самого ближайшего к ядру атома, и далее по порядку. Каждый последующий слой не заполняется, если предыдущий является незавершенным.
- Если атом находится в основном состоянии, то электроны располагаются на атомных орбиталях в порядке возрастания энергии. Это означает, что электроны сначала заполняют подуровни с меньшей энергией, по порядку: s → p → d → f.
- Принцип запрета Паули. На атомной орбитали может находиться не более двух электронов. Это возможно только при условии, что эти электроны имеют противоположные спины.
- Правило Хунда. Заполнение орбиталей одного подуровня начинается с одиночных электронов, имеющих параллельные (одинаковые по знаку) спины. Только после того, как все орбитали будут заняты одиночными электронами, происходит окончательное заполнение орбиталей парами электронов с разнонаправленными спинами.
Для построения графической конфигурации необходимо учитывать, что:
- Каждая орбиталь имеет определенное количество квантовых ячеек: s-орбиталь — одну, p-орбиталь — три, d-орбиталь — пять, и f-орбиталь — семь.
- В каждой отдельной ячейке может быть не более двух электронов с различными спинами (то есть направленными в противоположные стороны).
- При этом на s-орбитали максимально возможно присутствие двух электронов, на p-орбитали — шести, на d-орбитали — десяти, на f-орбитали — четырнадцати.
- Если в квантовой ячейке находятся два электрона, то такие электроны называются спаренными. Если ячейку занимает только один электрон — он неспаренный.
Возбужденное состояние атома
Составляя электронную конфигурацию атома, мы принимаем, что атом находится в основном состоянии, то есть в состоянии с минимальной энергией. Однако некоторые атомы, получая дополнительно энергию из внешней среды, способны переходить в возбужденное состояние.
Возбужденное состояние атома возникает, когда электрон из электронной пары предыдущего уровня с меньшей энергией «расспаривается»и переходит на свободную орбиталь следующего уровня. Этот процесс позволяет атому временно повысить свою энергию и участвовать в химических превращениях, изменяя свою валентность и возможность образовывать химические связи.
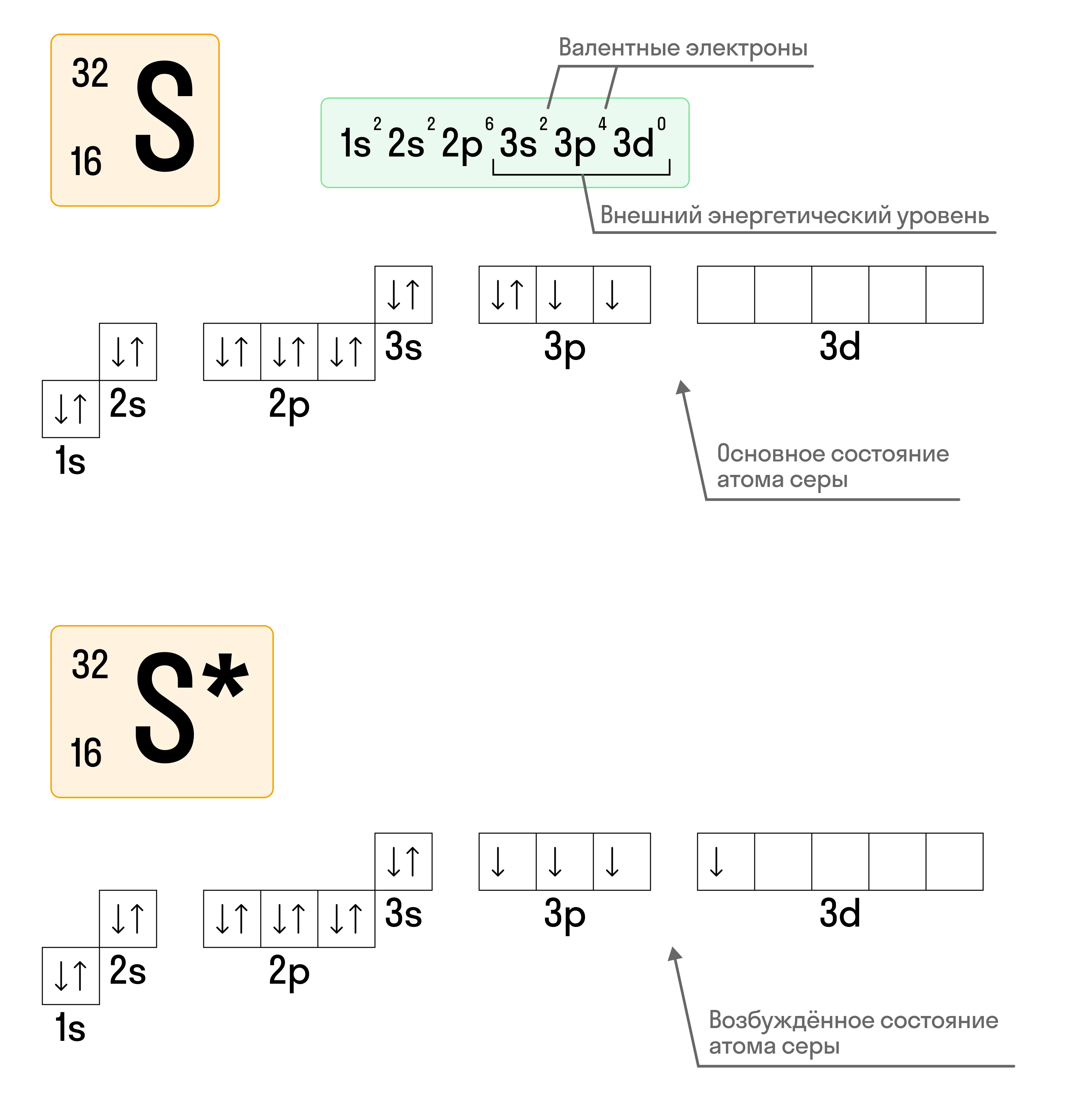
В этом случае электронная конфигурация будет выглядеть так:

Атом серы имеет также спаренные электроны на 3s-подуровне, поэтому для него возможно еще одно возбужденное состояние:
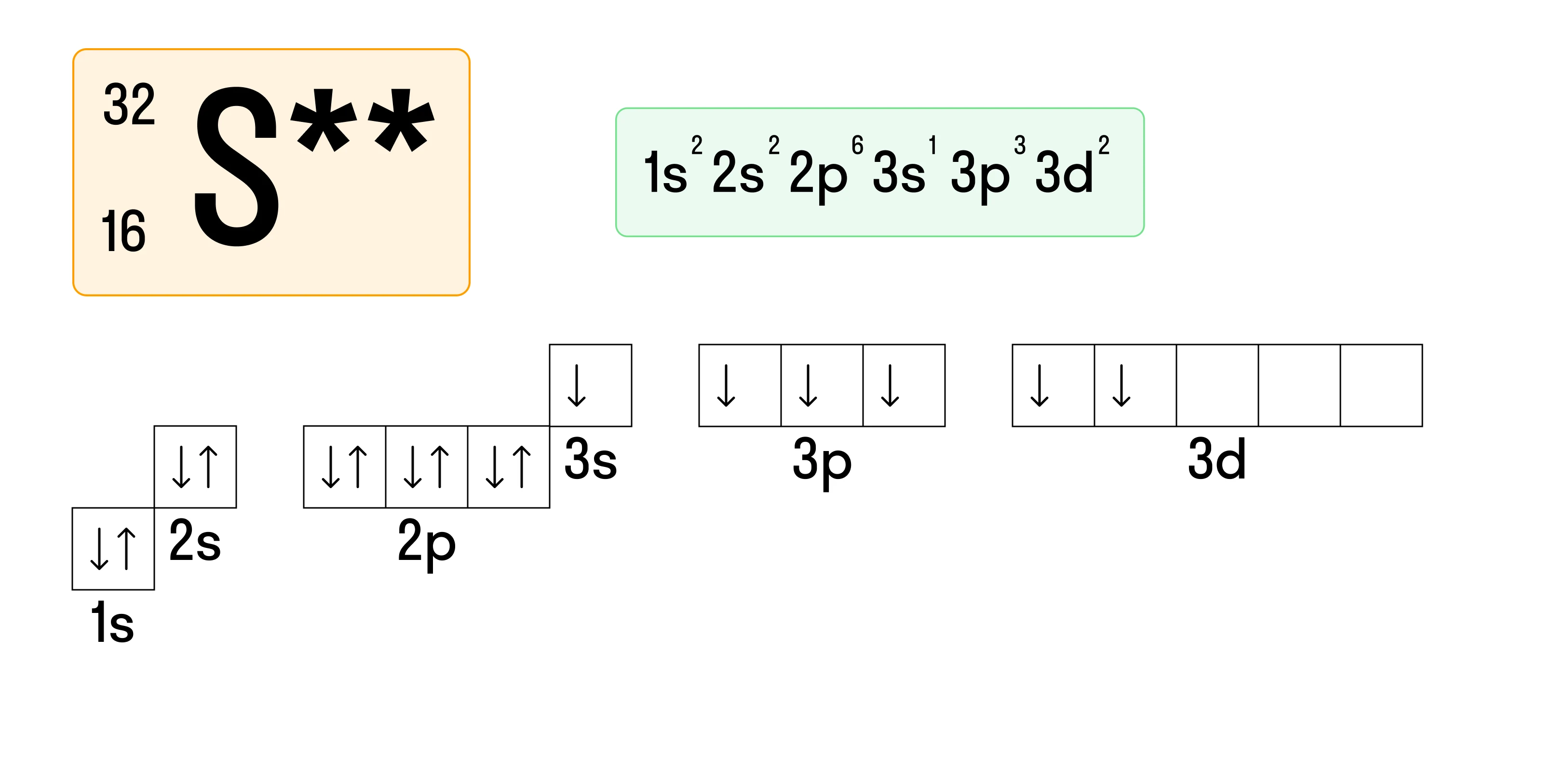
Тем, что атомы некоторых химических элементов могут переходить в возбужденное состояние, определяются их валентные возможности. Так, сера в основном состоянии обладает валентностью, равной II. В возбужденном состоянии, когда «расспариваются» только два электрона на 3p-подуровне, сера имеет валентность, равную IV, а когда оказываются «расселены» все электроны на внешнем энергетическом уровне, валентность серы равна VI.
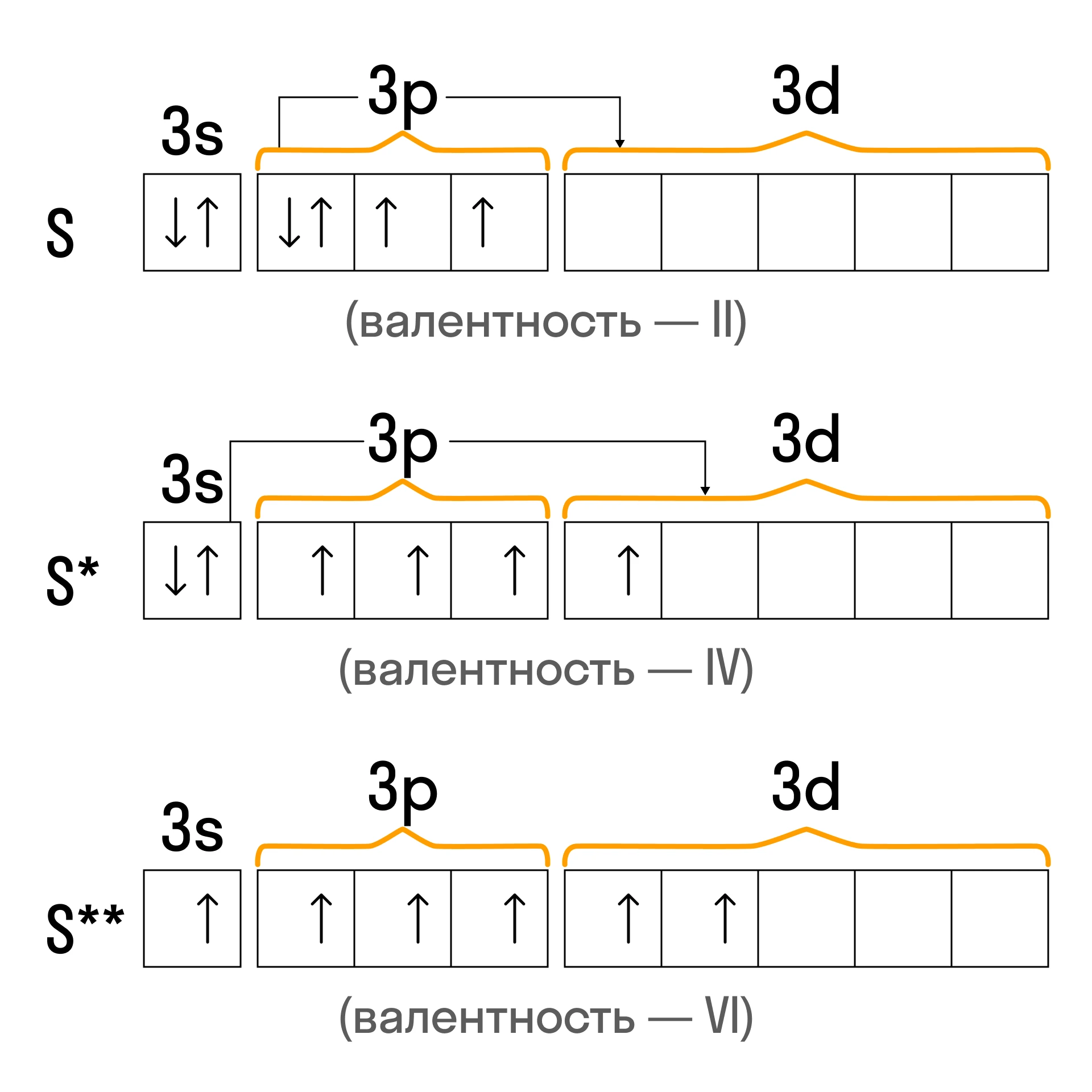
Следует помнить: возбужденное состояние характерно непосредственно для тех атомов, которые обладают свободными орбиталями. Например, известно, что третий уровень имеет три подуровня независимо от их заполнения (как у серы или фосфора).
Второй энергетический уровень характеризуется только двумя подуровнями, поэтому атомы азота (N), кислорода (O) или фтора (F) не смогут перейти в возбужденное состояние, так как не обладают свободными орбиталями.
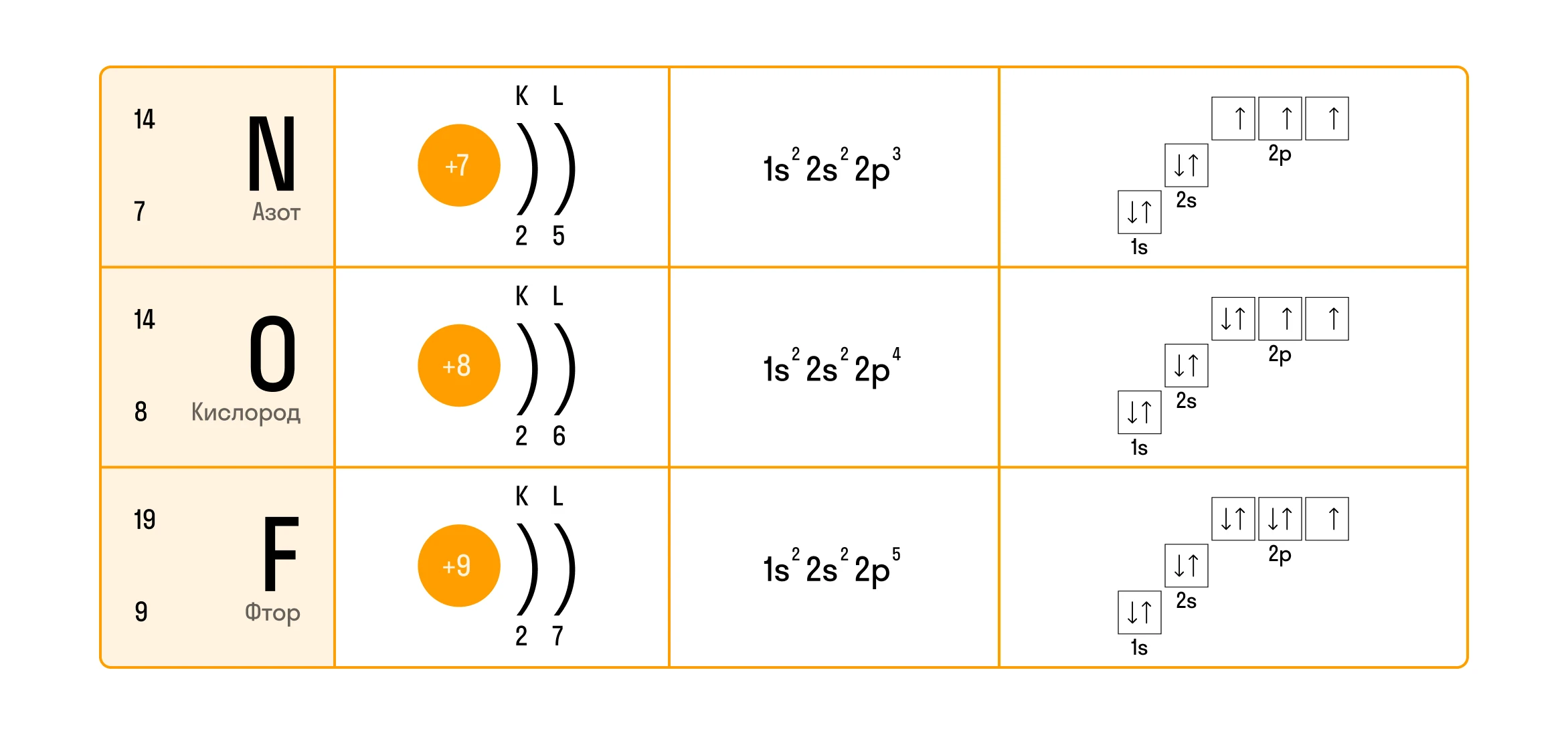
Еще несколько примеров электронно-графической конфигурации для закрепления темы:
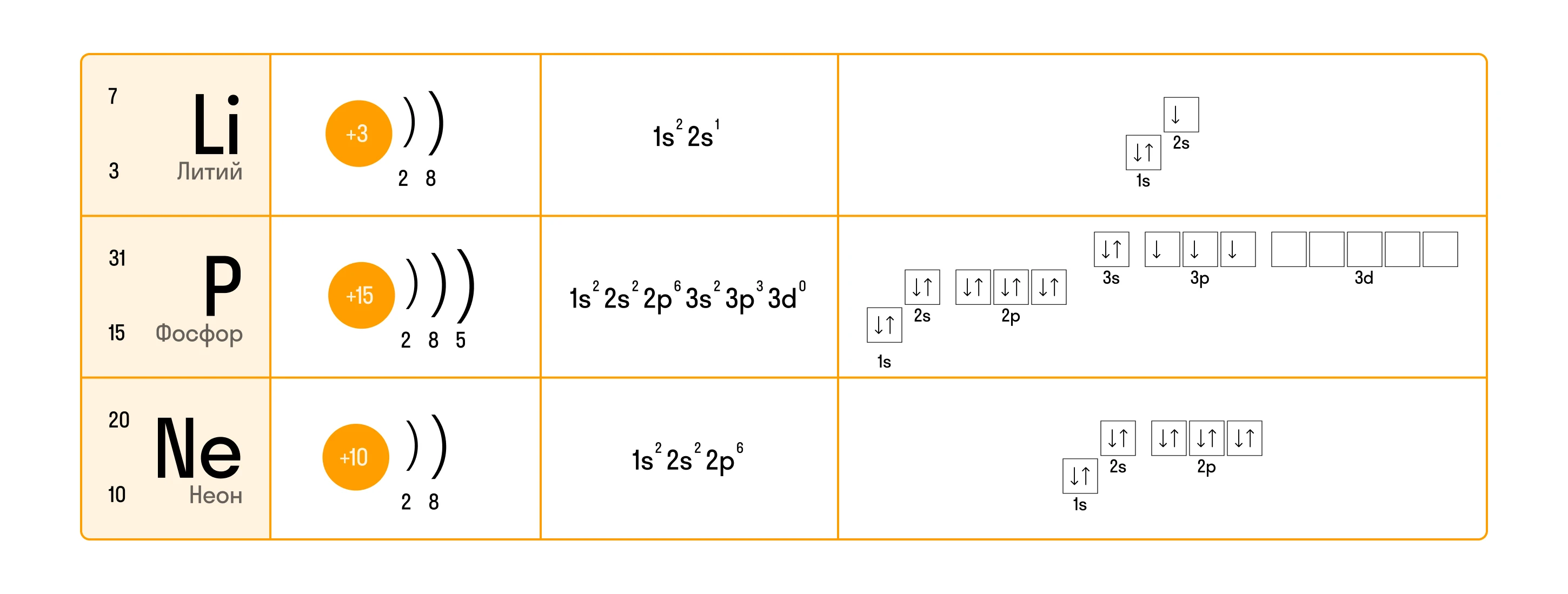
Понимание электронных конфигураций играет исключительную роль в химии. Знание о распределении электронов по энергетическим уровням и подуровням позволяет не только предсказывать, но и объяснять уникальные свойства химических элементов и их реакционную способность.
Пора проверить себя
- Что не является частью атома?
- Протоны
- Нейроны
- Нейтроны
- Электроны
- Какое максимальное число электронов может находиться на втором энергетическом уровне?
- 8
- 2
- 16
- 32
- Внешний энергетический уровень…
- Находится ближе всего к ядру атома
- Содержит валентные электроны
- Определяется номером группы
- Свойственен только для элементов третьего периода
- Электронная конфигурация атома Na:
- 1s22s22p63s1
- 1s22s22p53s2
- 1s12s22p63s1
- 1s22s22p63s2
Ответы
1. b, 2. a, 3. b, 4. a.