Для кого эта статья:
- студенты и школьники, изучающие химию
- преподаватели и репетиторы по химии
- люди, интересующиеся изучением химических реакций и их закономерностей
Определение и формулы
Скорость химической реакции определяется как преобразование концентрации реагирующих веществ за единицу времени в гомогенных (однородных) системах, или изменение количества вещества на единицу реакционной поверхности в гетерогенных (неоднородных) системах.
Обозначают скорость реакции буквой υ, а её единица измерения — моль/л・с.
Определить скорость можно по следующим формулам:
Для гомогенных систем:
Для гетерогенных систем:
Посмотрим, как используется эта величина при решении задач:
В реакции образования воды O2 + 2H2 = 2H2O начальная концентрация кислорода равна 0,5 моль/л, а через 2 минуты концентрация оказалась равной 0,25 моль/л. Чему равна скорость данной реакции?
Итак, нам известно следующее: C1 = 0,5 моль/л, C2 = 0,25 моль/л, t2 = 2 мин = 120 с. Также отмечаем, что начальное время реакции t1 = 0 с.
Чтобы рассчитать υ, необходимо вначале определить дельты:
- ΔС = C2 − C1 = |0,25 − 0,5| = |−0,25| = 0,25 моль/л
- Δt = t2 − t1 = 120 − 0 = 120 с
Затем рассчитываем скорость реакции по формуле, справедливой для гомогенных систем: υ = ΔС/Δt = 0,25/120 = 0,002 моль/л・с.
Итак, искомая нами скорость реакции составила 0,002 моль/л・с.
Важно понимать, что

Влияние природы реагирующих веществ
Природа реагирующих веществ определяется характером химической связи в веществах и их строением. Менее активные вещества реагируют медленнее, тогда как более активные легко и быстро вступают в реакции с другими веществами.
Так, к примеру, чем более активен металл, тем более бурно он будет реагировать в водой. Щелочные металлы с водой взаимодействуют крайне активно, при такой реакции может происходить взрыв, выделяется тепло и свет. Менее активные металлы с водой могут не взаимодействовать вовсе.
Таким образом,
Если среда реакции неоднородная, то есть процесс происходит в гетерогенной системе, то также учитывается площадь поверхности реагирующих веществ. Например, реакция взаимодействия гранул цинка с соляной кислотой пройдет быстрее, если гранулы измельчить: Zn(тв) + 2HCl(р-р) = ZnCl2 + H2 ↑.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Влияние изменения концентрации
Концентрация — это количество того или иного вещества, содержащееся в определенной массе или объеме раствора.
Выразить концентрацию можно разными способами, например, как массовую долю, мольную долю, но в нашей теме используется молярная концентрация (С), показывающая количество вещества (моль) в одном литре раствора.
Влияние концентрации на скорость продиктовано законом действующих масс:
Скорость элементарной химической реакции прямо пропорциональна произведению молярных концентраций реагирующих веществ, возведенных в степени, равные их стехиометрическим коэффициентам.
Если реакция имеет вид aA + bB = cC +dD, то закон действующих масс будет иметь вид: υ = k・CaA・CbB , где υ — скорость химической реакции, [моль/л・с], CA и CB — молярные концентрации веществ A и B, [моль/л], k — константа скорости реакции, не зависящая от концентрации реагирующих веществ.
Исходя из этого, можно сделать вывод, что
Влияние изменения температуры
При повышении температуры частицы любого вещества ускоряют свое движение, что приводит к возрастанию числа активных соударений. Следовательно, с ростом температуры скорость химической реакции также увеличивается.
Зависимость скорости реакции от температуры отражает правило Вант-Гоффа:
При увеличении температуры на каждые 10॰ скорость реакции увеличивается в 2–4 раза
Эту зависимость можно выразить математически:
υ2 = υ1 ・γ(T2−T1)/10, где υ2 — скорость при температуре T2, υ1 — скорость реакции при температуре T1, γ — температурный коэффициент скорости реакции, принимающий значения в диапазоне от 2 до 4.
Давайте применим правило Вант-Гоффа:
Как и во сколько раз изменится скорость реакции, если реакционную смесь нагрели от 150॰ до 200॰, а температурный коэффициент равен 4?
Нам известно следующее: T1 = 150॰, T2 = 200॰, γ = 4.
Изменение скорости реакции характеризуется отношением скоростей υ2/υ1. Тогда:
υ2/υ1 = γ(T2−T1)/10 = 4(200−150)/10 = 1024,
значит, скорость реакции увеличилась в 1024 раза.
Итак,
Катализаторы и ингибиторы
Повысить или понизить скорость химической реакции можно с помощью специальных веществ — катализаторов и ингибиторов.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ходе реакции не расходуется.
При воздействии катализатора происходит снижение энергии активации, которая необходима для протекания реакции:
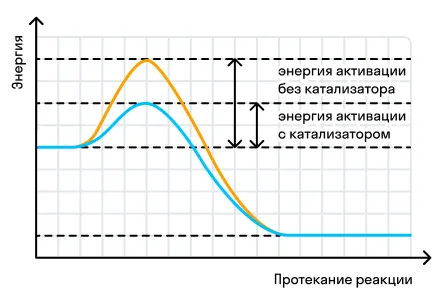
Если в проведении реакции участвует катализатор, то такие реакции являются каталитическими.
Катализаторы могут быть как гомогенными, то есть находящимися в одной фазе с реагирующими веществами, так и гетерогенными, образующими самостоятельную фазу, отделенную от той, в которой находятся реагенты.
|
Примеры катализаторов |
|
|---|---|
|
Органическая химия |
|
|
Процесс |
Катализатор |
|
Гидрирование/дегидрирование |
Ni, Pt, Pd |
|
Изомеризация |
AlCl3 |
|
Тримеризация ацетилена |
Cакт |
|
Дегидратация |
Al2O3 |
|
Неорганическая химия |
|
|
Процесс |
Катализатор |
|
Синтез аммиака |
Fe |
|
Окисление сернистого газа |
V2O5 |
|
Окисление аммиака |
Pt |
Ингибитор — вещество, замедляющее химическую реакцию.
Применение ингибиторов позволяет существенно замедлить процессы коррозии металлов, старения полимеров и окисления топлива, что способствует увеличению срока службы и сохранению качества различных материалов и продуктов.
Скорость химической реакции — важный параметр, который определяет то, насколько быстро протекают химические процессы. Мы рассмотрели основные факторы, влияющие на скорость, поэтому пора переходить к отработке полученных знаний на практике.
Пора проверить себя
- Из предложенного перечня выберите все факторы, приводящие к увеличению скорости реакции: 2CuS(тв) + 3O2(г) = 2CuO(тв) + 2SO2(г) + Q.
- Понижение температуры
- Увеличение концентрации SO2
- Измельчение CuS
- Повышение давления
- Уменьшение концентрации SO2
- Из предложенного перечня выберите все факторы, влияющие на скорость реакции: Fe + H2SO4 = FeSO4 + H2.
- Добавление FeSO4
- Измельчение Fe
- Понижение температуры
- Увеличение концентрации H2
- Повышение давления