Для кого эта статья:
- Студенты или школьники, изучающие химию
- Выпускники и специалисты в области химии и химической технологии
- Преподаватели и репетиторы, готовящие материалы для уроков химии
Химические свойства алканов
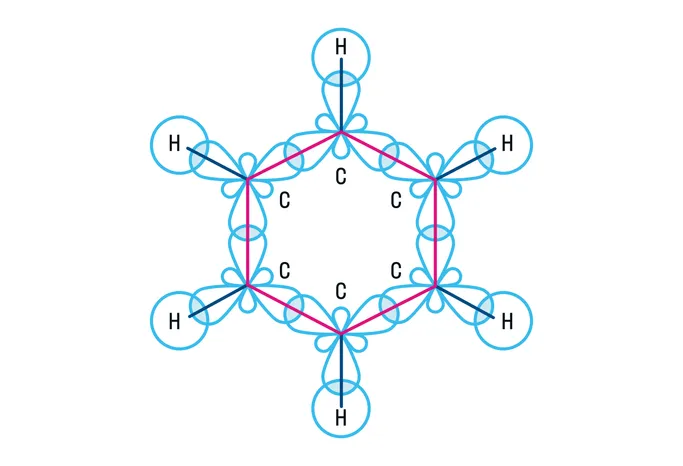
Алканы — это предельные углеводороды, содержащие только одинарные связи между атомами углерода, так как все атомы углерода находятся в состоянии sp3-гибридизации.
Общая формула алканов имеет вид CnH2n+2 .
Алканы не обладают большой реакционной способностью и вступают в ограниченное количество взаимодействий.
Реакции замещения
Галогенирование
Алканы взаимодействуют со всеми галогенами, кроме фтора (F). Для реакции необходимы определенные условия: освещение и нагревание. В результате один атом водорода замещается на атом галогена. Реакция может продолжаться вплоть до полного замещения атомов водорода на атомы хлора.
При галогенировании сначала замещается атом водорода у третичного атома углерода, затем у вторичного и, в последнюю очередь, у первичного. Продукты реакции называются галогеналканы или галогенпроизводные алканов.
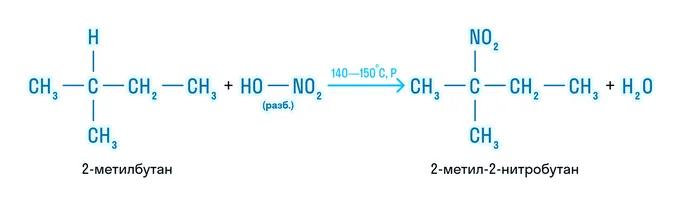
Нитрование (реакция Коновалова)
Взаимодействие с раствором азотной кислоты (HNO3) с образованием нитропроизводных:
R一H + HO一NO2 → R一NO2 + H2O
Реакция проводится при температуре 140–150॰С.
Реакции разложения
Дегидрирование
При отщеплении водорода от алканов в присутствии катализатора — никеля (Ni) образуются алкены:
CH3一 CH3 → CH2=CH2 + H2
Крекинг
Процесс свойственен для молекул алканов с длинной углеродной цепью. Происходит разрыв связей между атомами углерода и образование смеси алканов и алкенов с меньшей молекулярной массой:
Пиролиз метана
При медленном нагревании до 1500॰С:
CH4 → C + 2H2
При быстром нагревании до 1500॰С:
2CH4 → C2H2 + 3H2
Реакции окисления
Полное окисление (горение)
Схема реакции:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O
Каталитическое окисление
Изомеризация
Алкан, углеродный скелет которого включает 4 и более атомов углерода, способен изменять своё строение, то есть изомеризоваться:

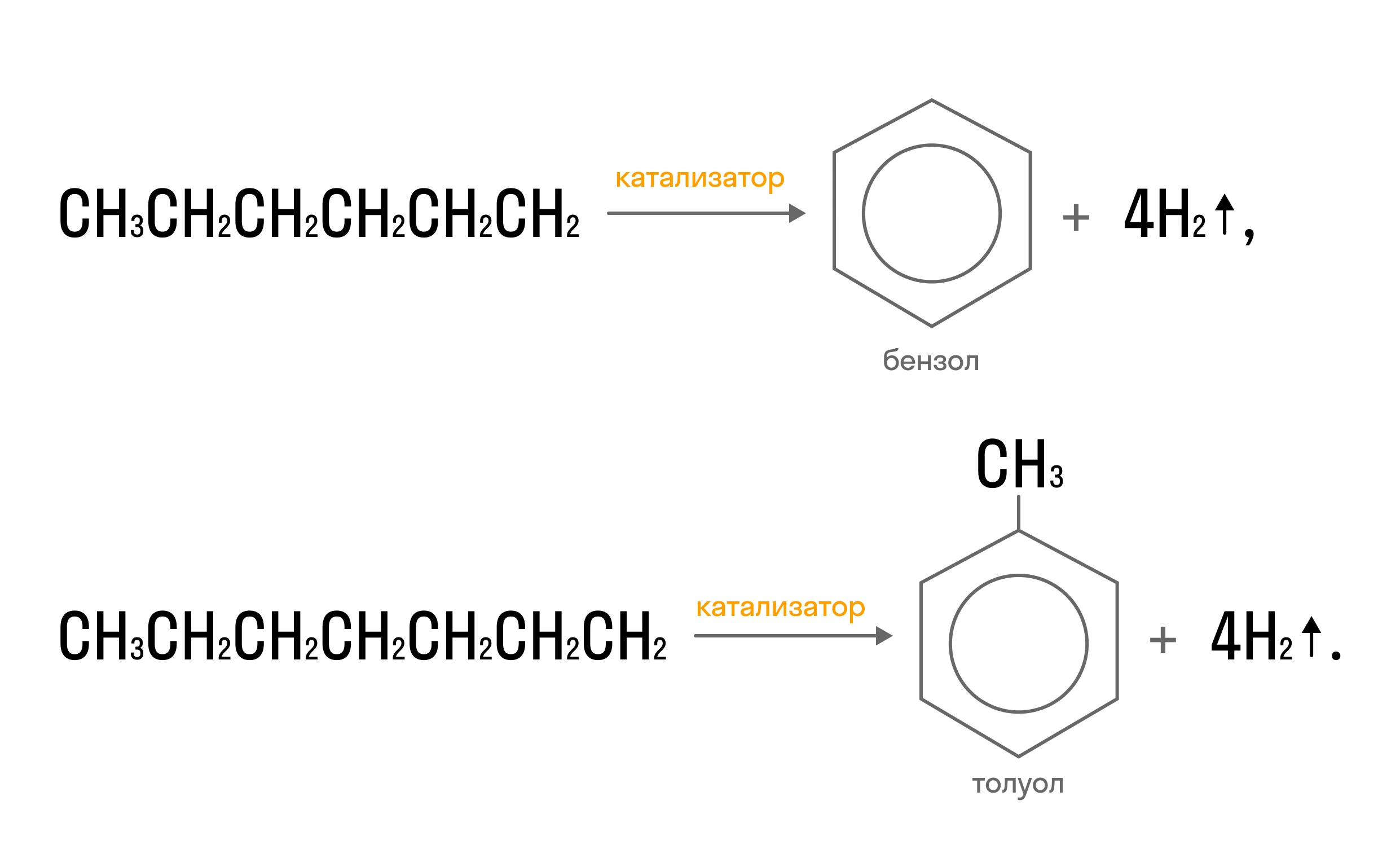
Ароматизация
Алканы, состоящие из 6 и более атомов углерода, способны образовывать ароматические циклы:

Химические свойства циклоалканов
Циклоалканы — углеводороды циклического строения с общей формулой CnH2n.
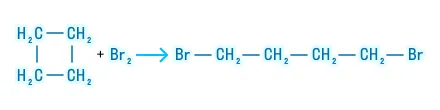
Химические свойства циклоалканов определяются размером цикла. Малые циклы (С3 и С4) проявляют высокую химическую активность, вступая в реакции присоединения, проходящие с разрывом цикла и образованием алканов.
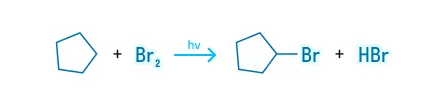
Бромирование
Гидрогалогенирование
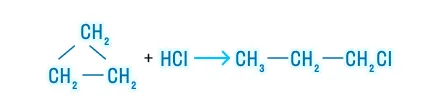
Гидрирование
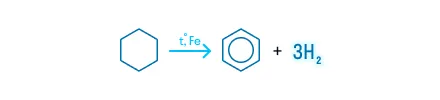
Для молекул средних циклов, начиная с С5, характерны реакции замещения, а не присоединения:
Циклогексан (C6H12) при дегидрировании превращается в бензол:
Для циклоалканов также характерны реакции окисления:
Полное окисление. Циклоалканы сгорают в кислороде с образование углекислого газа и воды:
CnH2n+ 1,5nO2 → nCO2 + nH2O
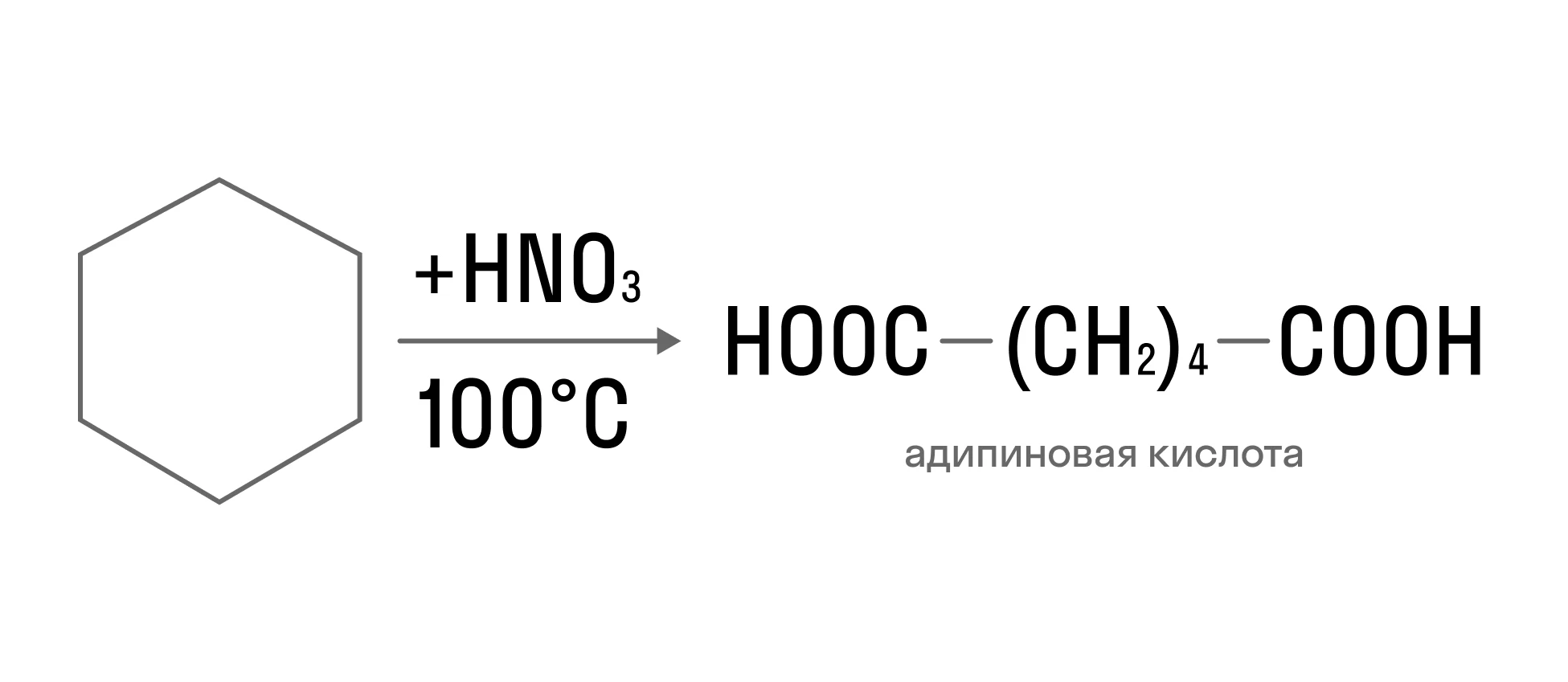
Взаимодействие с сильными окислителями. Реакция всегда сопровождается разрывом цикла, а в результате образуются дикарбоновые кислоты:
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Химические свойства алкенов
Алкены — это непредельные углеводороды состава CnH2n, содержащие одну двойную связь между атомами углерода.
Атомы углерода при кратной связи находятся в sp2 — гибридизации, благодаря чему алкены проявляют большую химическую активность, в сравнении с предельными углеводородами.
Реакции присоединения
Реакции присоединения проходят по правилу Марковникова.
Правило Марковникова
Атом водорода всегда присоединяется к наиболее гидрированному атому углерода при двойной связи.
Гидрогалогенирование
CH3一CH=CH2 + HCl → CH3一CHCl一CH3
Гидратация
Продуктом такой реакции является спирт:
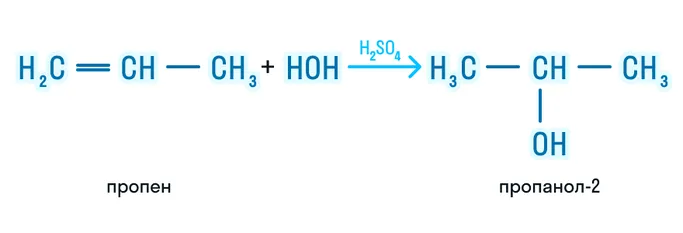
Галогенирование
Алкены взаимодействуют со всеми галогенами. Реакция с бромной водой — это качественная реакция на двойную связь:
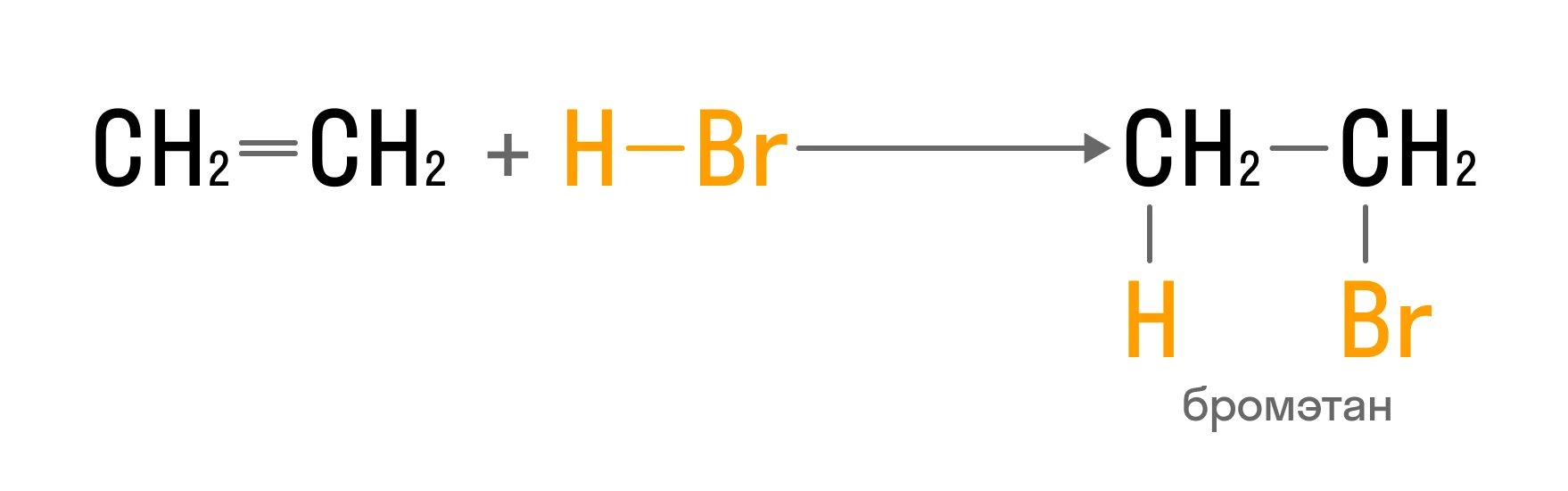
Гидрирование
При присоединении водорода из алкенов получают алканы:
CH3一CH=CH2 + H2 → CH3一CH2一CH3
Для проведения реакции необходим катализатор (никель, платина) и поддержание невысокой температуры.
Полимеризация
Полимеризация — это процесс объединения одинаковых молекул в более крупные.
В ходе реакции происходит разрыв двойной связи:
Окисление
Мягкое окисление (реакция Вагнера)
Мягкое окисление происходит в нейтральной среде. Реакция идет с разрывом двойной связи, а продуктами реакции являются двухатомные спирты:
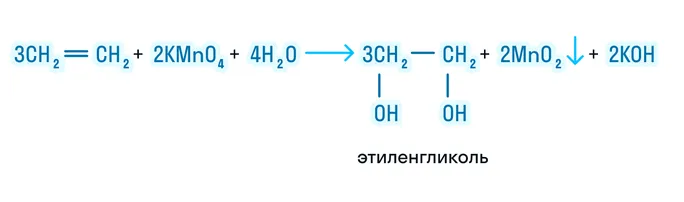
Жёсткое окисление
Реакция проходит в среде серной кислоты. Продукты: карбоновые кислоты, карбонильные соединения и углекислый газ.
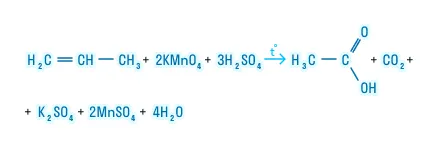
Частичное окисление
Частичное окисление приводит к образованию оксидов алкенов:
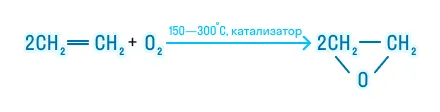
Горение
Взаимодействие с кислородом:
CnH2n+ 1,5nO2 → nCO2 + nH2O
Химические свойства алкадиенов
Алкадиены — это непредельные углеводороды, содержащие две двойные связи в молекуле.
Общая формула CnH2n-2.
В зависимости от расположения двойных связей, в молекуле различают:
- алкадиены с изолированными связями;
- алкадиены с сопряженными связями;
- алкадиены с кумулированными связями.
Химические свойства алкадиенов во многом сходны со свойствами алкенов.
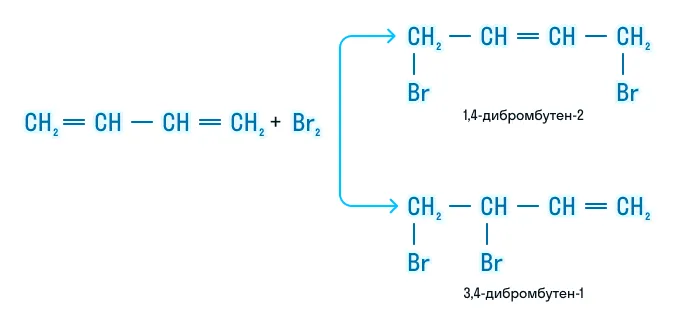
Реакции присоединения
На первой ступени эти реакции могут протекать в двух направлениях:
- в концевые положения (1,4 — присоединение) с образованием двойной связи в центре молекулы;
- к одной из двойных связей (1,2 — присоединение).
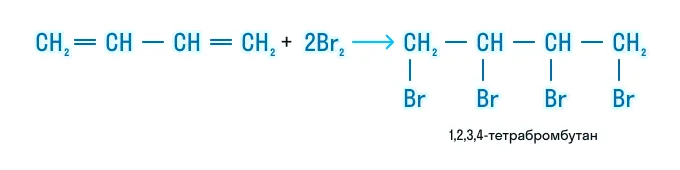
Галогенирование
Если реакция происходит с избытком галогена, образуется тетрагалогенпроизводное:
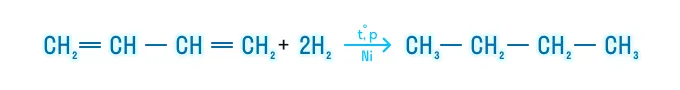
Гидрирование
С избытком водорода образуются алканы:
При взаимодействии с одной молекулой водорода образуется смесь алкенов:
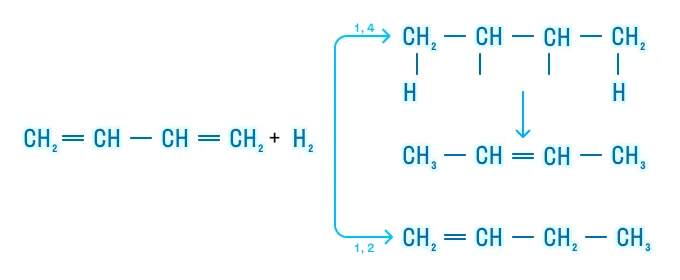
Гидрогалогенирование
Реакция подчиняется правилу Марковникова:
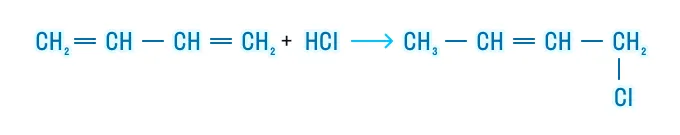
Полимеризация
Полимеризация является важнейшим свойством алкадиенов, так как продуктом такой реакции является каучук, широко применяющийся во многих отраслях:
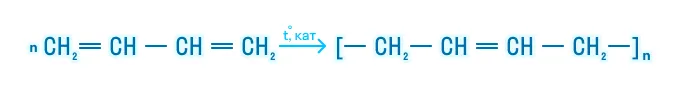
Окисление
Мягкое окисление
Реакция с перманганатом калия в нейтральной среде. Также является качественной реакцией — раствор перманганата обесцвечивается:
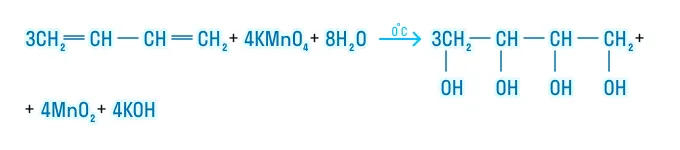
Жёсткое окисление
В кислой среде происходит разрыв двойных связей С=С и связей С一Н у атомов углерода при кратных связях:
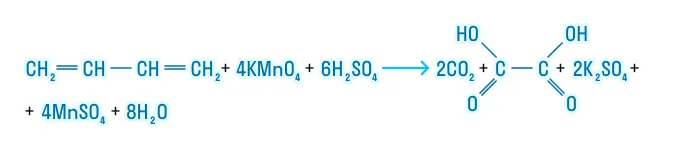
Продукты такой реакции разнообразны. Рассмотрим их в таблице.
Горение
Схема реакции:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O
Химические свойства алкинов
Алкины — это непредельные углеводороды ациклического типа, в молекулах которых содержится одна тройная связь.
Общая формула алкенов CnH2n-2.
Атомы углерода при тройной связи находятся в sp-гибридизации, что оказывает влияние на химические свойства алкинов.
Реакции присоединения
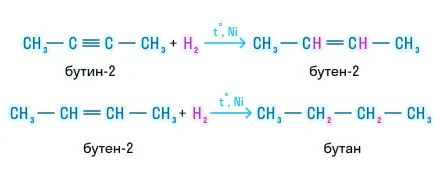
Гидрирование
Реакция проходит в присутствии катализатора. Водород присоединяется последовательно с образованием сначала алкена, а затем — алкана:

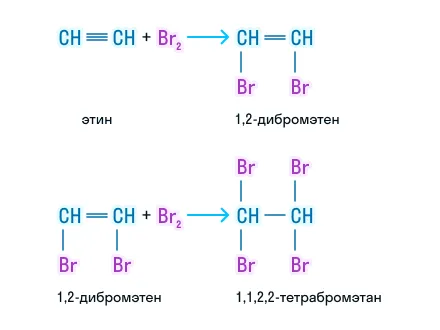
Галогенирование
Как и для алкенов, для алкинов реакция с бромом является качественной. Также проходит последовательно, а конечный продукт — галогенпроизводное алкана:
Гидрогалогенирование
Алкины взаимодействуют с галогеноводородами. Реакция идет в 2 стадии, обе подчиняются правилу Марковникова:
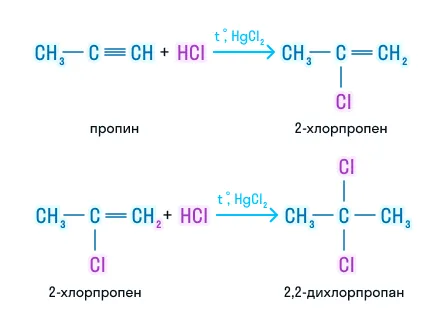
Гидратация (реакция Кучерова)
Реакция идёт в присутствии катализатора — соли Hg2+ — и осуществляется в 2 стадии:
- на первой стадии образуется промежуточный продукт — непредельный спирт — фенол;
- вторая стадия — изомеризация енола в стабильное карбонильное соединение: альдегид, в случае ацетилена и кетоны, в случае его гомологов.
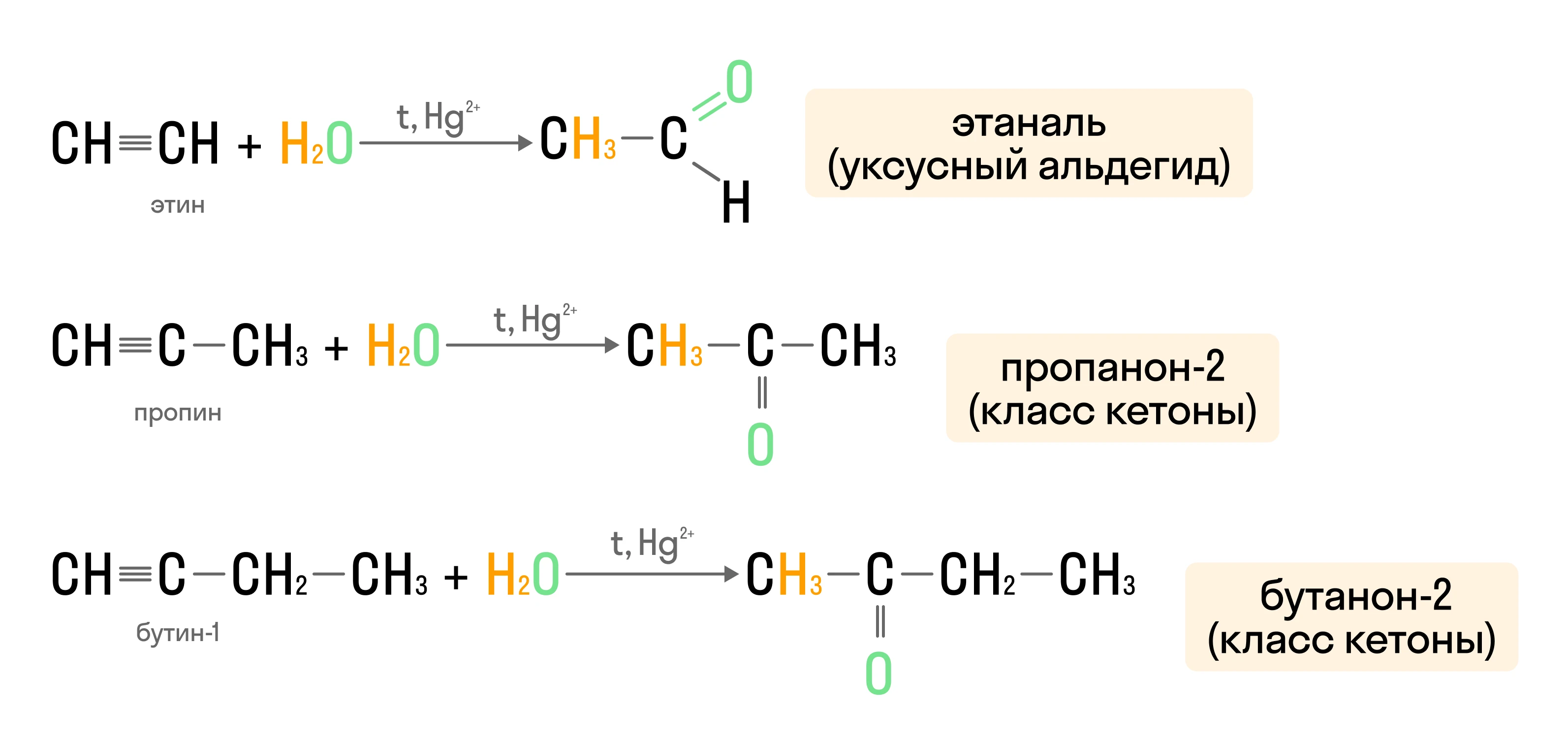
Димеризация
Соединение двух молекул ацетилена под воздействием аммиачного раствора CuCl:
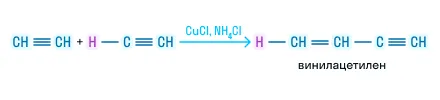
Тримеризация
Соединение трёх молекул ацетилена под действием температуры, давления и использовании активированного угля:
Реакции замещения
Алкины, имеющие тройную связь в концевом положении, проявляют слабокислотные свойства и атом водорода при концевой тройной связи способен замещаться на атом металла.
Образование ацетиленидов
Данные реакции являются качественными для алкинов.
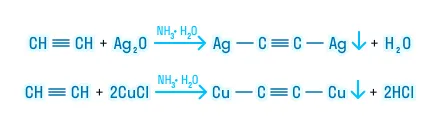
Окисление
Алкины крайне легко подвергаются окислению с образованием кислородсодержащих соединений.
Неполное окисление
Взаимодействие с перманганатом калия в нейтральной или слабощелочной среде — качественная реакция на кратную тройную связь.
3CH ≡ CH + 8KMnO4 → 3KOOC—COOK (оксалат калия) + 8MnO2↓ + 2KOH + 2H2
Взаимодействие с перманганатом калия в кислой среде:
5CH3 –C = C–CH2–CH3 + 6KMnO4 + 9H2SO4→5CH3COOH + 5CH3CH2COOH + 6MnSO4 + 3K2SO4 + 4H2O
Полное окисление (горение)
Горение алкинов проходит по схеме:
CnH2n-2 + (3n-1)/2O2 → nCO2 + (n-1)H2O
Химические свойства аренов
Арены (ароматические углеводороды) — соединения состава CnH2n-6, содержащие одно или несколько бензольных колец.
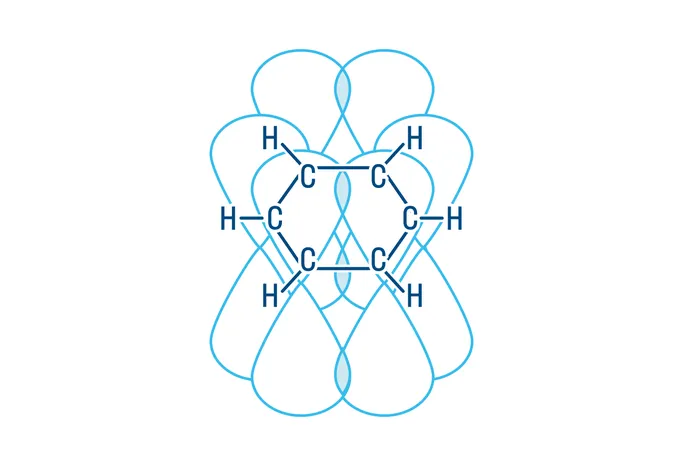
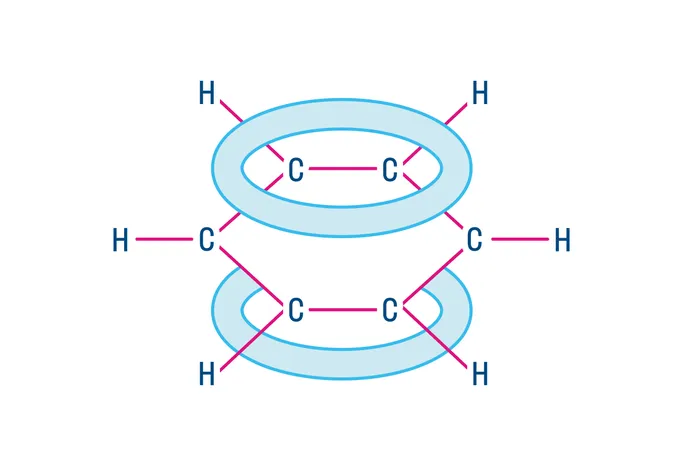
Простейший представитель — бензол C6H6. Строение молекулы бензола определяет его химические свойства и свойства его гомологов.
6 атомов углерода в бензоле находятся в sp2-гибридизации. Каждый из них образует 3 σ-связи, 2 из которых с соседними атомами углерода, и 1 — с водородом. Эта структура расположена в одной плоскости. Каждый атом углерода также имеет одну негибридизованную p-орбиталь, расположенную перпендикулярно углеродному скелету и эти орбитали взаимодействуют друг с другом, образуя единое π-электронное облако.
Из-за этих особенностей строения бензол крайне активен и вступает реакции, которые рассмотрим далее.
Реакции замещения
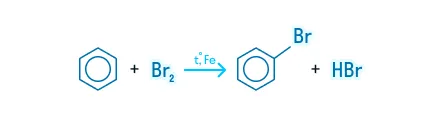
Галогенирование
Бензол и его гомологи вступают во взаимодействие с галогенами в присутствии безводных солей AlCl3, AlBr3, FeCl3.
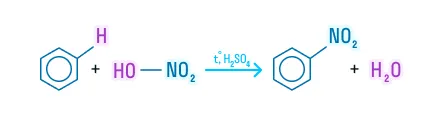
Нитрование
Реакция с азотной кислотой протекает в присутствии кислоты серной. Вмести они образуют нитрующую смесь:
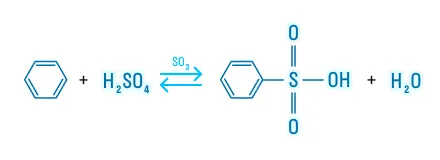
Сульфонирование
Взаимодействие с концентрированной серной кислотой:
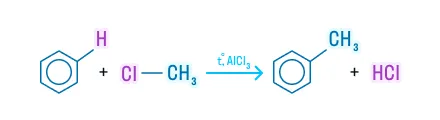
Алкилирование (реакция Фриделя-Крафтса)
В реакцию с бензолом вступают спирты, галогеналканы, алкены:
Реакции присоединения
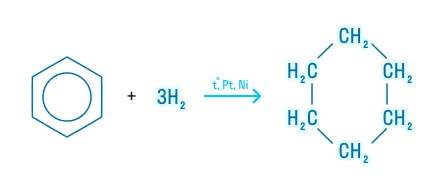
Гидрирование
Реакция гидрирования требует жёстких условий: высокую температуру, наличие катализатора, давление. Продукты реакции — циклоалканы.
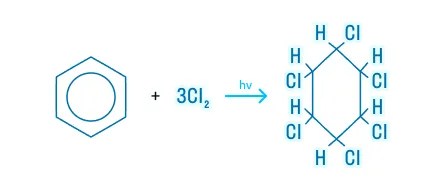
Галогенирование
При повышенной температуре и ультрафиолетовом излучении бензол способен взаимодействовать с избытком хлора:
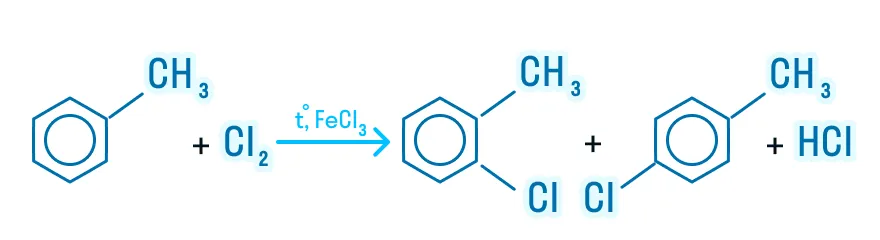
Гомологи бензола также подвергаются галогенированию, но замещение происходит в радикале:
Реакции окисления
Горение
Схема горения бензола и его гомологов:
2CnHn + 5n/2O2 = 2nCO2 + nH2О
Взаимодействие с перманганатом калия в кислой среде
Итак, в зависимости от строения углеводородного скелета, наличия или отсутствия кратных связей, состояний гибридизации атома углерода, углеводороды могут демонстрировать различные химические свойства.
Пора проверить себя
- Выберите все вещества, взаимодействующие с бромной водой:
- Бутан
- Бутин
- Бутадиен-1,3
- Этен
- Выберите реакции, в которые может вступать как метан, так и пропан:
- Окисление раствором дихромата калия
- Изомеризация
- Дегидрирование
- Гидролиз
- Окисление кислородом воздуха