Для кого эта статья:
- Студенты и школьники, изучающие химию
- Учителя и преподаватели химии
- Все, кто интересуется химическими процессами и реакциями
Что такое реакция ионного обмена
Чтобы дать определение понятию «реакция ионного обмена», разберем его на составные части:
обмен — значит, что у нас есть два сложных вещества, которые чем-то обмениваются между собой;
ионный — значит, что эти вещества обмениваются между собой ионами, то есть заряженными частицами.
Теперь соединим все вместе и получим, что реакция ионного обмена — это химическая реакция между двумя сложными веществами, которая приводит к обмену заряженными частицами (ионами), в результате чего образуются новые сложные соединения.
Реакция ионного обмена — это химическая реакция между растворами электролитов, в которой ионы одноимённого заряда меняются местами, обычно с образованием осадка, газа или слабого электролита.
Например, при смешивании растворов NaCl и AgNO₃ образуется осадок AgCl и раствор NaNO₃.
С определением разобрались, теперь нужно понять, есть ли какие-то условия, которые гарантируют нам протекание химической реакции. С этим нам поможет правило Бертолле.
А между какими соединениями протекают реакции ионного обмена? На самом деле все просто: это кислоты, гидроксиды (растворимые и нерастворимые) и соли.

Примеры реакций ионного обмена
Давайте рассмотрим примеры, которые характеризуют каждый из трех признаков протекания химической реакции:
Выпадение осадка:
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl.
Выделение газа:
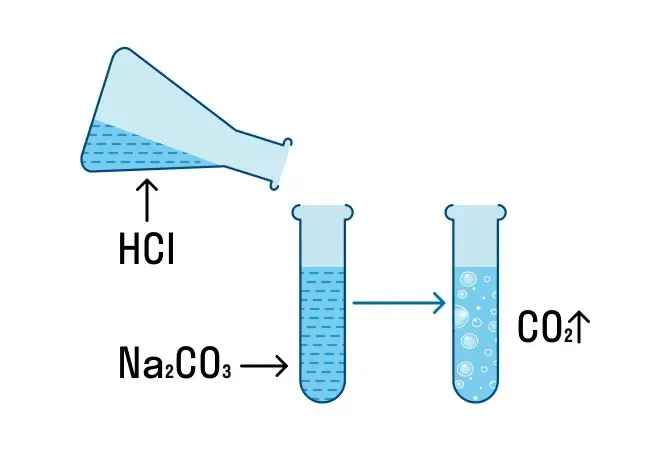
Na2CO3 + 2HCl = H2O + CO2↑ + 2NaCl.
Образование малодиссоциирующего вещества (воды):
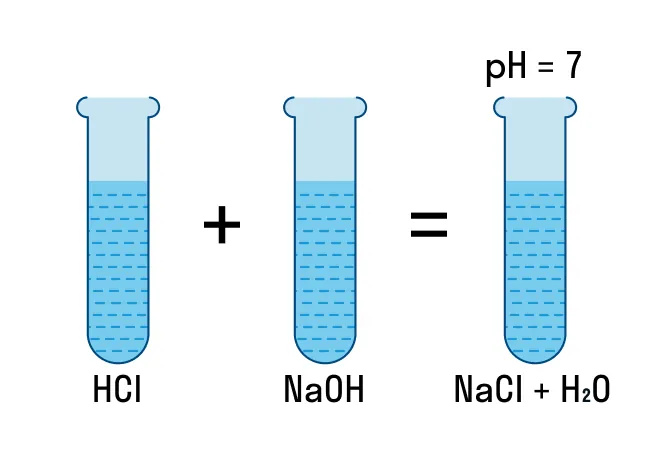
NaOH + HCl = H2O + NaCl.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Составление уравнений обменных реакций
Химические уравнения реакций обмена можно записать:
в молекулярной форме:
2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3.
в полной ионной форме — с указанием всех существующих в растворе ионов:
2Na+ + 2Cl− + Pb2+ + 2NO3− = PbCl2↓ + 2Na+ + 2NO3−.
в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов:
Pb2+ + 2Cl− = PbCl2↓.
Перейдем к правилам записи ионных уравнений:
Записываем уравнение в молекулярном виде и обязательно расставляем коэффициенты.
Далее с помощью таблицы растворимости определяем растворимость каждого химического соединения.
Составляем полное ионное уравнение с учетом коэффициентов и не забываем указывать заряды ионов.
Важно помнить, что мы не расписываем на ионы нерастворимые соединения, воду, оксиды, все слабые электролиты, анионы кислотных остатков кислых солей слабых кислот и катионы основных солей слабых оснований, а также комплексные катионы. Их следует оставить в молекулярной форме.
Находим одинаковые ионы в левой и правой частях полного ионного уравнения и сокращаем их.
Далее переписываем оставшихся участников ионного уравнения и получаем сокращенное ионное уравнение.
Практика
Чтобы узнать, как записывать уравнения окислительно-восстановительных реакций, прочитайте нашу статью «ОВР — это...».
Чтобы новые знания лучше усвоились, немного попрактикуемся. Для проиллюстрированных химических реакций обмена нужно составить молекулярное, полное ионное и сокращенное ионное уравнения:
Решать задачки гораздо интереснее на интерактивной платформе с мгновенной проверкой. А опытный преподаватель тут же поможет разобраться, если ответ получился неправильным или что-то осталось непонятным. Все это ждет учеников на онлайн-курсах по химии в школе Skysmart.
При изучении химических реакций важно учитывать также тепловой эффект, который может проявляться как в поглощении, так и в выделении энергии. Подробнее об этом вы можете узнать в статье про тепловой эффект реакции.