Тепловой эффект реакции — это количество теплоты Q, выделяющееся или поглощающееся при химической реакции, когда количество веществ соответствует стехиометрическим коэффициентам уравнения.
Примеры:
- Экзотермическая реакция горения водорода (выделяется Q)
- Эндотермическая реакция разложения воды (поглощается Q)
Для кого эта статья:
- Студенты и школьники, изучающие химию и термодинамику
- Преподаватели химии и наставники в области изучения химических реакций
- Читатели, интересующиеся основами термохимии и расчетами тепловых эффектов
Тепловой эффект химической реакции определяется разницей энергии в продуктах и исходных веществах. Для точного расчета этих значений важно знать молярную массу всех участвующих соединений, о чем подробнее рассказано в статье «Как найти молярную массу».
Определение теплового эффекта химической реакции
В процессе химической реакции связи в исходных веществах разрываются и образуются новые связи, благодаря чему образуются новые вещества — продукты реакции. Разрыв связи протекает с поглощением энергии, а образование — с выделением, то есть химические реакции сопровождаются энергетическими эффектами.
Как правило, энергия выделяется или поглощается в виде теплоты, поэтому мы говорим, что протекание химической реакции сопровождается тепловым эффектом.
Тепловой эффект химической реакции — это количество теплоты, которое поглощается или выделяется в результате протекания химической реакции.
Если исходные вещества были менее устойчивыми (поглощается небольшое количество энергии), а образуются устойчивые (выделяется большое количество энергии), то в результате химической реакции выделяется тепловой эффект.
И наоборот, образование более устойчивых веществ из менее устойчивых сопровождается поглощением теплоты.
Рассмотрим эти процессы на рисунке:
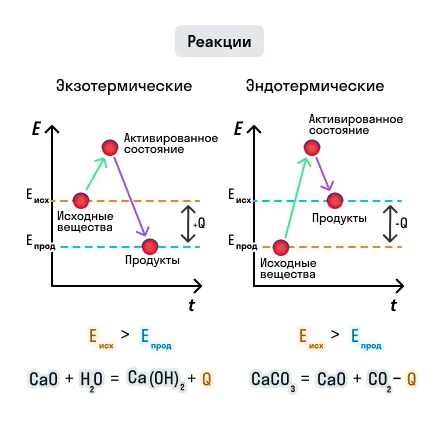
В зависимости от того, выделяется или поглощается теплота, различают два типа химических реакций: экзотермические и эндотермические.

Экзотермические реакции
Экзотермические реакции протекают с выделением теплоты.
В экзотермических реакциях количество выделившейся теплоты указывают со знаком «+».
Например, при сгорании угля:
C(тв) + O2 (г) = CO2 (г) + Q.
Чтобы запустить эту и некоторые другие реакции, нужна инициация, или, проще говоря, пинок. В случае с реакцией горения угля это нагрев (поджигание).
К экзотермическим реакциям относятся реакции горения и реакции соединения.
Реакции горения
Пример — реакция горения метана в атмосфере кислорода:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Реакции соединения
Пример — образование воды из двух простых веществ, при этом выделяется 484 кДж:
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Эндотермические реакции
Эндотермические реакции протекают с поглощением теплоты. Количество поглощенной теплоты указывают со знаком «−».
К эндотермическим реакциям чаще всего относят реакции разложения.
Например, реакции разложения нитрата калия и карбоната кальция:
2KNO3(тв) → 2KNO2(тв) + O2 (г) – Q;
CaCO3(тв) = CaO(тв) + CO2 (г) − 170 кДж.
Термохимические уравнения
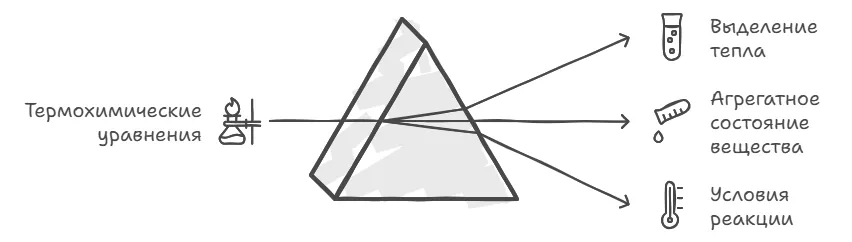
Уравнения реакций, в которых указано количество выделившейся теплоты, называют термохимическими.
В термохимических уравнениях всегда указывают агрегатные состояния веществ, так как от этого зависит значение теплового эффекта.
Рассмотрим термохимическое уравнение сгорания газа метана:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.
Глядя на уравнение, можно сделать вывод, что при сгорании 1 моля газообразного метана в 2 молях газообразного кислорода выделяется 802 кДж теплоты сгорания.
Теплота сгорания — это количество теплоты, выделяющееся при горении 1 моля вещества.
Если в реакцию вступит в 5 раз больше метана, чем в представленном термохимическом уравнении, то есть не 1 моль метана, а 5, то тепловой эффект будет пропорционально больше, то есть не 802 кДж, а 802 ⨯ 5 = 4 010 кДж.
Практика
Рассмотрим несколько термохимических расчетов для типовых заданий.
Задача 1
Рассчитайте количество теплоты, выделившейся в результате реакции образования метана, термохимическое уравнение которой —
C(тв) + 2H2 (г) = CH4 (г) + 76 кДж,
из: а) 0,3 моля углерода; б) 2,4 г углерода; в) 2,24 л водорода.
Решение.
Важно помнить, что количество теплоты, которая выделяется в результате реакции, пропорционально количеству вещества, вступившего в реакцию.
а) Из термохимического уравнения видно, что при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,3 моля С выделяется x кДж.
Составим уравнение и решим его:
1 моль × х = 76 кДж × 0,3 моля;
б) Для начала найдем количество вещества прореагировавшего углерода. Для этого разделим его массу m на молярную массу M:
Молярная масса углерода равна 12 г/моль (значение из таблицы Менделеева).
Тогда
В соответствии с термохимическим уравнением при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,2 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,2 моля;
в) Для начала найдем количество вещества вступившего в реакцию водорода. Для этого разделим его объем V на молярный объем Vm:
Молярный объем любого вещества равен 22,4 л/моль.
Тогда
В соответствии с термохимическим уравнением при взаимодействии 2 молей H выделяется 76 кДж, тогда при взаимодействии 0,1 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,1 моля;
Задача 2
В результате реакции, термохимическое уравнение которой —
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж,
выделилось 1 360 кДж. Вычислите: а) объем (н. у.) вступившего в реакцию кислорода; б) массу образовавшейся воды.
Решение.
а) В соответствии с термохимическим уравнением при взаимодействии 1 моля кислорода выделяется 484 кДж, тогда при взаимодействии х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
1 моль × 1 360 кДж = 484 кДж × х молей;
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
V = n(H) × Vm, где Vm — молярный объем;
V(H) = 2,81 моля × 22,4 л/моль = 62,95 л.
б) В соответствии с термохимическим уравнением при взаимодействии 2 молей воды выделяется 484 кДж, тогда при взаимодействии х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
2 моля × 1 360 кДж = 484 кДж × х молей;
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
m(H2O) = n(H2O) × M(H2O), где M — молярная масса;
M(H2O) = 1 × 2 + 16 × 1 = 18 г/моль;
m(H2O) = 5,62 моля × 18 г/моль = 101,16 г.
Еще больше задач, да еще и в интерактивном формате — на онлайн-курсах по химии в школе Skysmart.
Вопросы для самопроверки
Что такое тепловой эффект?
На какие типы делятся реакции по тепловому эффекту?
Приведите примеры реакций, которые протекают с выделением теплоты.
Какие уравнения называют термохимическими?
Рассчитайте количество теплоты, которая выделится при сгорании 0,7 моля метана. Термохимическое уравнение реакции:
CH4 (г) + 2O2 (г) = CO2 (г) + 2H2O (г) + 802 кДж.