Коррозия металлов - это самопроизвольное разрушение металлических конструкций вследствие их химического или электрохимического взаимодействия с окружающей средой.
-
Примеры:
- ржавчина на стали
- зеленый налет на меди
Процесс происходит на границе фаз "металл - окружающая среда".
Для кого эта статья:
- Специалисты в области материаловедения
- Инженеры и работники производственных отраслей
- Студенты и исследователи, изучающие физику и химию материалов
Коротко о главном
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.

Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
Таблица 1. Сравнение химической и электрохимической коррозии металлов |
||
|---|---|---|
Признаки сравнения |
Химическая коррозия |
Электрохимическая коррозия |
Определение |
Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток |
Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита |
Агрессивные реагенты |
O2, пары H2O, CO2, SO2, Cl2 |
Растворы электролитов |
Примеры |
3Fe + 2O2 → Fe3O4 |
4Fe + 3O2 + 6H2O = 4 Fe(OH)3 При контакте железа с цинком коррозии подвергается цинк: А (+) на цинке: Zn0 - 2e- = Zn2+. К (–) на железе: 2H+ + 2e- = H2. |
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Что такое коррозия
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3.
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
3Fe + 2О2 = Fe3O4;
Fe + H2SO4 = FeSО4 + Н2.
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Виды коррозии металлов
Виды коррозии — это различные формы разрушения материалов под воздействием окружающей среды. Основные виды коррозии включают:
- Электрохимическая коррозия
- Водородная коррозия
- Кислородная коррозия
- Химическая коррозия
- Сплошная (общая) коррозия
- Местная точечная коррозия
- Местная щелевая коррозия
- Коррозионное растрескивание под напряжением
- Сульфидная коррозия под напряжением
- Водородное охрупчивание
- Межкристаллитная коррозия
- Контактная коррозия
Примеры: Кислородная коррозия происходит в присутствии воды и кислорода. Электрохимическая коррозия часто встречается на металлических конструкциях, погружённых в электролиты.
Химическая коррозия
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
Гомогенный механизм электрохимической коррозии |
Гетерогенный механизм электрохимической коррозии |
|---|---|
Поверхность металла рассматривается как однородный слой. |
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке. |
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов. |
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений. |
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса. |
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
Fe → Fe2+ + 2e.
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
O2 + 2H2O + 4e → 4OH-
2H+ + 2e → H2
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Чтобы получать высокие оценки по химии, важно понимать не только процессы, происходящие при коррозии, но и принципы различных типов химических связей, таких как ковалентная неполярная связь.
Как защитить металлы от коррозии
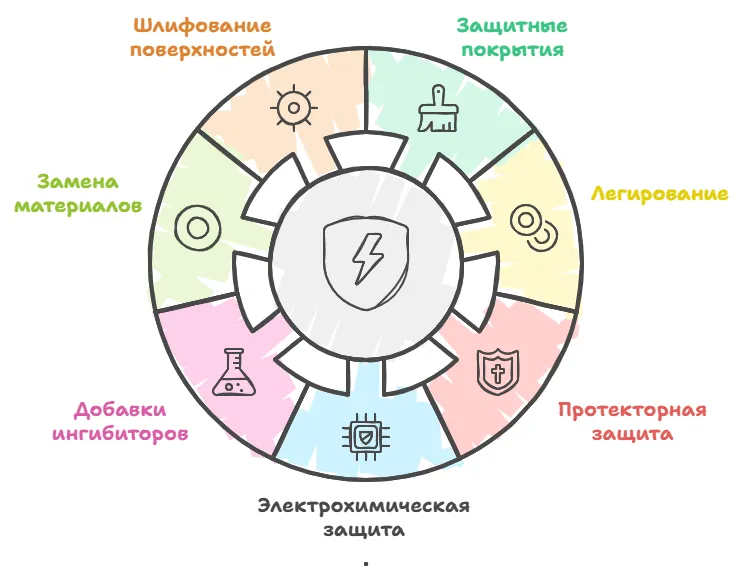
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
Способ № 1. Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Одним из важных факторов, влияющих на скорость коррозии, является pH среды. Водородный показатель pH может значительно ускорить или замедлить коррозионные процессы, что важно учитывать при выборе материалов для эксплуатации в различных средах.
Проверьте себя
Что такое коррозия?
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
Гидроксид железа Fe(OH)3 называют:
а ржавчина;
б) окалина;
в) патина.
Что является причиной возникновения коррозии?
Чем отличаются химический и электрохимический типы коррозии?
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!