Для кого эта статья:
- студенты и школьники, изучающие химию
- учителя и преподаватели химии
- люди, интересующиеся научной литературой и историей науки
Предпосылки открытия периодического закона
Периодический закон — это ключ к пониманию большинства процессов в химии. Открыв его в 1869 году, Дмитрий Иванович Менделеев совершил революцию в науке, связав свойства химических элементов с их атомными номерами. До этого момента химия была скорее искусством, чем наукой. Элементы открывались случайно, а свойства их оставались загадкой.

Так, в 1829 году, немецкий химик Дёберейнер предложил разделить известные на тот момент 63 химических элемента на триады, то есть группы по три элемента, близких по свойствам. Масса среднего элемента в триаде должна была быть равна среднему арифметическому числу масс двух других элементов. Осуществить задуманное не вышло, так как учёный сократил поиск схожих элементов до трёх в группе.
Далее были попытки А. Э. Шанкуртуа, Дж. А. Ньюлендса, Ю. Л. Мейера и других учёных — всего более 50 вариантов реализации систематизации элементов, однако ни один из них не увенчался успехом. При этом некоторого прогресса всё же достичь удалось:
- Были выявлены атомные массы химических элементов, которые оказались близки к современным.
- Определены похожие между собой по свойствам элементы.
- Усовершенствовано учение о валентности.
- Установлено сходство кристаллических форм некоторых элементов.
Почему же классифицировать химические элементы было так непросто? Ответ кроется в особенностях самих элементов, строении их атомов и свойствах.
Химический элемент и его свойства
Как мы знаем, атом — мельчайшая частица химического элемента, являющаяся источником его уникальных свойств. Химический элемент — это определённый вид атомов с одинаковым зарядом ядра. Другими словами, это своеобразный комплекс атомов, которые имеют одинаковое количество структурных единиц — электронов, протонов и нейтронов.
Каждый элемент уникален, но при этом многие элементы можно объединить в группы по ряду признаков.
Свойства элементов делят на несколько категорий: металлические или неметаллические; окислительные или восстановительные; свойства, зависящие от радиуса атома, от электроотрицательности, валентности, степени окисления и энергии ионизации.
Благодаря этим параметрам химические элементы значительно отличаются от простых веществ. К примеру, когда мы говорим, что в организме человека содержится железо, то имеем в виду не кусок металла, а химический элемент, содержание которого определяется крайне малыми дозами. Также химические элементы образуют аллотропные модификации (несколько простых веществ, образованных одним элементом) или способны переходить в ионную форму. Кроме того, элементы имеют изотопы.
Изотопы
Изотопы — это модификации атомов химических элементов, содержащих одно и то же количество электронов и протонов, но различающихся числом нейтронов, а следовательно, и имеющих разную атомную массу.
Примечательно, что при практически идентичном составе, изотопы одного и того же химического элемента всё же различаются по своим свойствам. Существуют изотопы, которые не излучают радиацию и остаются стабильными на протяжении долгого времени, и изотопы, которые нестабильны и испускают радиацию — радиоизотопы.
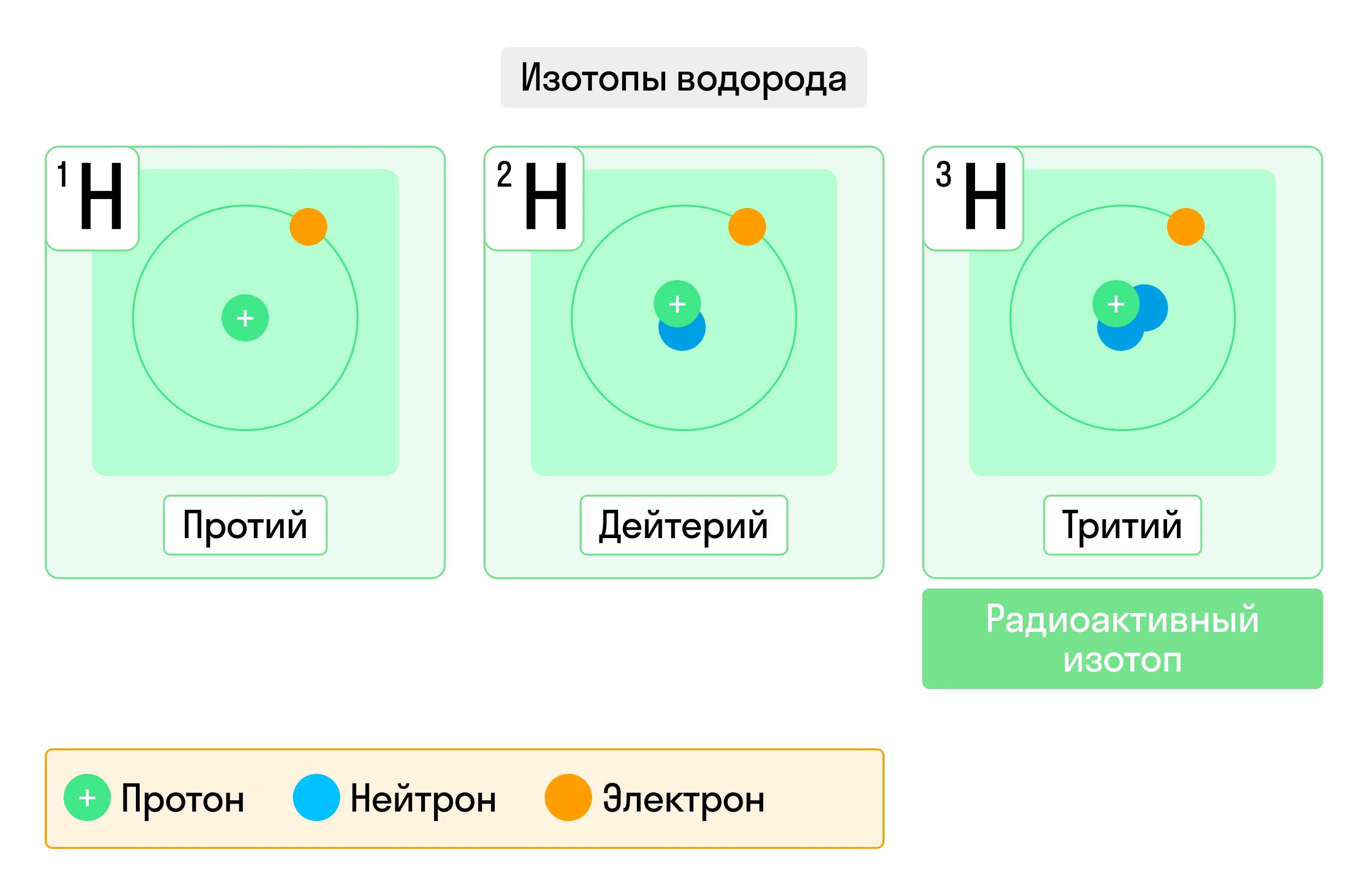
Наиболее известны изотопы водорода H: водород, дейтерий и тритий. Каждый из них имеет один электрон и один протон, но при этом число нейтронов различается:
- У водорода нейтронов нет вообще, и масса его атома равна 1.
- У дейтерия один нейтрон, значит масса атома равна 2.
- Тритий обладает двумя нейтронами и, соответственно, массовым числом, равным 3, и является радиоизотопом.
Изотопы есть и у других химических элементов. Уран U, например, считается достаточно редким элементом, но его изотопы можно встретить в горных породах, почве, воде и даже в человеческом организме.
Изотопы одного и того же химического элемента занимают одно место в ячейке Периодической системы, а атомная масса каждого элемента рассчитывается как средняя величина для всех изотопов с учетом частоты их встречаемости. Именно поэтому атомная масса имеет дробное значение.
Именно с атомной массой связывал изменение свойств химических элементов Д. И. Менделеев. Изначально периодический закон звучал так:
«Свойства элементов, формы и свойства образуемых ими соединений находятся в периодической зависимости от величины их атомной массы».
Однако дальнейшие исследования показали, что свойства атомов зависят в первую очередь от электронного строения, определенного параметрами ядра.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по химии
-
Выбирай из 550+ репетиторов по химии
Записывайся на бесплатные курсы для детей
Периодическая система
Итак, современная формулировка периодического закона гласит:
Свойства элементов, а также структура и свойства их соединений находятся в периодической зависимости от величины заряда ядер их атомов.
Таким образом возможно изменение свойств химических элементов в определённых сочетаниях и повторение их через определенное число элементов.
Наглядно периодический закон отражает Периодическая система химических элементов Менделеева (ПСХЭ), которая разделена на группы и периоды.
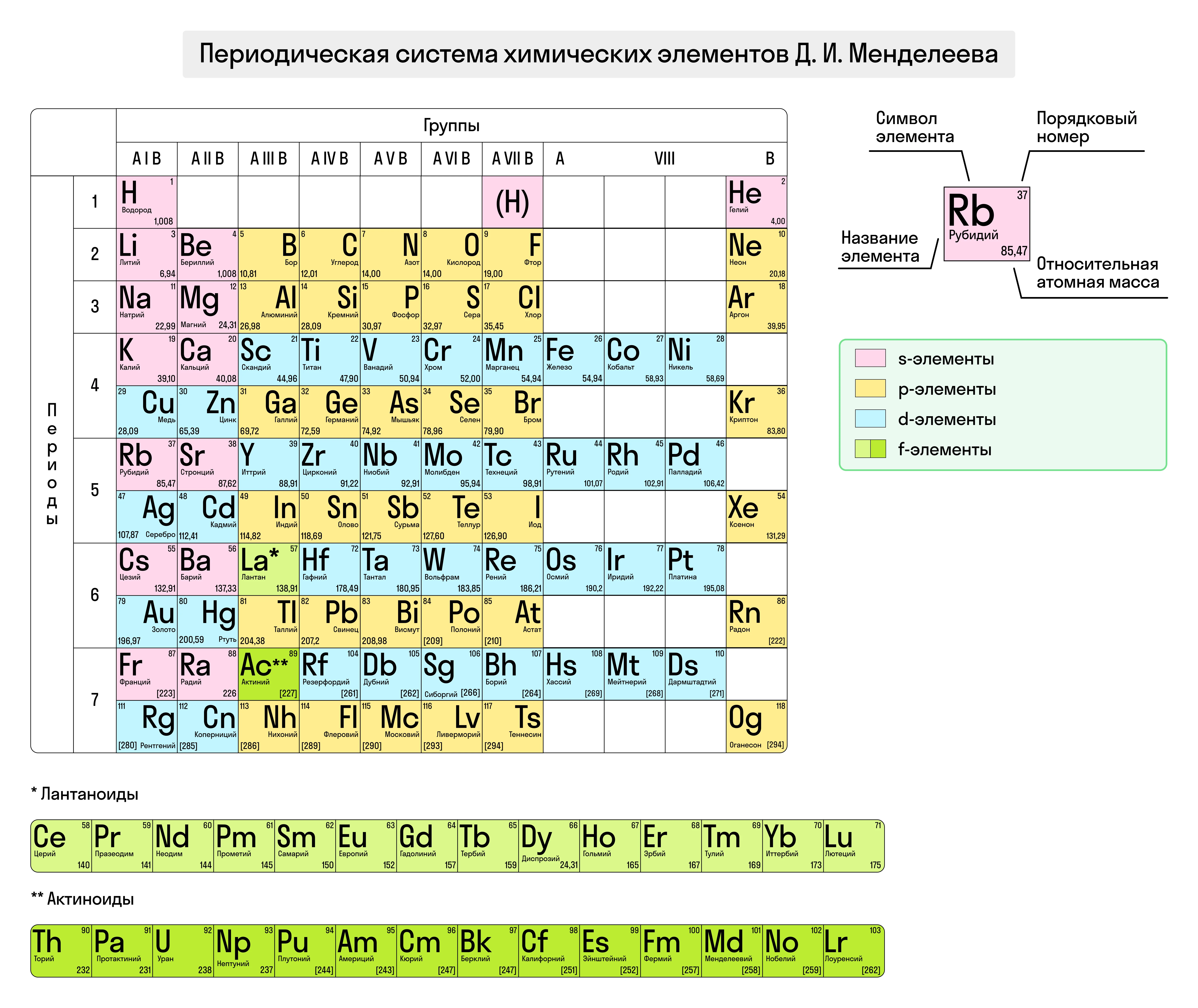
Группа — это вертикальный столбец элементов, имеющих одинаковое число валентных электронов (т. е. электронов на внешнем энергетическом уровне), равное номеру группы. Всего в ПСХЭ восемь групп, каждая из которых разделена на главную и побочную.
Период — это горизонтальный ряд элементов с одним и тем же количеством электронных слоёв, число которых определяется номером периода. В ПСХЭ содержится семь периодов. Периоды с 1 по 3 считаются малыми, а с 4 по 7 — большими.
Каждый элемент занимает свою собственную ячейку в ПСХЭ. В ячейке, помимо названия и химического знака, указан порядковый номер элемента и его атомная масса.
Изменения свойств химических элементов обусловлены их положением в ПСХЭ, а, следовательно, периодическими изменениями количества электронов на внешних электронных оболочках атома.
Закономерности изменения химических свойств элементов
Каким образом меняются свойства элементов? Для ответа на этот вопрос нам стоит более подробно рассмотреть, как расположены элементы в группах и периодах.
Все элементы расположены в ПСХЭ последовательно, по мере возрастания порядкового номера, а значит, и заряда ядра атома.
Каждый период, за исключением первого, начинается щелочным металлом (литий Li, натрий Na, калий K и т. д.), а заканчивается благородным газом (неон Ne, аргон Ar, криптон Kr и т. д.). Если элементы расположены в одном периоде, значит, у них одинаковое количество энергетических уровней. Начало каждого периода соответствует началу заполнения нового электронного слоя в атоме.
Каждая главная группа включает в себя элементы, схожие по своим свойствам, так как у них одно и то же количество внешних электронов. Элементы побочных подгрупп содержат валентные электроны на внешнем и предвнешнем электронных слоях. Если провести в ПСХЭ воображаемую диагональ от бора B до астата At, то элементы под диагональю (и элементы всех побочных подгрупп) — металлы, а над диагональю — неметаллы.
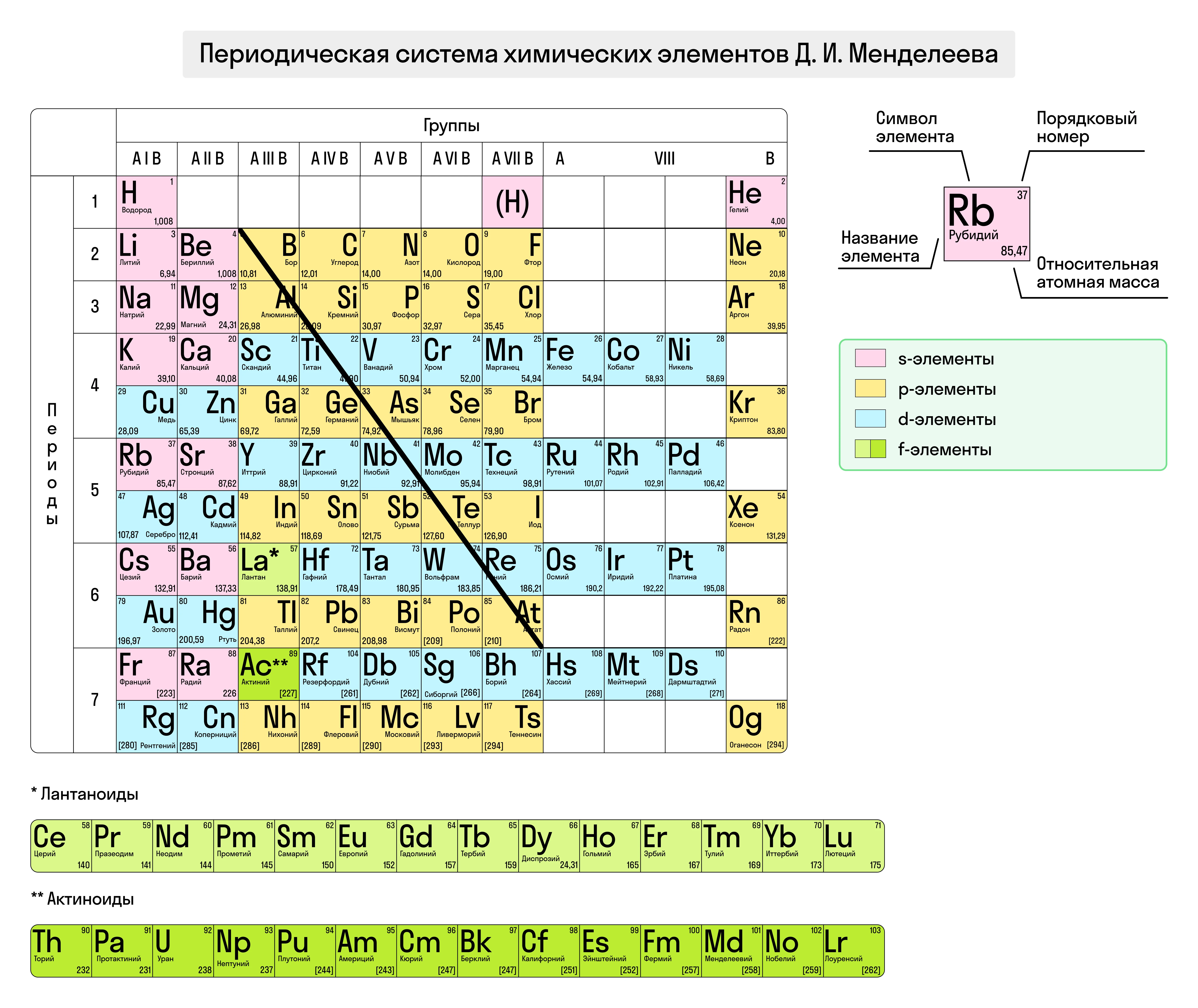
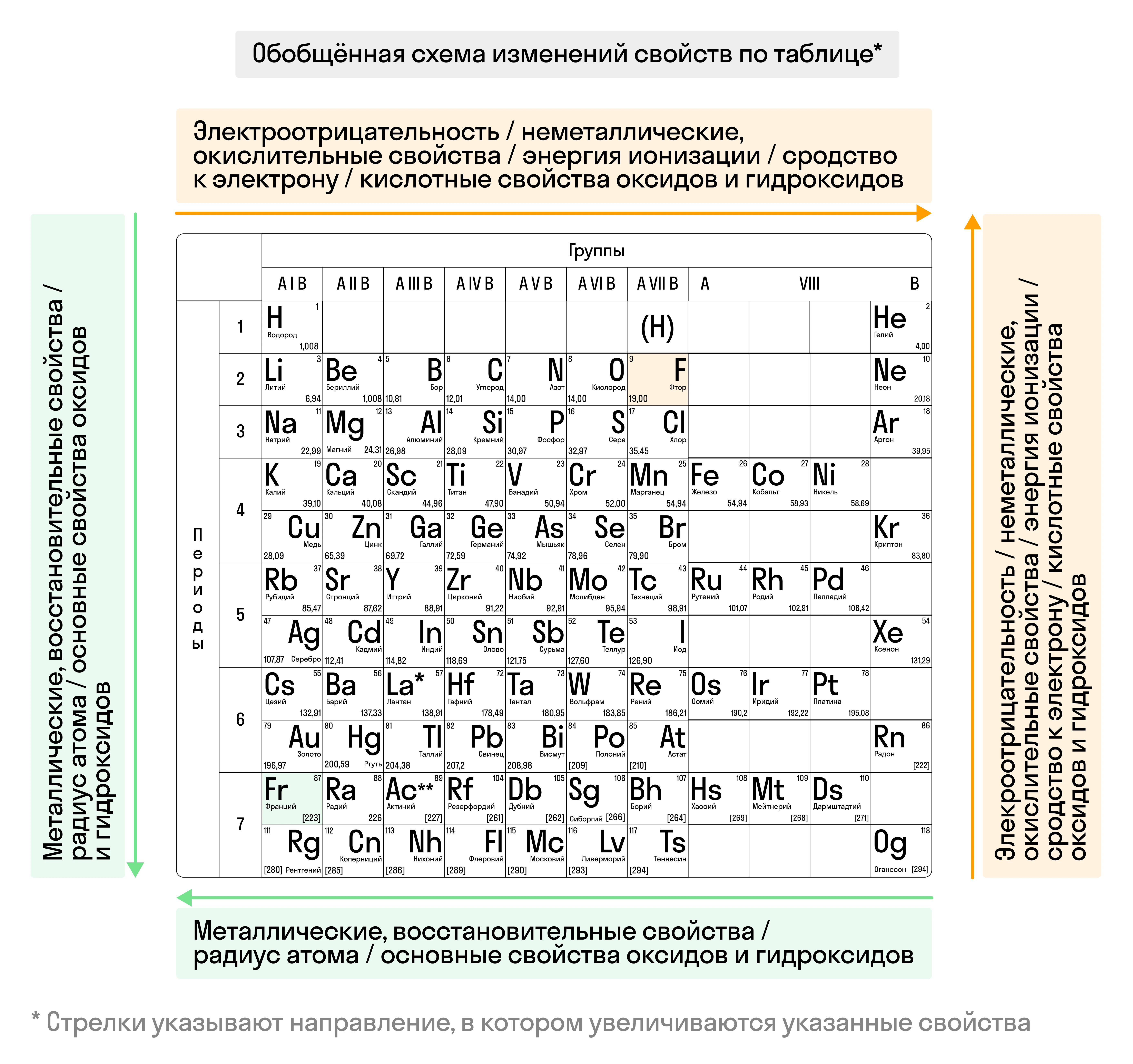
Итак, с увеличением заряда ядра атома меняется строение энергетических уровней, что приводит к периодическим изменениям свойств химических элементов:
- Радиус атома увеличивается в группах сверху вниз, а в периодах — слева направо. Чем больше атомный радиус, тем более выраженно элемент проявляет неметаллические свойства.
- Электроотрицательность увеличивается в группах снизу вверх, в периодах — слева направо. Самый электроотрицательный элемент — фтор F.
- Металлические свойства усиливаются в группах сверху вниз, в периодах — справа налево.
- Энергия ионизации, свойственная для элементов-металлов, возрастает в периодах слева направо, в группах — снизу вверх.
- Неметаллические свойства усиливаются в группах снизу вверх, в периодах — слева направо.
Все химические элементы способны образовывать различные соединения, изменения свойств которых также подчиняются периодическому закону.
Закономерности изменения свойств простых веществ и соединений элементов
Нам уже известно, что химические элементы могут проявлять металлические или неметаллические свойства. Понятия «металл» и «неметалл» относятся и к простым веществам, элементами образованными.
В чём разница между химическим элементом и простым веществом? Простое вещество — это форма существования элемента, которая характеризуется различными физическими свойствами: температурой плавления и кипения, агрегатным состоянием, цветом, запахом и так далее. Важно, что простые вещества состоят из атомов только одного химического элемента. Помимо прочего, для простых веществ характерны окислительные или восстановительные свойства.
Изменение свойств простых веществ согласно периодическому закону
|
Свойства простых веществ |
Изменение свойств |
|---|---|
|
Металлические |
Усиливаются в периоде справа налево, в группе — сверху вниз |
|
Неметаллические |
Усиливаются в периоде слева направо, в группе — снизу вверх |
|
Восстановительные |
Ослабевают в периоде слева направо, в группе — снизу вверх |
|
Окислительные |
Усиливаются в периоде слева направо, в группе — снизу вверх |
Химические элементы могут образовывать и сложные вещества, состоящие из атомов нескольких разных элементов. Свойства же кислородных соединений, таких как оксиды и гидроксиды, зависят от положения образующих их элементов в ПСХЭ. Для них характерны свойства основные и кислотные.
В главных подгруппах происходит усиление основных свойств и, соответственно, ослабление кислотных. В периодах же всё происходит наоборот: основные свойства ослабевают, кислотные — усиливаются. Таким образом мы получаем следующие схемы градиента свойств:
основный оксид → амфотерный оксид → кислотный оксид;
щёлочь → нерастворимое основание → амфотерный гидроксид → кислота.
Элементы-неметаллы образуют летучие водородные соединения (NH3, CH4, H2S), кислотные свойства которых усиливаются в периоде слева направо, в группе — сверху вниз.
Мы рассмотрели основные закономерности изменений свойств химических элементов и их простых и сложных веществ согласно периодическому закону. Осталось выяснить, как применять всю эту информацию на практике.
Решение задач
Задание 1
Из указанных в ряду химических элементов выберите три, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одном периоде. Расположите выбранные химические элементы в порядке возрастания их металлических свойств.
1) Mg 2) Sr 3) Si 4) Ba 5) Cl
Решение:
Для начала определим элементы, стоящие в одном периоде. Для этого воспользуемся ПСХЭ: Mg — 3 период, Sr — 5 период, Si — 3 период, Ba — 6 период, Cl — 3 период.
Магний, кремний и хлор — элементы третьего периода.
Осталось вспомнить, как изменяются металлические свойства в периоде: они возрастают справа налево. Необходимо расставить наши элементы следующим образом: Cl → Si → Mg.
Ответ: 531
Задание 2
Из указанных в ряду химических элементов выберите три, которые в Периодической системе химических элементов Д. И. Менделеева находятся в одной группе. Расположите их в порядке уменьшения кислотных свойств летучих водородных соединений, которые соответствуют этим элементам.
1) S 2) Na 3) Te 4) Se 5) Al
Решение:
Определим группы, в которых находятся элементы: S — VIA, Na — IA, Te — VIA, Se — VIA, Al — IIIA. Сера, теллур и селен — элементы VIA группы. Кислотные свойства летучих водородных соединений неметаллов усиливают в группе сверху вниз, соответственно: S → Se → Te.
Ответ: 143
Периодический закон —надёжный инструмент для прогнозирования и понимания свойств химических элементов и их соединений. Для того, чтобы с легкостью решать экзаменационные задания, нужно запомнить все закономерности изменения химических свойств элементов.
Пора проверить себя
Задание 1
Из указанных в ряду химических элементов выберите три, которые в ПСХЭ находятся в одном периоде. Расположите эти элементы в порядке усиления основных свойств их оксидов.
1) P 2) Na 3) Li 4) Ca 5) Al
Ответ
152Задание 2
Из указанных в ряду химических элементов выберите три, которые в ПСХЭ находятся в одной группе. Расположите эти элементы в порядке уменьшения электроотрицательности.
1) S 2) N 3) Br 4) P 5) As