Для кого эта статья:
- Студенты и школьники, изучающие химию
- Преподаватели или наставники, обучающие основные концепции химии
- Любители науки, интересующиеся химическими связями и их свойствами
Что такое ковалентная связь
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов. В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной. |

Ковалентная неполярная связь
Ковалентная неполярная связь – это связь, возникающая в результате образования общих электронных пар между атомами одного и того же элемента неметалла.
Например:
- Молекулы водорода (H₂)
- Кислорода (O₂)
- Азота (N₂)
Образованы ковалентными неполярными связями.
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
Понимание ковалентных неполярных и полярных связей лежит в основе изучения химической валентности, которая определяет количество химических связей, которые атом может образовать. На примере валентности можно увидеть, как эти принципы применяются на практике и помогают объяснить структуру молекул. Более подробно о том, что такое валентность и как её определить, можно узнать здесь.
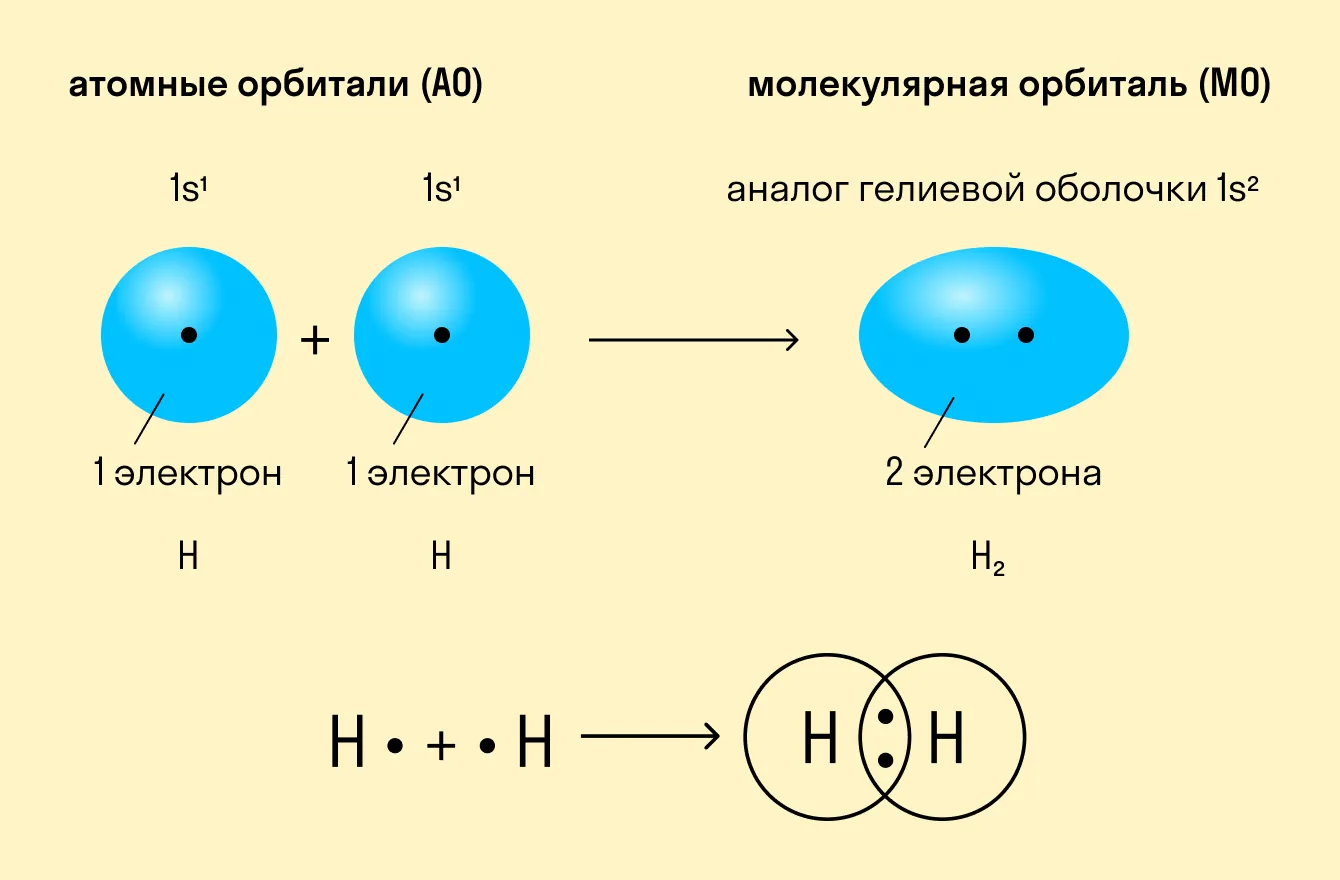
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно. Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО. |
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:

Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Ковалентная полярная связь
Ковалентная полярная связь - это химическая связь между атомами с различной электроотрицательностью, где общая электронная пара смещена к более электроотрицательному атому. Примеры:
- HCl
- H2O
- NH3
- HF
- CO
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
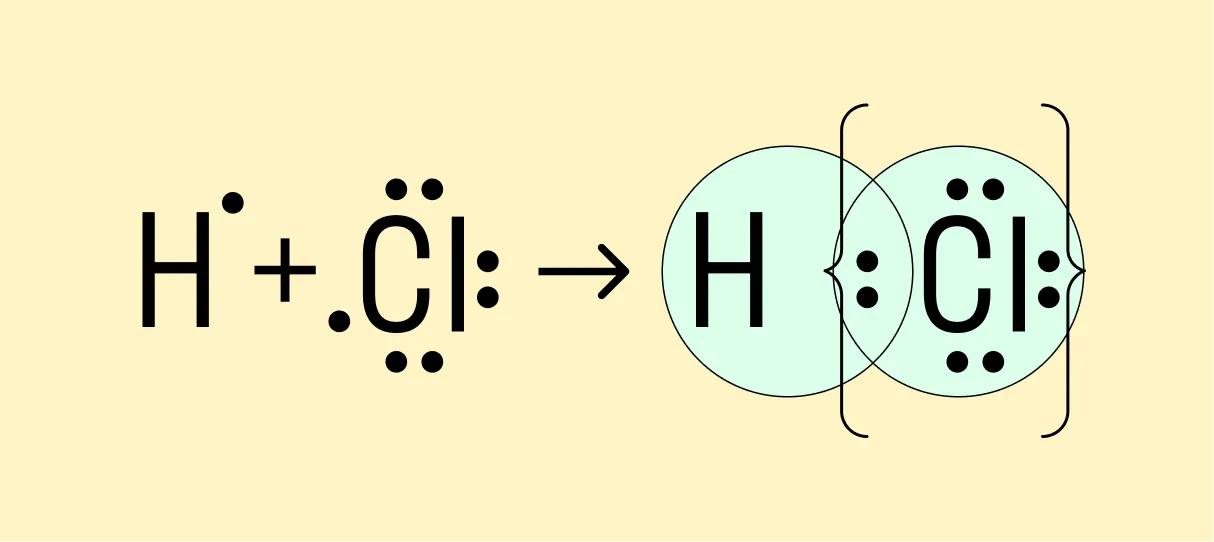
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно. Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ. |
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
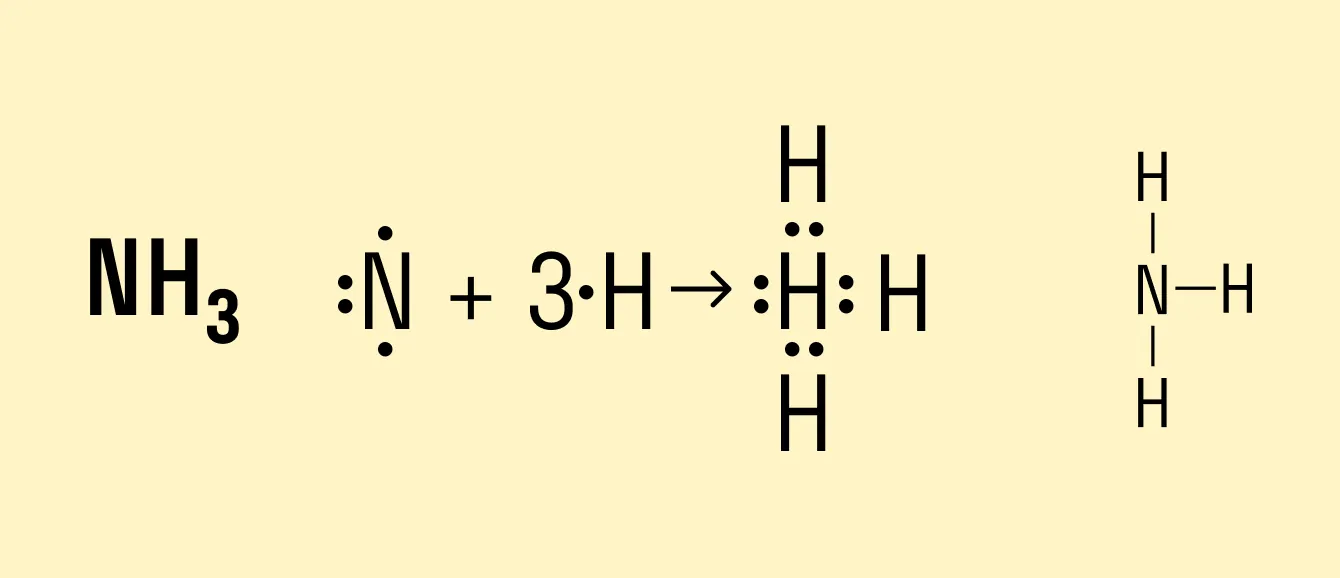
Механизмы образования ковалентной связи
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4+ в форме тетраэдра, где углы представлены четырьмя атомами водорода.
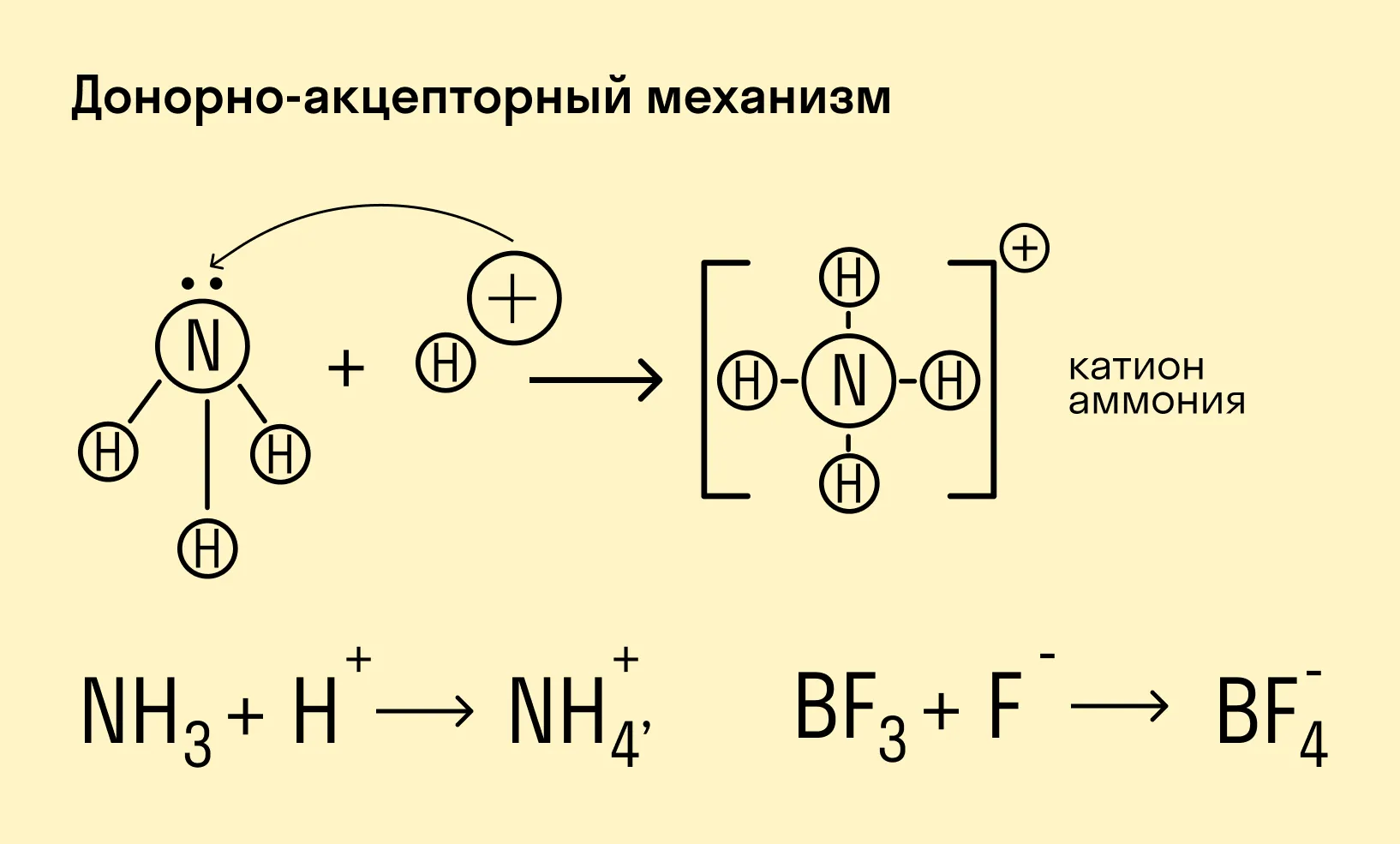
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
NH4+Cl, NH4+Br;
NO3-;
KNO3, LiNO3;
O3;
H3O+;
CO;
K(Al(OH)4), Na2(Zn(OH)4).
Кратность ковалентной связи
Ковалентная связь может подразумевать образование как одной пары электронов, так и двух или даже трех. Исходя из того, сколько именно получилось пар, выделяют одинарные, двойные и тройные связи. В формулах они обозначаются соответствующим количество черточек.
Кратность ковалентной связи — это количество созданных общих электронных пар у двух атомов. |
Например, в молекуле хлора Cl2 каждый атом содержит по одному валентному электрону на внешней p-орбитали. При сближении атомов происходит перекрывание орбиталей и свободные электроны соединяются в одну общую пару. Это одинарная ковалентная связь. В данном случае она будет неполярной, поскольку речь идет о простом веществе.
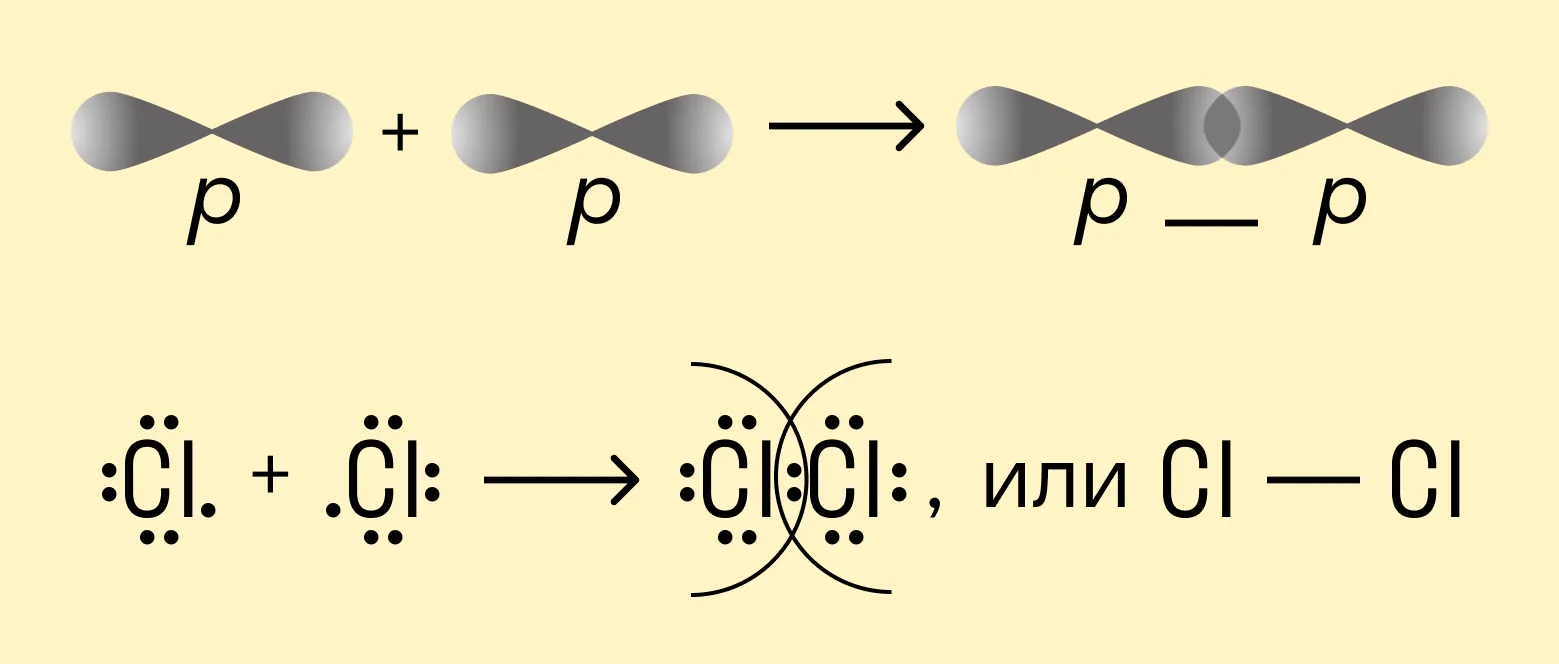
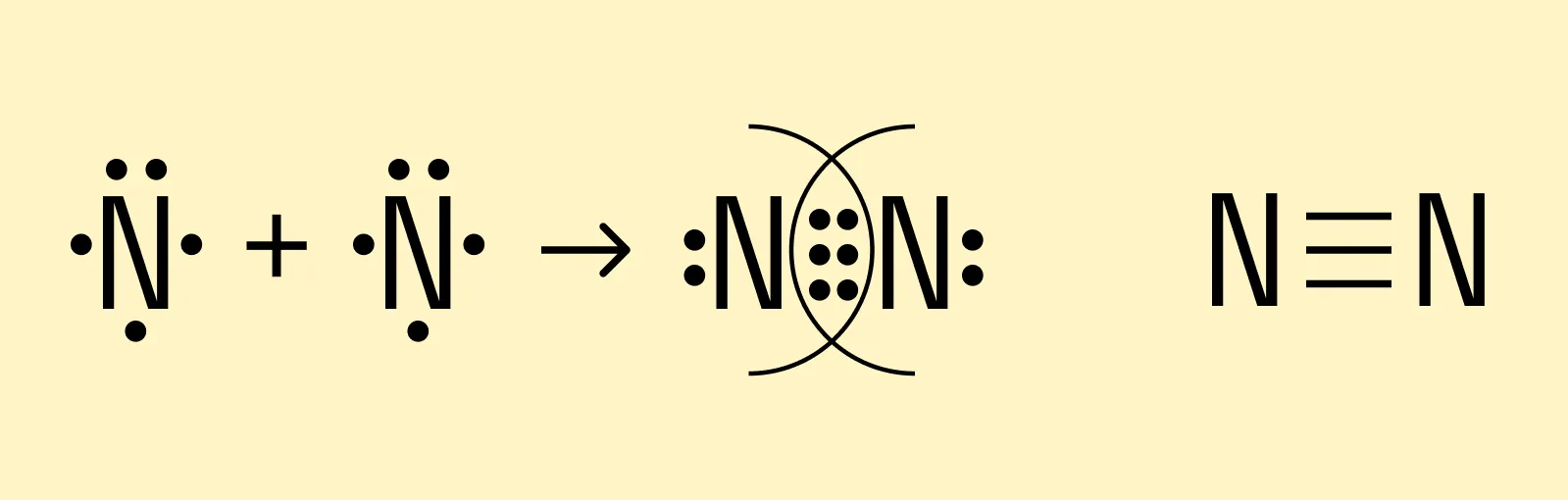
Посмотрим теперь, что происходит с атомами азота, у которых на внешней орбитали целых 5 валентных электронов. Как мы помним, все частицы стремятся приобрести устойчивую форму, которая предполагает двухэлектронную или восьмиэлектронную внешнюю оболочку. Таким образом, атомам азота нужно довести количество электронов на внешней орбитали до 8, для чего они отдают в общие пары по 3 электрона. В результате получаются 3 электронные пары, и такая химическая связь называется тройной.
Понимание разницы между ковалентными неполярными и полярными связями является ключевым для изучения структур различных веществ. Это знание особенно важно при рассмотрении типов кристаллических решеток, которые определяют физические свойства материалов. Кристаллические решётки зависят от природы химических связей, формируя уникальные структуры с различными характеристиками.
Характеристики ковалентной связи
К ковалентным связям применимы те же общие закономерности, что и для других типов. Например, чем меньше длина ковалентной связи, тем она прочнее. Но есть и специфические свойства, которые появляются только при этом виде взаимодействия:
насыщаемость,
полярность,
направленность.
Насыщаемость ковалентной связи
Насыщаемость говорит об ограничениях по количеству взаимодействий, в которые может вступать один атом. Таких взаимодействий, т. е. химических связей, может быть ровно столько, сколько у атома неспаренных электронов. Как мы помним из примеров выше, у водорода один валентный электрон, поэтому он может образовать только одинарную ковалентную связь.
Полярность ковалентной связи
Полярность связи — это смещение электронной плотности к одному из атомов. Чем больше выражено такое смещение, тем более полярной является связь. Напомним, что электронная плотность смещается всегда в сторону более электроотрицательного элемента. Следовательно, большая разница в ЭО между атомами обуславливает высокую полярность связи.
Атом, к которому смещается общая пара электронов, заряжается отрицательно. Данный заряд обозначают буквой δ-. Второй атом заряжается положительно, и этот заряд обозначают буквой δ+. Очень часто центры положительного и отрицательного зарядов разделяет некоторое расстояние. Молекулы с таким устройством называют диполями (поскольку они имеют два полюса)
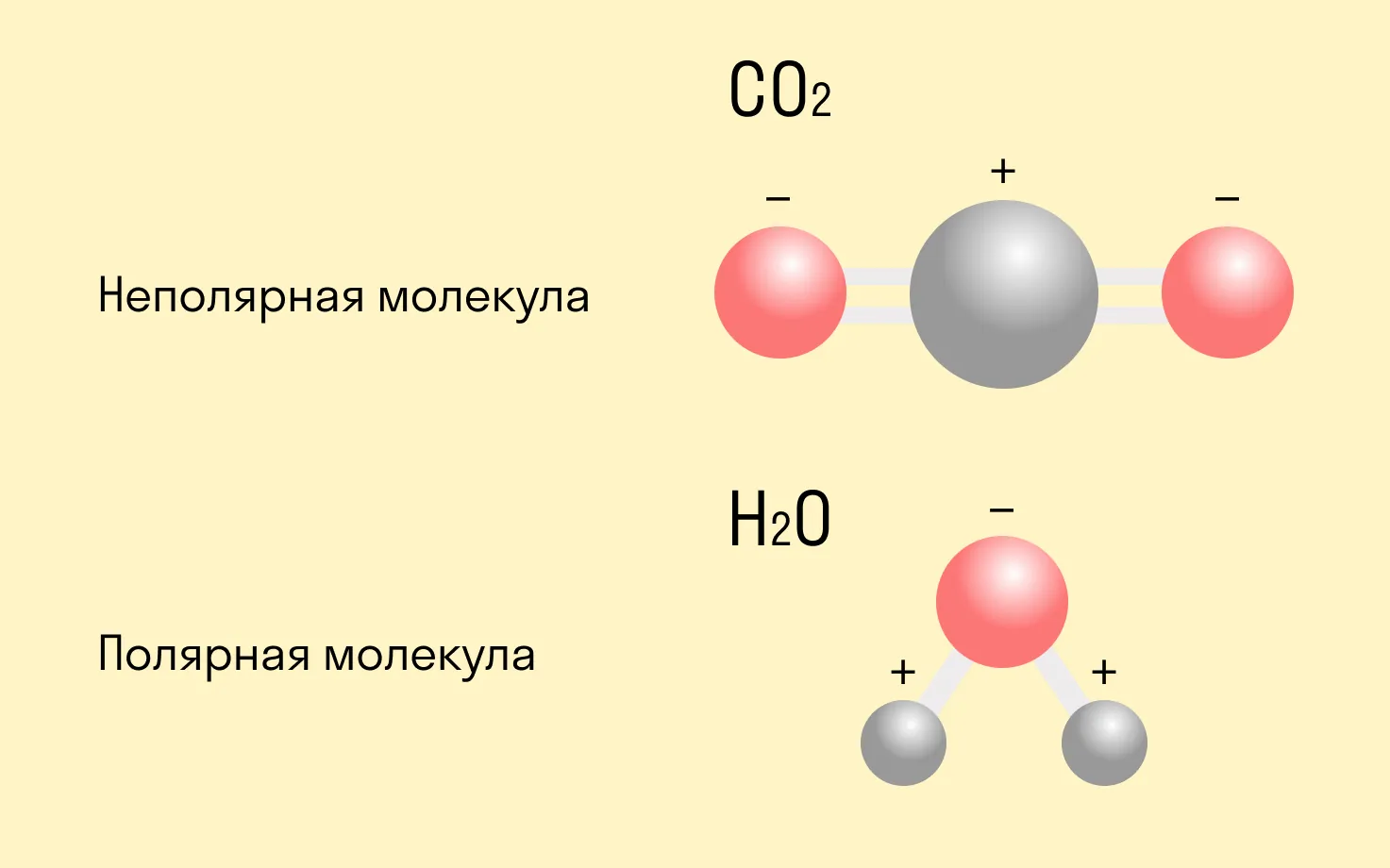
Смещение электронной плотности в сторону одного из атомов, связанных ковалентной полярной связью, в структурной формуле можно обозначить стрелкой или дугой. Стрелка используется, если перекрываемые орбитали атомов находятся на одной оси, а дуга — если они расположены под углом.
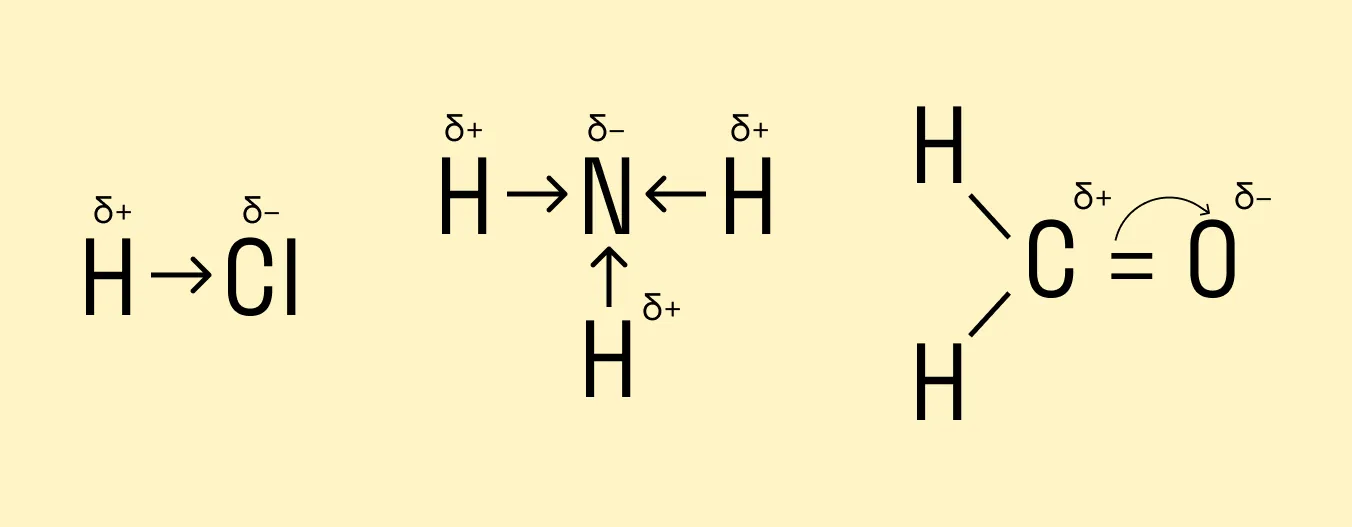
Направленность ковалентной связи
Ковалентная связь становится направленной, если в ней участвуют атомы, чьи орбитали (электронные облака) находятся под определенным углом друг к другу. Если провести воображаемые линии между связанными атомами, можно увидеть этот угол — он называется валентным. По значениям валентных углов легко определить строение молекулы вещества, ее геометрическую форму.
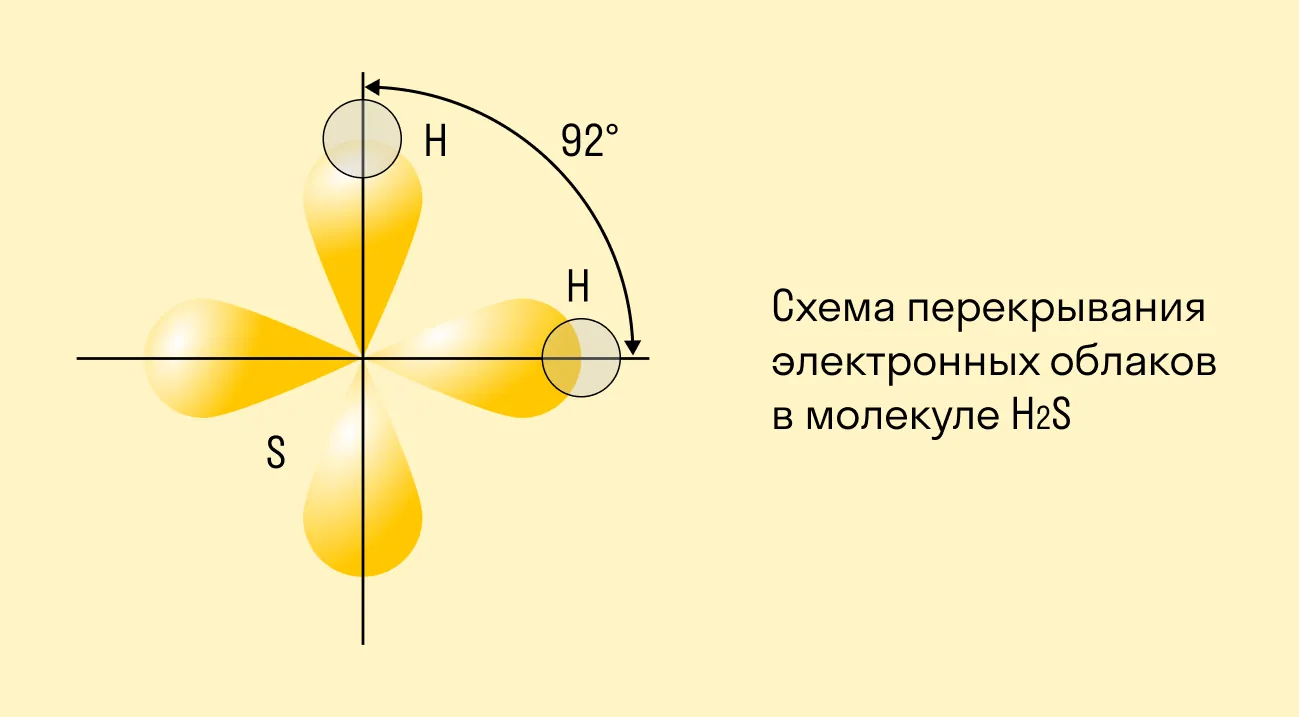
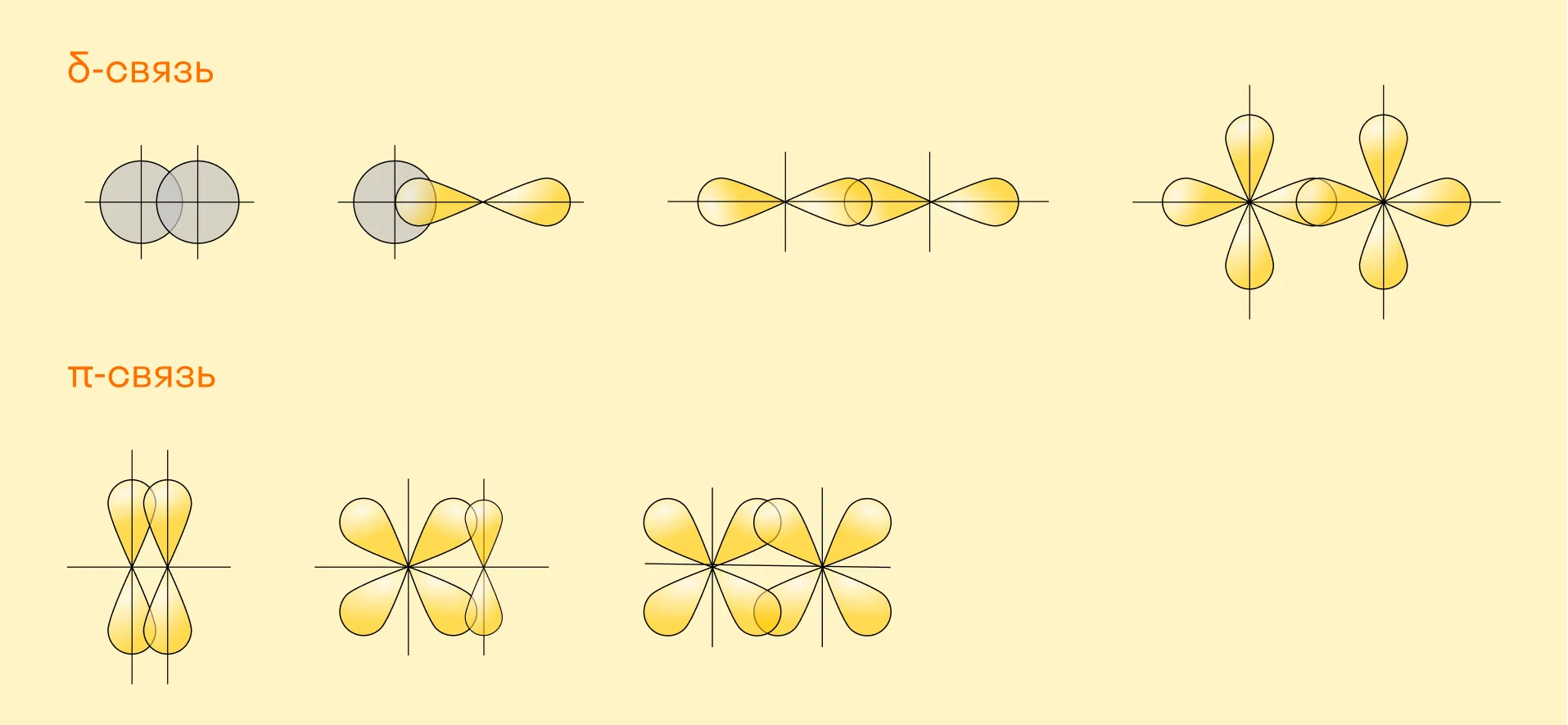
В зависимости от взаимного расположения орбиталей выделяют:
σ-связи, которые образуются, если перекрывание орбиталей идет по оси, соединяющей ядра атомов (т. е. линейно);
π-связи, которые предполагают боковое перекрывание (электронные облака находятся под углом друг к другу).
Как понятно из этих определений, два атома могут иметь только одну σ-связь, а в дополнение к этому они могут быть связаны с другими атомами π-связями.
Вопросы для самопроверки
Дайте определение ковалентной связи.
Что такое ковалентная полярная связь, чем она отличается от неполярной?
Исключите лишнее: ковалентная полярная связь характерна для H2S, O2, N2O5, SF6.
Чем обусловлена кратность химической связи?
Назовите два механизма образования ковалентной связи.