Для кого эта статья:
- студенты и школьники, интересующиеся химией
- специалисты в области химии, экологии и сельского хозяйства
- широкая аудитория, ищущая информацию о pH в повседневной жизни
Что такое водородный показатель pH и зачем он нужен
Водные растворы веществ могут быть кислыми, нейтральными или щелочными. Кислотность среды зависит от концентрации положительно заряженных ионов водорода (H+) и отрицательно заряженных гидроксид-ионов (OH−) относительно друг друга.
Если в растворе [H+] > [OH−], то его называют кислотным,
если [OH−] > [H+] — щелочным,
если [H+] = [OH−] — нейтральным.
В нейтральном растворе концентрация Н+ и ОН− ничтожно мала, поскольку эти ионы активно взаимодействуют друг с другом с образованием малодиссоциирующего соединения Н2О. Поэтому в нейтральном растворе присутствуют только те ионы водорода и гидроксид-ионы, которые образовались в результате обратимой диссоциации:
Н2О ⇆ Н+ + ОН–.
Константа диссоциации имеет незначительную величину и равна:
Концентрация воды практически не изменяется в растворе, поэтому мы можем упростить выражение константы диссоциации воды:
Kw = [H+][OH−] = 10−14.
Получившееся выражение называют ионным произведением воды. Эта величина постоянна при заданной температуре (для T = 22–25 °С Kw = 10−14) для воды и ее растворов.
Концентрация ионов H+ и OH− при комнатной температуре всегда одинакова и равняется:
[H+] = [OH−] = 10−7 моль/л.
Для характеристики кислотности среды более удобно использовать водородный показатель pH (читается «пэ аш»), который равен десятичному логарифму величины [H+] с отрицательным знаком. Формула расчета pH:
Формула pH - это pH = -log[H+], где [H+] - концентрация ионов водорода (H+), выраженная в моль/л.
Например, если концентрация ионов водорода [H+] = 0.01 моль/л, pH = -log(0.01) = 2.
Единица измерения концентрации - моль/л.
Название величины указывает на то, что кислотность или щелочность среды можно выразить через концентрацию только ионов водорода.

Расчет водородного показателя для растворов разной кислотности
Попробуем посчитать pH для чистой воды и нейтральных водных растворов:
pH= −lg[H+] = −lg10−7 = −(−7) = 7.
Для нейтральных водных растворов и чистой воды pH = 7.
Рассчитаем значения водородного показателя для раствора сильной одноосновной кислоты (например, HCl) концентрации 1 моль/л. Концентрация ионов водорода Н+ равняется также 1 моль/л. Подставим значения в ионное произведение воды, которое сохранит свое значение 10−14 и в этом растворе:
Кw = [H+][ОН−] = [1 моль/л] × [ОН−] = 10−14.
В таком случае [Н+] = 100 (так как 100 = 1 моль/л).
Тогда рН = −lg100 = 0.
Для растворов сильных кислот pH = 0.
Рассчитаем значения водородного показателя для раствора сильного основания (например, KOH) концентрации 1 моль/л. Ионное произведение воды принимает вид:
Кw = [Н+][1 моль/л] = 10−14.
Кw = [Н+][100 моль/л] = 10−14.
Тогда
Следовательно, рН = −lg10−14 = 14.
Для растворов сильных оснований pH = 14.
Таким образом, значения pH могут варьироваться в интервале от 0 до 14. Чем меньше рН, тем выше кислотность среды. И наоборот: чем больше рН, тем выше щелочность среды.
Сильнокислотные свойства раствора характерны для pH = 0–3, а сильнощелочные — для pH = 12–14.
Значения pH в зависимости от характера среды:
в нейтральных водных растворах pH = 7;
в кислотных — pH < 7;
в щелочных — pH > 7.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Водородный показатель в быту и производстве
В быту нейтральной средой принято считать диапазон pH = 5–8,5. Растворы такой кислотности (или щелочности) безопасны для кожи и слизистых человека. Ниже приведены pH некоторых веществ, которые мы встречаем в повседневной жизни:

Водородный показатель имеет важное значение во многих отраслях:
в косметологии многие продукты проходят проверку на оптимальное значение pH для безопасности кожи;
в сельском хозяйстве кислотность среды определяют для выращивания сельскохозяйственных культур;
в экологии изменение кислотности дождевых вод, рек, озер свидетельствует об ухудшении экологических условий и т. д.
Запоминать теорию проще, если она подкреплена примерами из реальной жизни. Ученики онлайн-курсов по химии в Skysmart на каждом уроке узнают что-то новое об окружающем мире и учатся применять знания на практике.
Методы определения водородного показателя раствора
Характер среды (кислый, нейтральный или щелочной) определяют с помощью индикатора.
Индикаторы — вещества, которые изменяют окраску раствора при различных значениях pH.
Чтобы определить характер среды, в исследуемый раствор достаточно добавить несколько капель водно-спиртового раствора индикатора — и окраска последнего изменится.
На практике наиболее распространены несколько индикаторов: метилоранж, лакмус и фенолфталеин. Окраска этих индикаторов в кислой, нейтральной и щелочной среде представлена в таблице:
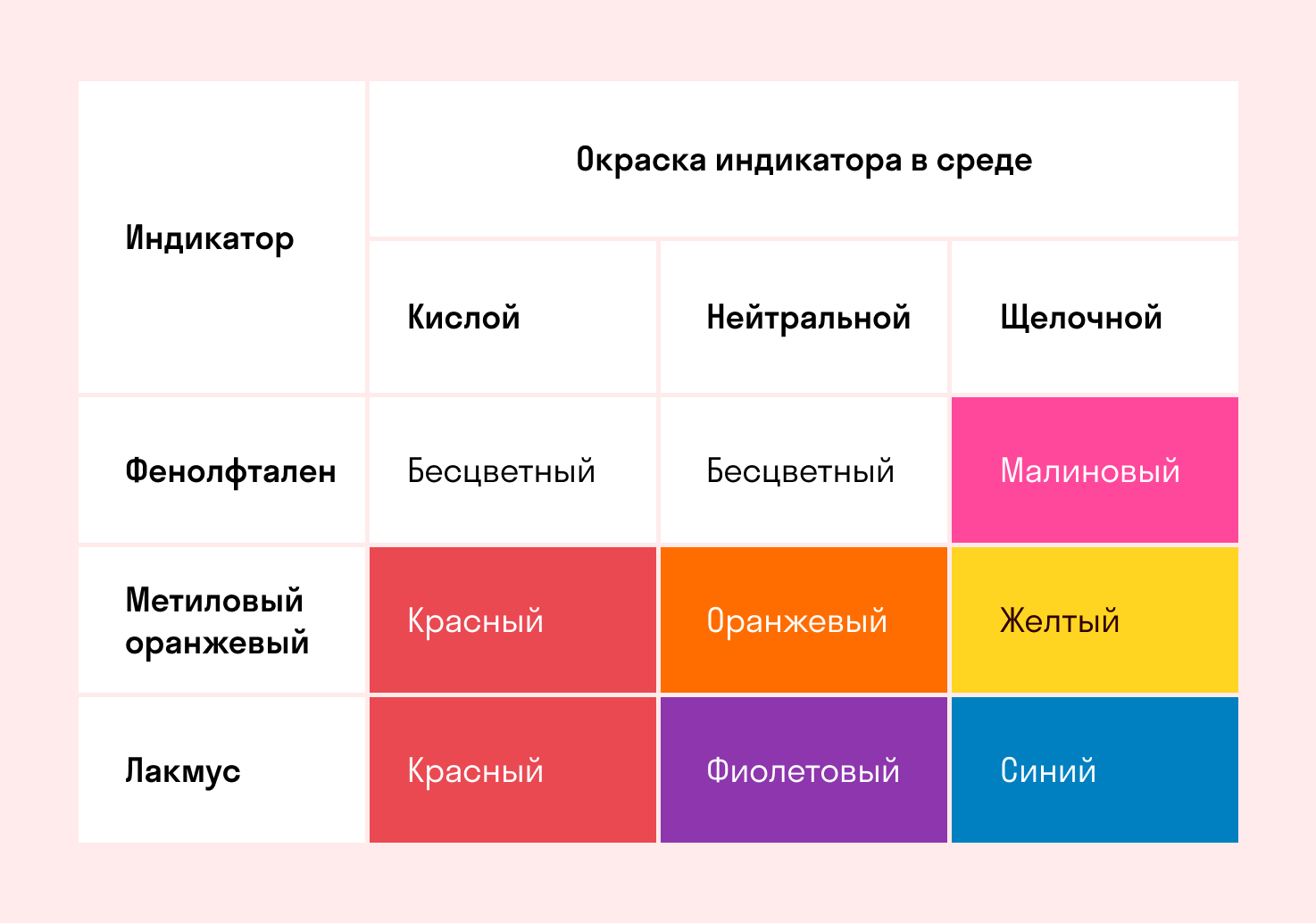
Определение pH среды с помощью индикатора — быстрый и наглядный метод, но для определения более точного значения pH используют универсальный индикатор.
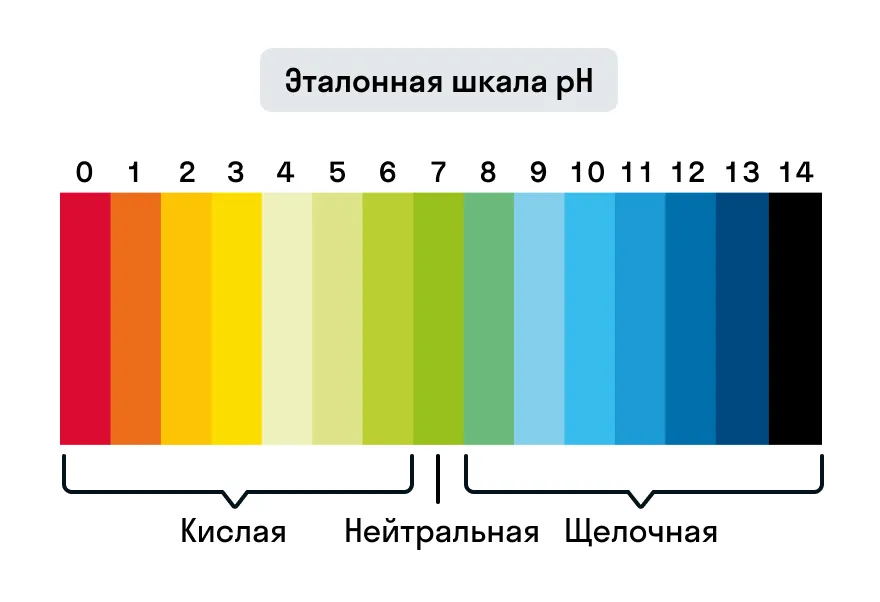
Универсальный индикатор представляет собой смесь высушенных веществ, нанесенных на бумагу. С его помощью можно определить характер среды в широком диапазоне pH — от 1 до 14.
Для измерения водородного показателя pH на бумажную полоску наносят исследуемый раствор, а затем сравнивают цвет индикатора с эталонной шкалой.
Помимо определения характера среды, с помощью индикатора можно отследить изменение концентрации компонента в растворе. Например, реакция нейтрализации (реакция между кислотой и щелочью) протекает без каких-либо признаков (выпадения осадка или выделения газа). Но если к раствору кислоты добавить индикатор лакмус, раствор окрасится в красный, а после добавления к нему щелочи — в фиолетовый. Изменение окраски индикатора подтвердит протекание реакции нейтрализации.
Использование специального прибора pH-метра позволяет измерять значения pH в более широком интервале и с большей точностью (до 0,01 единицы pH) по сравнению с индикаторами.
Работа pH-метра основана на измерении электродвижущей силы (ЭДС), которая создается электродами после погружения в раствор.
Вопросы для самопроверки
Какие значения pH характерны для кислой, нейтральной и щелочной среды?
В каких областях науки и производства необходимо измерять значения pH раствора вещества? Приведите несколько примеров.
Что такое индикатор? Как определить с его помощью характер среды?
В чем преимущества универсального индикатора?
Как называется прибор для более точного определения водородного показателя среды? Приведите его преимущества.



















