Для кого эта статья:
- Студенты и аспиранты в области химии
- Научные исследователи и преподаватели химии
- Специалисты в области смежных научных дисциплин
Какими бывают механизмы реакции
Представьте, что радикальные реакции — это как вечеринка, где все веселятся, но иногда что-то может пойти не по плану, и начинается цепная реакция. Ионные реакции, с другой стороны, — это как званый ужин с соблюдением всех правил этикета. Если вы думали, что химия — это скучно, то это совсем не так. И сейчас мы расскажем, как именно молекулы устраивают свои вечеринки и званые ужины.
Для начала введём несколько понятий, которые пригодятся нам по ходу изучения данной темы.
Реагент — вещество, воздействующее на молекулу, и вызывающее изменение химической связи в ней
Субстрат — молекула, предоставляющая атом для образования новой связи.
Ионный механизм реакции
Какие мысли приходят, когда мы видим название этого механизма? Конечно, сразу вспоминаются катионы, анионы и ионная химическая связь. И, действительно, ионный механизм реакции — это процесс, в результате которого образуются ионы. Однако в органических реакциях они носят название карбокатионов и карбанионов.
Карбокатионы заряжены положительно, карбанионы — отрицательно. Образуются они при гетеролитическом разрыве ковалентной связи, когда один из атомов получает общую электронную пару:
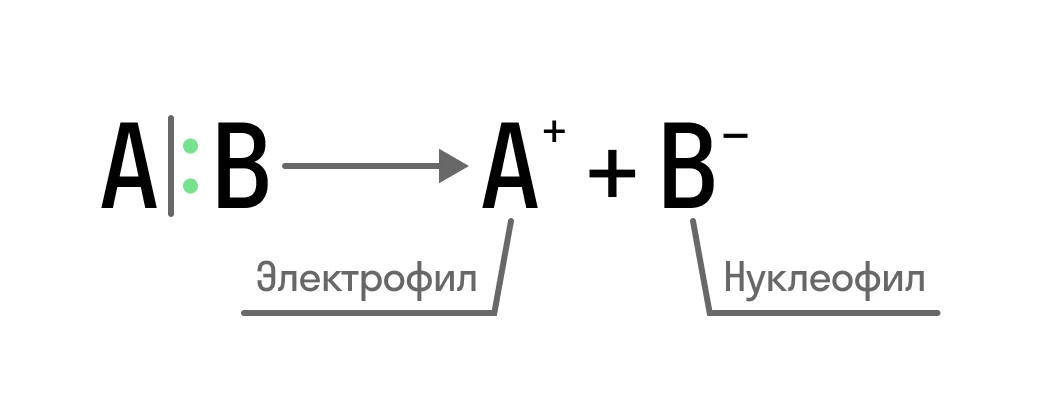
Один из образовавшихся ионов — это электрофил, а второй — нуклеофил.
Электрофилы — это частицы, обладающие свободной орбиталью на внешнем энергетическом уровне.
Нуклеофилы — это частица, на внешнем энергетическом уровне которой содержится неподеленная пара электронов.
|
Электрофильные частицы — акцепторы |
Нуклеофильные частицы — доноры |
|---|---|
|
Положительно заряженные ионы: H+, CH3+, CH3CO+ и пр. |
NH3, 一NH2 |
|
H2O, R一OH, R一O一R, RCOO一, OH一 |
|
|
Галогеналканы, альдегиды, кетоны и пр. |
C=C, C☰C |
|
Анионы: Cl−, NO3− и пр. |
Естественно, данный механизм реакции основан на электроотрицательности, и общая электронная пара всегда будет у той частицы, что обладает большей электроотрицательностью. Кроме того, для реакций, проходящих по этому механизму, необходимо соблюдение определенных условий:
- использование катализатора (кислоты Льюиса);
- небольшая температура;
- наличие полярного растворителя.
Реакции в органической химии, протекающие по ионному механизму, можно четко разделить на две категории: нуклеофильные и электрофильные.
Нуклеофильная реакция
Нуклеофильная реакция — процесс, при котором органическое вещество взаимодействует с нуклеофильной частицей.
Выделяют нуклеофильное присоединение и нуклеофильное замещение. Реакцию начинают нуклеофилы (образованные при гетеролитическом разрыве), атакующие в субстрате положительно- или частично положительно заряженные атомы.
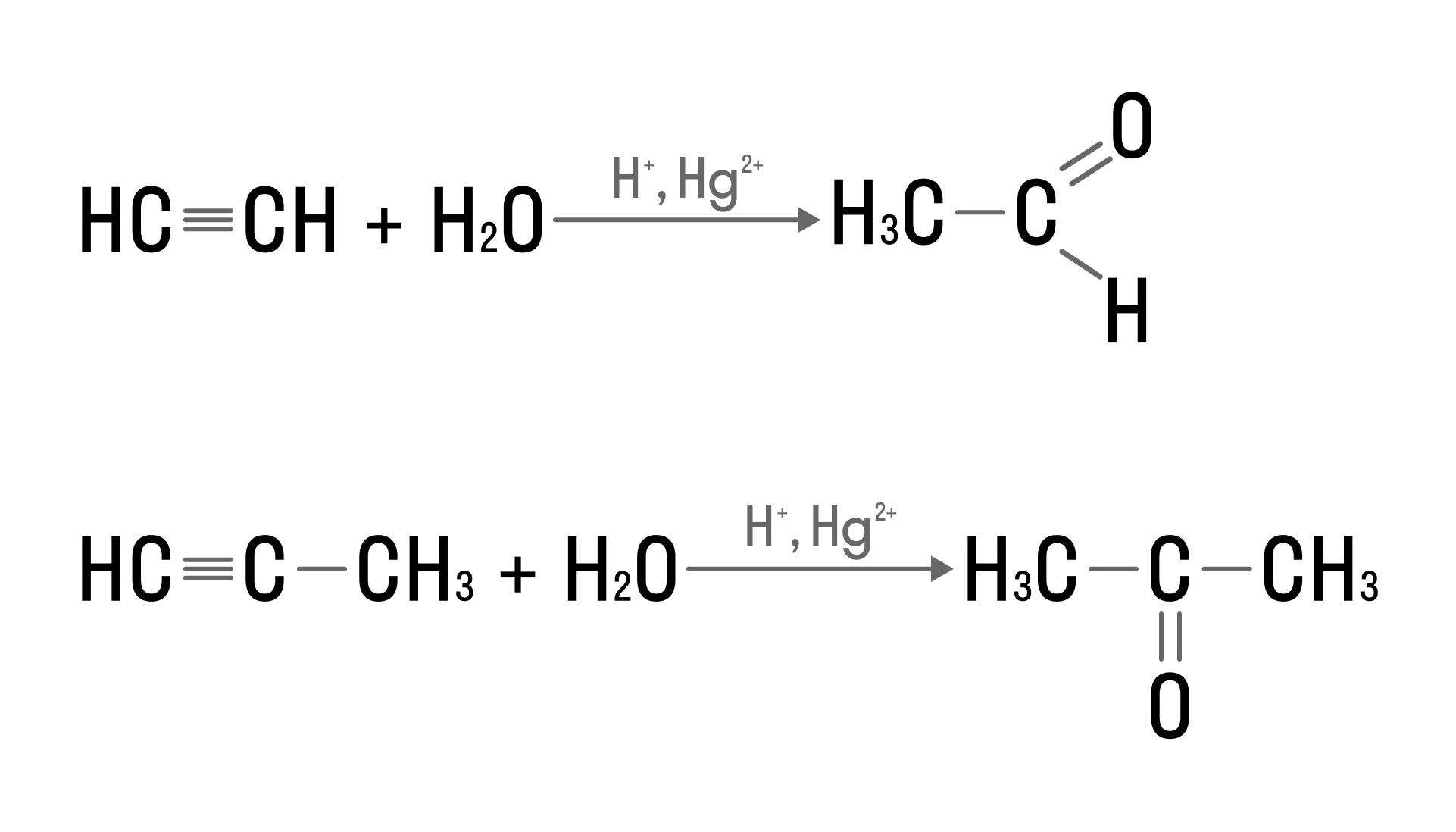
Нуклеофильное присоединение наиболее характерно для альдегидов, кетонов и молекул с кратными связями. Так, реакция Кучерова проходит именно по этому механизму:
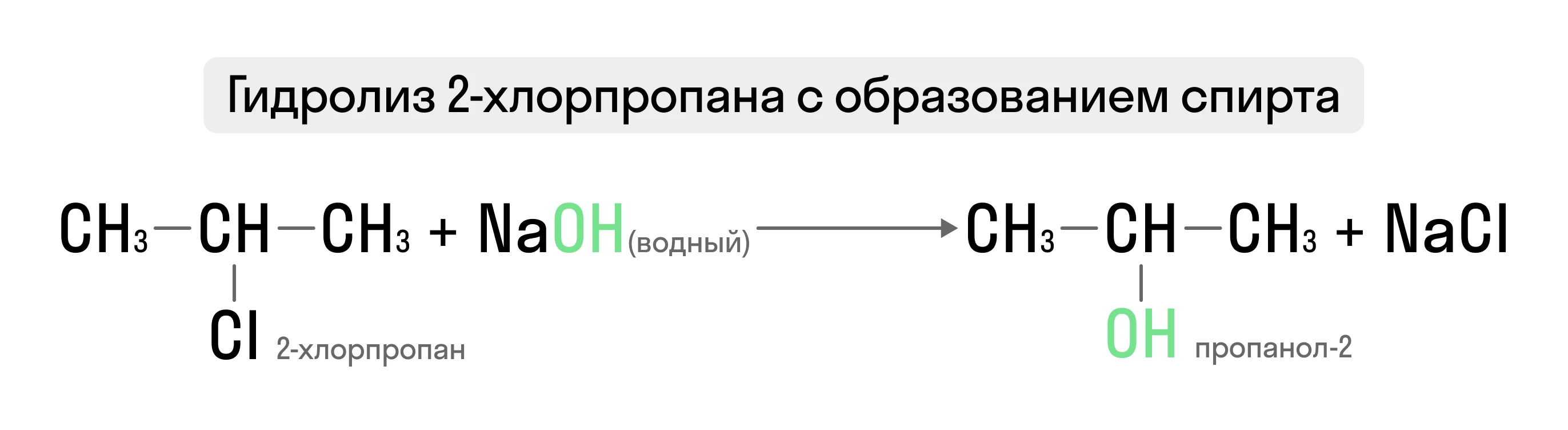
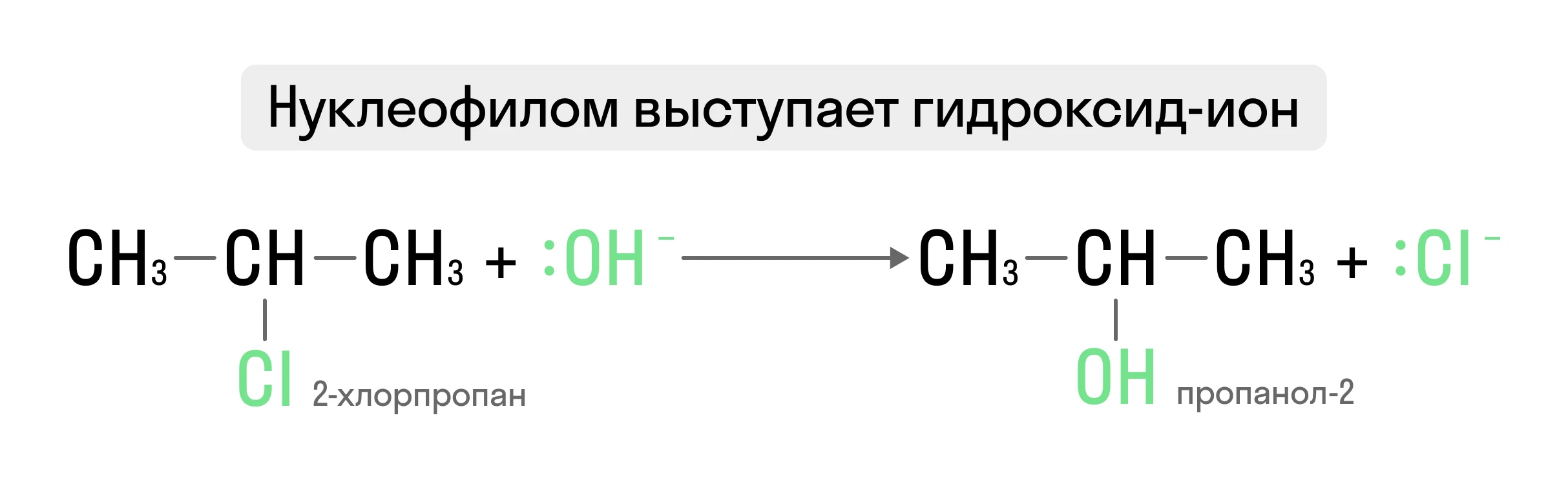
Нуклеофильное замещение характерно в основном для алифатических молекул при гидролизе, аминировании и т.д.
Электрофильная реакция
Электрофильная реакция — процесс, при котором органическое вещество взаимодействует с электрофильной частицей.
Различают электрофильное присоединение и электрофильное замещение. Реакция начинается с атаки электрофилов на субстрат.
Электрофильное замещение чаще всего встречается у аренов. Электрофил занимает место «функциональной группы» той молекулы, с которой вступает в реакцию:
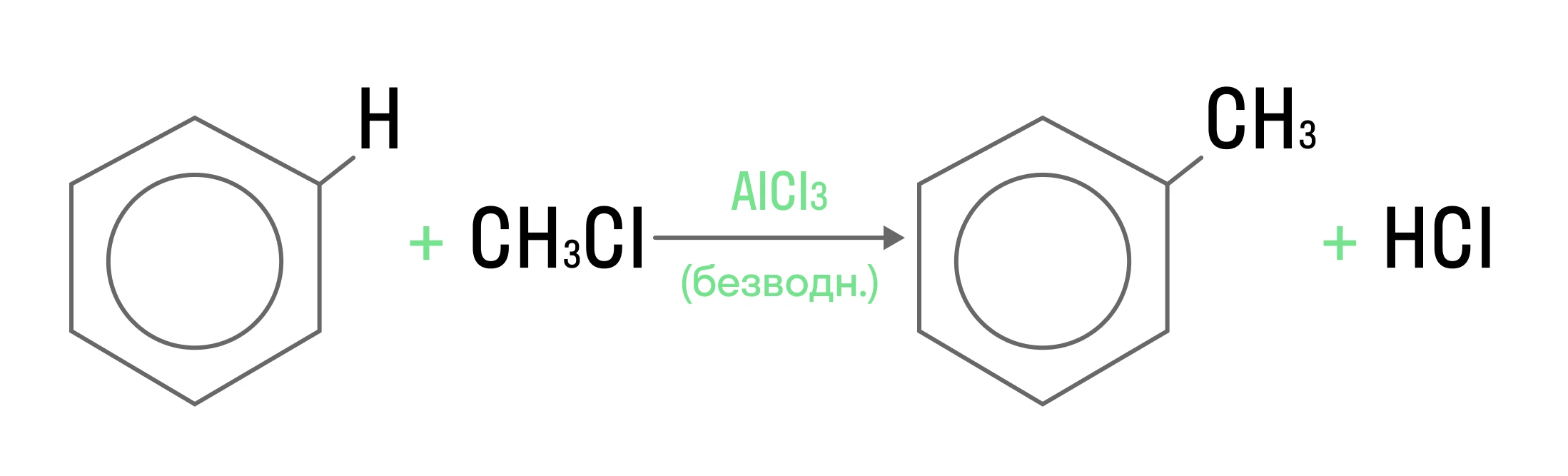
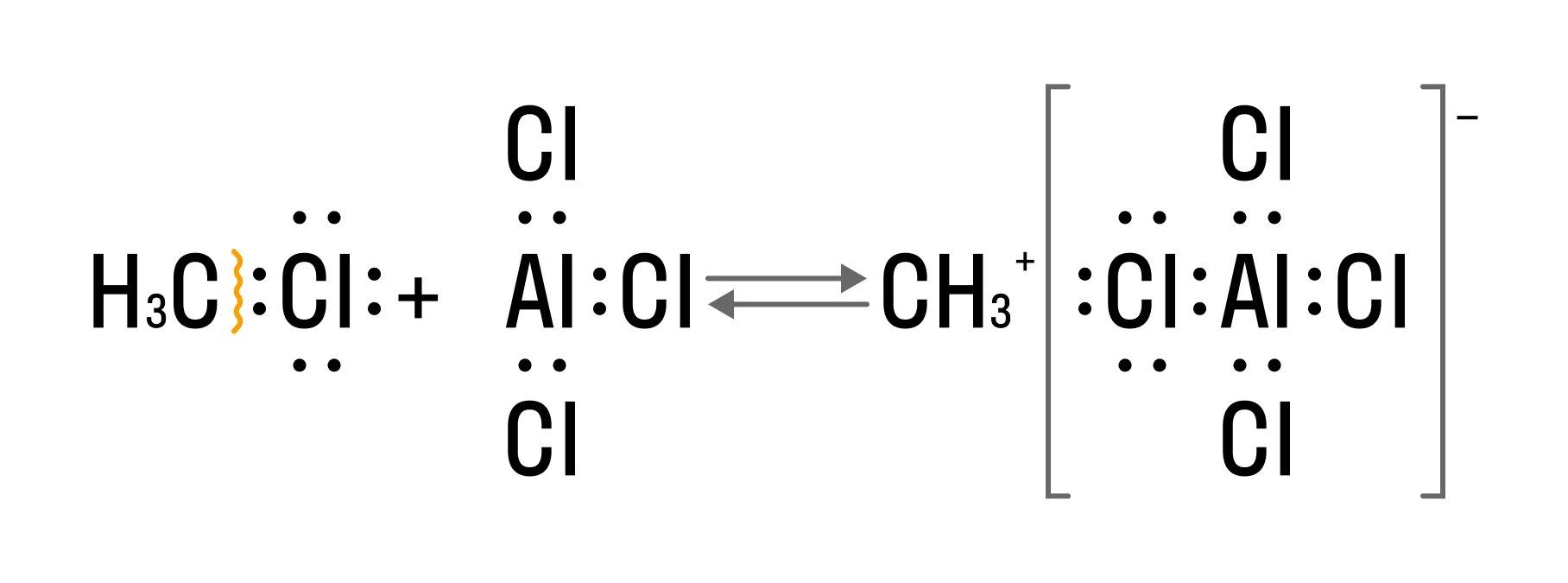
В качестве электрофила выступает частица CH3+. Катализатор же позволяет образоваться электрофильной частице:
Таким же образом можно провести и нитрование бензола:
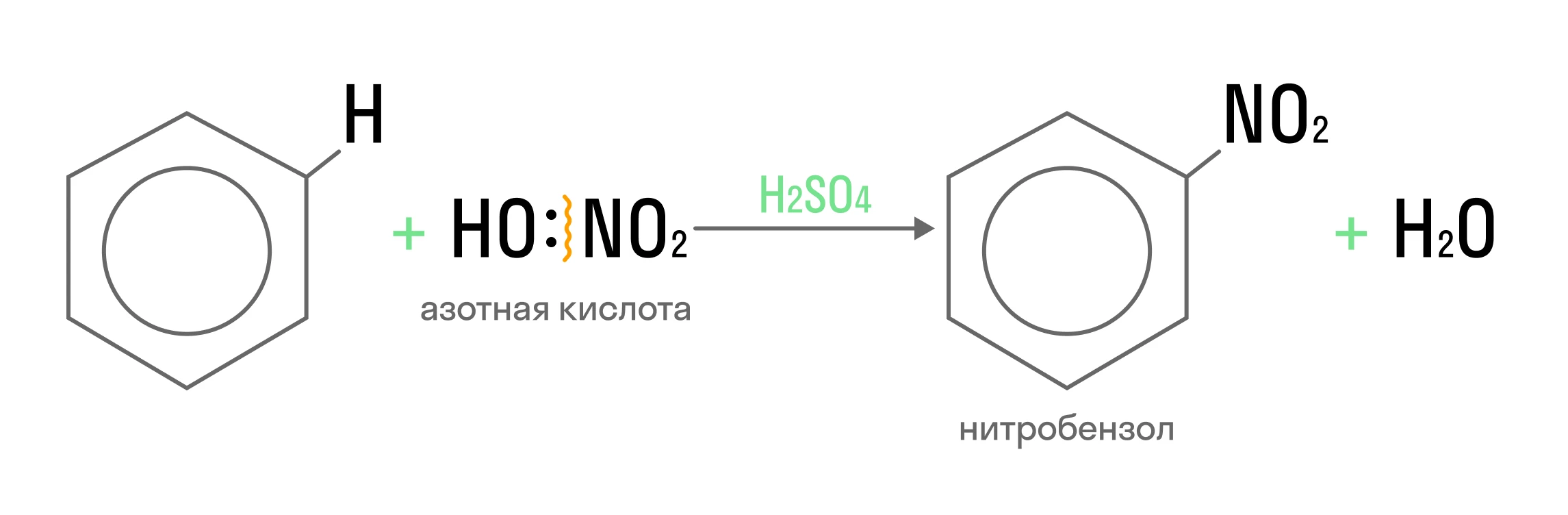
Электрофил — NO2+ образуется за счет действия катализатора:
Электрофильное присоединение характерно для веществ с кратными связями, а в ходе реакции связи разрываются. Протекает такое присоединение в несколько стадий:
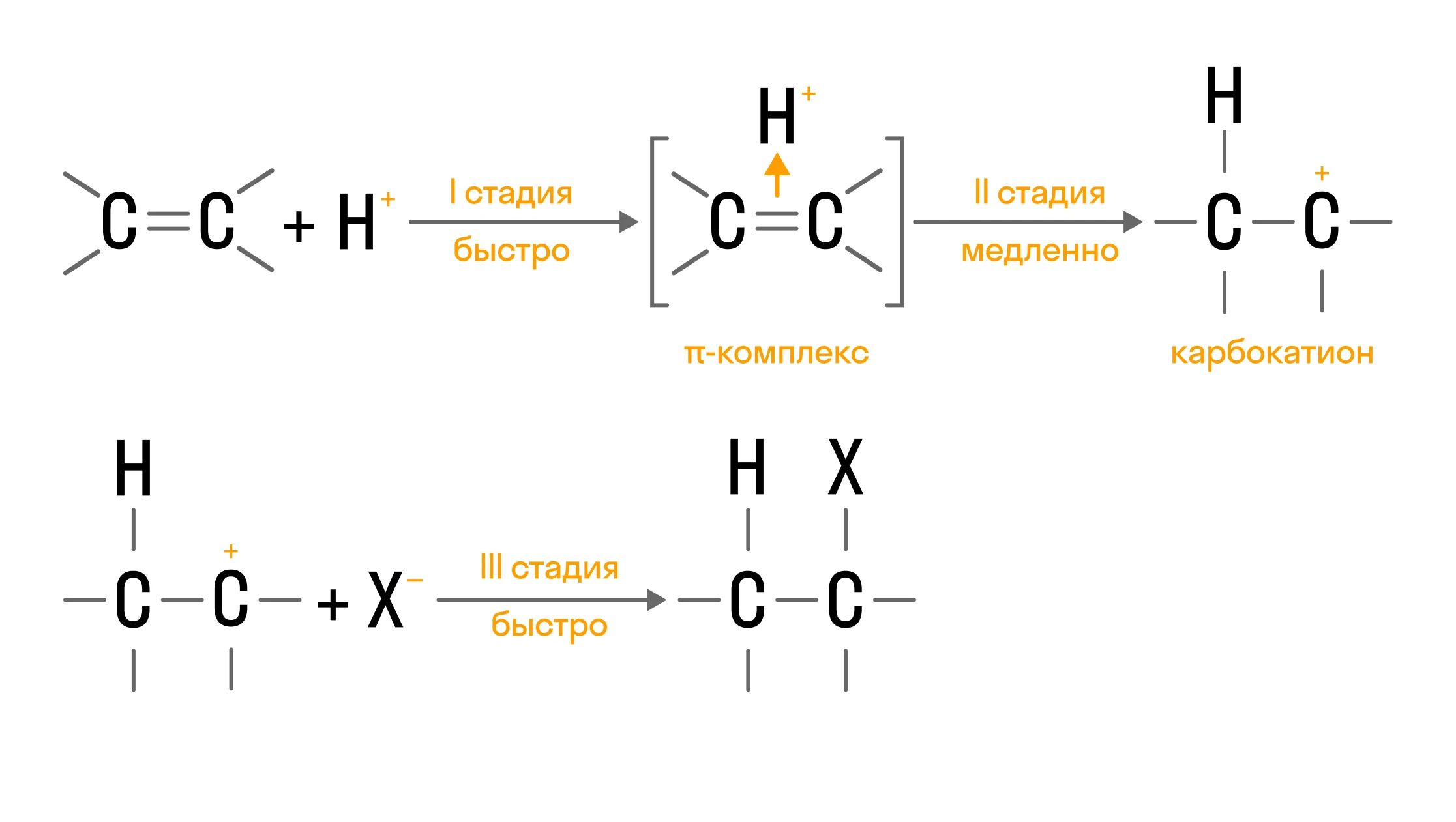
Если молекула вещества, вступающего в реакцию, является несимметричной, то принято пользоваться правилом Марковникова.
Правило Марковникова
Атом водорода всегда присоединяется к наиболее гидрогенизированному атому углерода при кратной связи
Однако есть и исключения. Например, если заместитель в молекуле оттягивает электронную плотность на себя или присутствуют свободные радикалы, то присоединение происходит против правила Марковникова. Так, в присутствии пероксида водорода при гидрогалогенировании пропена образуется 1-бромпропан:
Кроме того, принцип этот действует и когда механизм реакции не ионный, а радикальный.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Радикальный механизм реакции
Данный механизм осуществляется, когда происходит гомолитический разрыв ковалентной связи, то есть каждый атом получает по одному электрону из общей электронной пары:
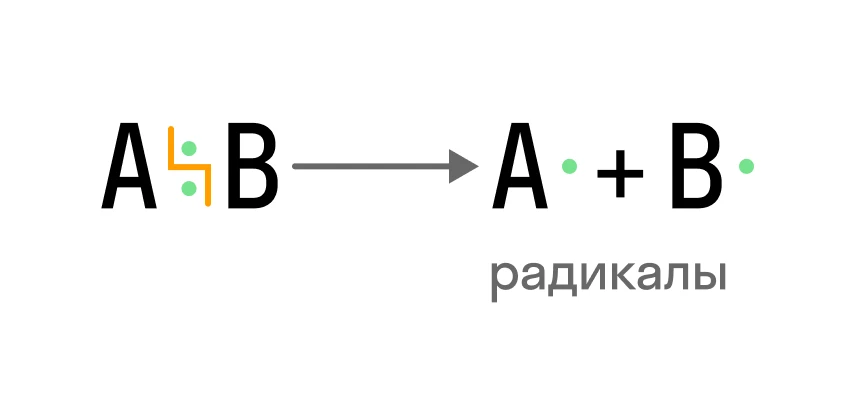
Так образуются свободные радикалы — частицы, содержащие по одному неспаренному электрону. Для таких реакций также необходимы условия:
- свет или ультрафиолетовое излучение;
- повышенная температура.
По своей сути радикальные реакции являются цепными, так как образовавшиеся радикалы — частицы крайне активные и стремятся связаться с другими атомами.
Яркий пример реакции, проходящей по радикальному механизму — галогенирование алканов:
Инициирование цепи. На этом этапе из молекулы галогена под действием света образуются радикалы:
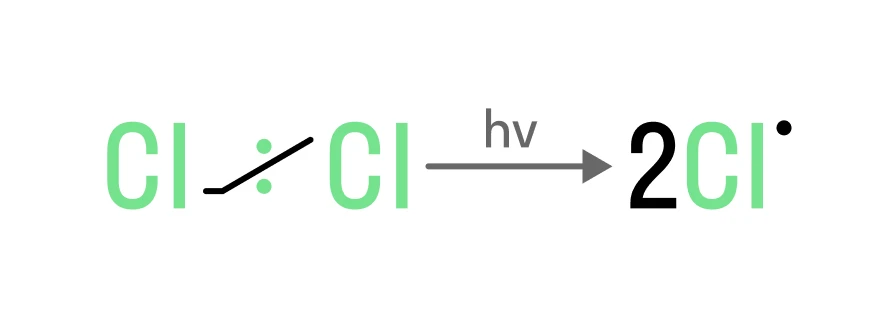
Развитие цепи, когда радикалы начинают воздействовать на молекулу, образуя промежуточные частицы — алкильные радикалы:
Обрыв цепи — образование молекул:
Итак, мы рассмотрели два основных механизма реакции в органике — ионный и радикальный:
- Радикальные реакции характеризуются гомолитическим разрывом связи, проходят с образованием свободных радикалов, что часто приводит к цепным реакциям.
- Ионные реакции охарактеризованы гетеролитическим разрывом химической связи и образованием ионов — карбокатионов и карбанионов. Реакции проходят обязательно в присутствии катализаторов.
- Ионные реакции считаются более контролируемыми и предсказуемыми, нежели реакции радикальные.
Чтобы лучше разобраться в теме перед экзаменом и набить руку на заданиях, присоединяйтесь к курсу подготовки к ЕГЭ по химии. Уже на первом занятии вы сможете найти пробелы в знаниях и понять, как их устранить. Это бесплатно!























