Для кого эта статья:
- Школьники и студенты, изучающие физику
- Люди, желающие улучшить свои знания в области термодинамики
- Ученые или любители науки, ищущие информацию о температуре и её измерении
Что такое температура
Температура — характеристика внутреннего состояния вещества, которая показывает степень его нагретости.
Температуру можно отнести к макроскопическим параметрам, наряду с объёмом и давлением. Макроскопические параметры описывают вещество как единое целое, не исследуя при этом характеристики отдельных молекул и атомов, из которых оно состоит.

Обозначение, единица измерения, шкалы измерения
Температуру обозначают латинской буквой T, а основные единицы измерения температуры в международной системе (СИ) — это Кельвин (К). В повседневной жизни также часто используют градус Цельсия (°C) и градус Фаренгейта (°F), но эти шкалы созданы для бытовых нужд и имеют свои недостатки для научных расчетов.
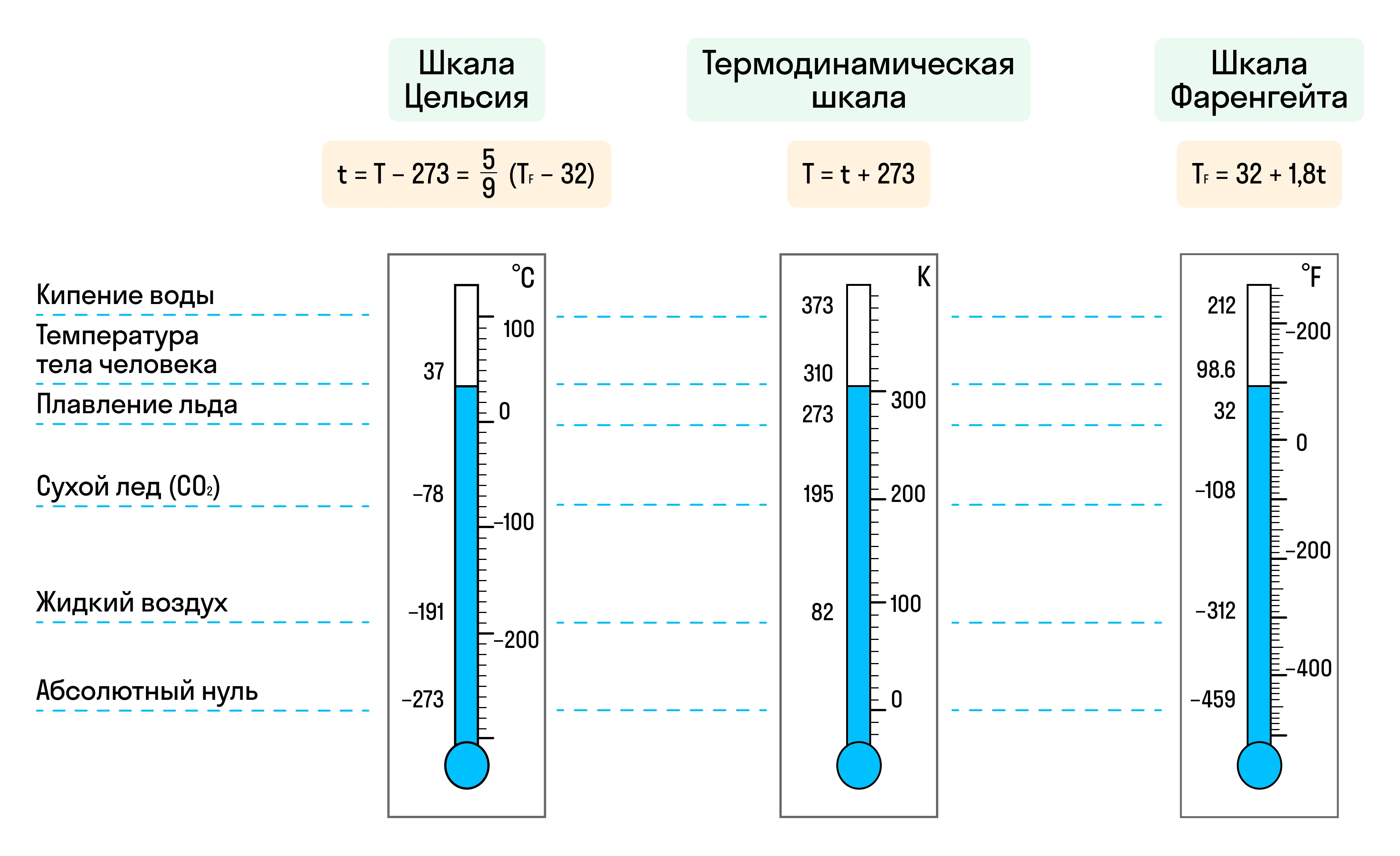
|
Основные шкалы температуры |
||
|---|---|---|
|
Шкала Цельсия |
Шкала Фаренгейта |
Шкала Кельвина |
|
В этой шкале 0°C соответствует температуре замерзания воды, а 100°C — её кипению при нормальном атмосферном давлении. Шкала Цельсия удобна в повседневной жизни, однако она не абсолютна — возможны как отрицательные, так и положительные значения, что создаёт неудобства при работе с физическими законами и расчетами. |
Используемая преимущественно в США, шкала Фаренгейта определяет 32°F как точку замерзания воды и 212°F как её точку кипения. |
Абсолютная шкала температуры, в которой 0 K (абсолютный ноль) — это температура, при которой всё тепловое движение молекул прекращается. Единица изменения температуры в шкале Кельвина совпадает с градусом Цельсия, но вся шкала смещена на 273,15 градусов ниже нуля по Цельсию. Эта шкала идеальна для научных исследований, так как она позволяет выражать все температуры в положительных значениях, упрощая формулы и расчёты. |
Переход к абсолютной шкале температуры в физике значительно упростил изучение явлений, связанных с молекулярным движением и термодинамическими процессами. С появлением шкалы Кельвина физики смогли точнее описывать процессы охлаждения, нагрева и поведения газов при разных температурах.
Получи больше пользы от Skysmart:
-
Подготовься к ОГЭ на пятёрку
-
Подготовься к ЕГЭ на высокие баллы
Записывайся на бесплатные курсы для детей
Решай задания в бесплатном тренажёре ЕГЭ
Измерительные приборы
Жидкостные термометры — это устройства, в которых для измерения температуры используется расширение жидкости, чаще всего ртути или спирта, внутри стеклянной трубки.
В обычных условиях такие термометры в зависимости от назначения могут измерять температуры в среднем от −30 до +300 °C (для ртутных) и от −70 до +80 °C (для спиртовых). Жидкость расширяется при нагреве и сужается при охлаждении, показывая, насколько изменилась температура.
Однако для научных лабораторий такие термометры не всегда подходят по нескольким причинам:
- Неточность измерений. Жидкость в термометре реагирует не только на температуру, но и на давление и плотность окружающей среды. В лабораторных условиях требуется точность, которую такие термометры не обеспечивают.
- Ограниченный диапазон температур. Жидкостные термометры не подходят для экстремально высоких и низких температур. Ртуть замерзает при −39 °C и кипит при 357 °C, а спиртовые термометры ограничены ещё более низкими значениями, что затрудняет работу с температурами в диапазонах, часто встречающихся в научных исследованиях.
- Риск загрязнения и опасность. В случае повреждения термометра разлив ртути создает токсичную среду, которая требует осторожной утилизации, а повреждения спиртовых термометров приводят к загрязнению и потерям точности в дальнейших измерениях.
В связи с этим в лабораториях используют газовые термометры. Газовые термометры основаны на законах термодинамики, где температура напрямую связана с давлением газа при постоянном объёме.
Принцип действия газового термометра состоит в том, что при изменении температуры меняется давление газа в закрытом сосуде, а при постоянном давлении меняется объём. Это изменение точно отражает абсолютную температуру газа, что делает их крайне точными.
Температура и скорость движения молекул
Согласно МКТ, частицы, из которых состоит вещество, находятся в бесконечном хаотичном движении. Такое движение называется тепловым, т.к. скорость движения молекул зависит от температуры. Чем больше температура, тем скорость движения больше и наоборот.
Раз температура влияет на скорость, она также влияет и на кинетическую энергию движения молекул:
Исходя из этого, можно дать такое определение температуры:
Температура — это мера средней кинетической энергии молекул, из которых состоит вещество.
k — постоянная Больцмана, k = 1,38 × 10−23 Дж/°K, T — абсолютная температура газа (в Кельвинах).
Взаимосвязь температуры, давления и объёма
Наиболее полно взаимосвязь макроскопических параметров (температуры, давления и объёма) можно рассмотреть на модели идеального газа. Такая модель упрощает поведение реальных газов, игнорируя взаимодействие между молекулами и их объём, что позволяет получить теоретическую основу для понимания газовых процессов.
Закон Бойля-Мариотта
При постоянной температуре T произведение давления p на объём V остается постоянным:
pV = const
Это означает, что при уменьшении объёма давление увеличивается, и наоборот, если температура остается неизменной.
Закон Шарля
При постоянном давлении объём газа прямо пропорционален температуре:
TV = const
При увеличении температуры объём газа будет увеличиваться, если давление не меняется.
Закон Гей-Люссака
При постоянном объёме давление газа пропорционально его температуре:
pT = const
Если объём фиксирован, то при нагревании давление увеличивается.
Эти законы объединяются в уравнении состояния идеального газа:
pV = υRT, где
p — давление газа [Па], V — объём газа [м3], υ — количество вещества [моль].
R = k ⋅ NA = 8,31 Дж/моль ⋅ °K — универсальная газовая постоянная, T — абсолютная температура газа (в Кельвинах).
Это уравнение позволяет находить любую из величин, если известны остальные, и показывает, как при изменении температуры и объёма изменится давление газа, а также как температура влияет на объём при постоянном давлении.
Тепловое равновесие
Вспомним принцип использования медицинского термометра: мы приводим его в соприкосновение с нашим телом, ожидаем 5–8 минут, и после этого прибор показывает температуру нашего тела. Разберёмся, каким образом температура прибора и нашего тела при этом становятся одинаковыми.
Тепловое равновесие — это состояние, при котором два или более тела (или системы) находятся в тепловом контакте и имеют одинаковую температуру.
Также при тепловом равновесии и другие макроскопические параметры тела долгое время остаются неизменными
Когда два тела с разными температурами вступают в тепловой контакт, энергия в форме тепла передается от более нагретого тела к менее нагретому. Этот процесс будет продолжаться до тех пор, пока температура не станет одинаковой для обоих тел.
Например:
- Если поместить горячую ложку в стакан с холодной водой, через некоторое время ложка и вода достигнут одной температуры.
- Если тёплая рука прикасается к холодному металлу, металл начнет поглощать тепло от руки, пока их температуры не выровняются.
В этом процессе важна разница температур: если изначально объекты были одинаково нагреты, процесс теплообмена происходить не будет.
Задачи про температуру и тепловое равновесие
Задача 1
В сосуде с жёсткими стенками находится в равновесном состоянии смесь 1 моля гелия и 1 моля азота. Температуру смеси повысили. Выберите все верные утверждения.
- В результате повышения температуры внутренняя энергия гелия увеличилась больше, чем внутренняя энергия азота.
- Средние кинетические энергии поступательного теплового движения молекул гелия и молекул аргона в равновесном состоянии одинаковы.
- Среднеквадратичные скорости молекул гелия и молекул азота в равновесном состоянии одинаковы.
- После повышения температуры парциальное давление гелия в сосуде увеличилось.
- После повышения температуры давление в сосуде увеличилось.
Решение и ответ
Решение:
- Изменение внутренней энергии идеального газа равно
- Средняя кинетическая энергия идеального газа рассчитывается по формуле:
- Средняя квадратичная скорость идеального газа равна
- Объём не менялся, температура увеличилась. Тогда по закону Гей-Люссака: При постоянном объёме давление газа пропорционально его температуре. Значит, парциальное давление гелия в сосуде увеличилось. Утверждение верно.
- При повышении температуры парциальные давления обоих газов увеличатся, а значит, увеличится и давление газа в сосуде. Утверждение верно.
Ответ: 245
Задача 2
Для создания и поддержания температуры 0 °С учёный сделал следующее: он налил в теплоизолированный стакан дистиллированную воду комнатной температуры, сверху добавил жидкий азот и перемешал смесь ложкой. Далее учёный перенёс смесь в специальный сосуд, где она медленно таяла при 0 °С.
Какой объём V жидкого азота понадобится для приготовления 300 г смеси, содержащей 75% льда и 25% воды (по массе), из воды при температуре 25 °С? Потерями тепловой энергии можно пренебречь.
Удельная теплоёмкость воды: c = 4200 Дж/кг ⋅ С.
Удельная теплота плавления льда: λ = 3,3 ⋅ 105 Дж/кг.
Плотность жидкого азота ρазота = 808 кг/м3.
Удельная теплота парообразования азота L = 197 600 Дж/кг.
Решение и ответ
Решение:
Проанализируем процессы, которые происходят по условию задачи:
- Дистиллированная вода охлаждается на 25 градусов (с +25°С до 0°С), далее 75% воды кристаллизуется, выделяя при этом тепло.
- Полученная тепловая энергия идет на испарение жидкого азота.
Рассчитаем Q охлаждения воды:
Qохл=cmΔt = 4200 ⋅ 0,3 ⋅ 25 = 31 500 Дж
Рассчитаем Q кристаллизации 75% воды:
Qкрист = 0,75λm = 0,75 ⋅ 0,3 ⋅ 3,3 ⋅ 105 = 74 250 Дж
Энергия, которая выделится при этих двух процессах, равна
Q = 31 500 + 74 250 = 105 750 Дж
Эта энергия равна количеству теплоты, необходимому для парообразования жидкого азота:
Q = Qпарооб
Qпарооб = Lmазота
mазота = ρазота ⋅ Vазота
Qпарооб = L ⋅ ρазота ⋅ Vазота
Тогда объём испарившегося азота можно выразить из формулы:
Ответ: 662 см3
Больше задач про температуру и тепловое равновесие мы решаем на курсе подготовки к ЕГЭ по физике в онлайн-школе Skysmart. Присоединяйтесь к нам – разберём все сложные темы и поможем сдать экзамен без стресса. Записывайтесь на курс и вместе с нами погружайтесь в удивительный мир физики!
























