Для кого эта статья:
- Студенты и школьники, изучающие физику
- Люди, интересующиеся научными темами и основами термодинамики
- Учителя и репетиторы, работающие с курсами по физике
Что такое тепло?
Начнем с вопроса одновременно легкого и сложного: что такое тепло?
Теплом называется природная энергия, которая создается беспорядочным движением частиц тела (атомов, молекул и т. п.) и проявляется в нагревании этого тела.
Такое определение не было известно людям сразу. Например, было такое предположение: теплота — это невидимая, невесомая жидкость, которая притекает в физические тела. И чем больше объем этой жидкости, тем тело горяче́е. Конечно же, эта гипотеза не нашла подтверждения.
Позже ученые обратили внимание на поведение молекул при нагревании или охлаждении тела. С ростом температуры скорость молекул возрастает, они чаще сталкиваются друг с другом. При этом растет потенциальная и кинетическая энергия, а значит, и внутренняя, что проявляется в буквальном нагревании тела. Такое хаотичное движение молекул называют тепловым движением.
Тепловое движение — процесс хаотичного движения частиц, образующих вещество.
Логично предположить: раз с ростом температуры скорость молекул увеличивается, то при понижении температуры скорость будет падать. Но возможна ли полная остановка движения? До какой температуры следует охладить тело в таком случае?
Чтобы это произошло, потребуется охладить тело до абсолютного нуля по шкале Кельвина, что соответствует −273,15 °C, или −459,67 °F. Молекулы в таких условиях прекратят движение и замрут в узлах кристаллической решетки. Но достичь такого температурного режима невозможно ни на планете Земля, ни во всей Вселенной, ни даже в лабораторных условиях.

Каким образом можно нагреть вещество?
На самом деле способов больше, чем один. Телу можно передать тепло непосредственно или же изменить его внутреннюю энергию, совершив над ним работу.
Теплопередача
К видам теплопередачи относятся теплопроводность, конвекция и излучение. Чтобы лучше понять, чем отличается один тип от другого, давайте разберем примеры.
-
Теплопроводность. Представьте, что ваши руки замерзли и вы держите в руках кружку кофе, чтобы их согреть. В таком случае тепло от более нагретого тела (кружки) передается менее нагретому (вашим рукам), до тех пор пока температура двух объектов не станет одинаковой. Так, горячая вода отдает свое тепло холодной при смешивании, а суп нагревает холодную ложку, если ее оставить в тарелке. Только аккуратно, не обожгитесь!
-
Конвекция — вид теплообмена, при котором внутренняя энергия передается струями и потоками самого вещества. Проще говоря, это процесс, который происходит в жидкостях и газах, когда слои вещества разной температуры перемешиваются. На этом принципе основано отопление помещения и проветривание комнаты. Кстати, ветры, дующие над поверхностью земного шара, — это тоже пример конвекции.
-
Излучение. Догадывались ли вы, что мы сталкиваемся с этим типом теплопередачи каждый день? Именно день, ведь солнечный свет излучает тепло с помощью электромагнитных волн, что делает жизнь на планете Земля возможной. По правде говоря, любое нагретое тело может стать источником тепла (человек, животные, свеча, костер, звезды). Это можно увидеть с помощью особого прибора — тепловизора.
Совершение работы над веществом
Здесь мы тоже не обойдемся без понятного примера. Возьмем пробирку с керосином, обыкновенный шнурок и термометр. Замерим начальную температуру и начнем натирать пробирку шнурком. Что произойдет с температурой? Она начнет возрастать. Это происходит благодаря теплопередаче? Или, может, невидимое излучение заставляет керосин нагреваться? Нет, мы изменили температуру вещества, совершив над ним работу.
Итак, подведем промежуточные итоги:
-
Тепло — это энергия, которая создается тепловым движением молекул.
-
Тепловое движение — процесс хаотичного движения частиц, образующих вещество.
-
С ростом температуры растет и скорость движения молекул, а полностью остановить это движение практически невозможно.
-
Изменить температуру тела можно двумя способами: с помощью теплопередачи или изменения внутренней энергии тела при совершении над ним работы.
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по физике
-
Выбирай из 890+ репетиторов по физике
Записывайся на бесплатные курсы для детей
Понятие тепловых явлений
Тепловые явления — это физические процессы, протекающие в телах при их нагревании или охлаждении. То есть это те явления, которые происходят с телами по мере изменения их температуры.
Давайте сделаем небольшую остановку на этом физическом понятии, а потом продолжим.
Температура — мера нагретости тела. Ее можно измерить с помощью термометра, или по-простому градусника. У этого прибора есть множество разновидностей, но в быту чаще всего пользуются ртутными (для измерения температуры человеческого тела), жидкостными (для измерения температуры воздуха или жидкости) и электронными термометрами.
В мире используют несколько температурных шкал: Цельсия, Кельвина и Фаренгейта. На онлайн-уроках физики в школе Skysmart вы подробнее познакомитесь с ними и научитесь легко переводить значения из одной шкалы в другую!
Какие бывают тепловые явления?
Давайте поразмышляем о том, что может происходить с телом под действием температуры. Для этого не придется идти далеко: достанем из холодильника кубик льда, опустим его в стакан и посмотрим, что получится. Спустя какое-то время лед начнет таять (или плавиться) и превратится в воду. Но на этом мы не остановимся! Перельем воду в кастрюлю и начнем нагревать на плите. Что произойдет тогда?
Абсолютно верно! Вода начнет нагреваться, а дальше — кипеть. Если вовремя не выключить плиту или не снять с нее кастрюлю, вся вода может выкипеть — превратиться в водяной пар.
За короткий промежуток времени мы смогли пронаблюдать воду в трех агрегатных состояниях: твердом, жидком и газообразном. А можно ли обратить процесс вспять и снова получить кубик льда?
Так просто это сделать не получится: должно быть, весь водяной пар разлетелся по квартире, и его будет очень сложно собрать воедино. Но это не говорит о том, что процесс перехода из одного агрегатного состояния в другое необратим.
Предположим, нам удастся добыть целый литр водяного пара. Охлаждая его, мы заметим, как пар конденсируется — превращается в капельки жидкости. А получить лед совсем просто, если поместить полученную жидкость в морозильную камеру.
Если внимательно проанализировать опыт, вы заметите, что переход из одного агрегатного состояния в другое не происходит мгновенно. Для этого необходимо нагреть или охладить вещество до определенной температуры, причем для каждого вещества эти температуры разные. Так, лед начинает таять при 0 °С, а железо плавится аж при 1 538 °С.
А как называются процессы, связанные с повышением и понижением температуры? Сколько их всего?
Начнем с самого легкого. Процессы, связанные с нагреванием или охлаждением, так и называются. Напомним, что эти процессы не ведут к изменению агрегатного состояния, а, можно сказать, являются подготовкой к нему.
Плавление — процесс перехода из твердого состояния в жидкое. А обратный процесс, когда жидкость превращается в твердое тело, называется кристаллизацией (или затвердеванием). Для этих процессов необходимо достичь одной и той же температуры вещества. То есть лед начнет плавиться при нуле градусов, но одновременно с этим вода начнет кристаллизоваться при этой температуре.
Парообразование (кипение) — процесс перехода жидкости в газ, а конденсация — обратный процесс перехода газа в жидкость. Для этих процессов также существует одна и та же температура. Ртуть кипит при температуре 356,7 °С, и при этой же температуре пары ртути превращаются в жидкость.
Отдельно выделим процесс сгорания вещества. Это явление также является тепловым, но, к сожалению, оно необратимо.
Рассмотрим график фазовых переходов для воды:
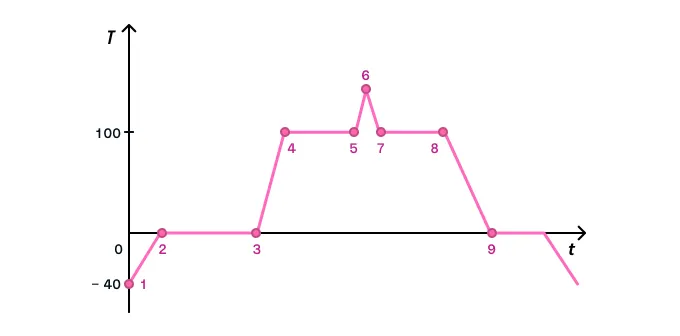
Обратите внимание на то, как одно тепловое явление сменяет другое. Согласно графику, в начале опыта мы берем лед при температуре −40 °С и начинаем его нагревать. График этого процесса представлен наклонной прямой 1–2.
Достигнув 0 °С (точка 2), лед начинает таять. Для этого процесса не нужно увеличивать температуру, достаточно 0 °С, но понадобится время, чтобы процесс завершился. Поэтому плавление льда на графике представлено прямой линией 2–3, параллельной оси абсцисс.
Мы продолжаем нагревать воду (наклонная линия графика 3–4) до 100 °С — в этой точке начинается кипение. Если мы хотим показать на графике, что процесс кипения продолжается, от точки 100 °С мы бы провели прямую линию, параллельную оси абсцисс (4–5), а нагревание водяного пара выглядело бы как наклонная линия 5–6 (схожая с подобными процессами, уже представленными на графике).
Пойдем в обратном направлении: на графике процесс 6–7 — охлаждение пара, 7–8 — конденсация, 8–9 — охлаждение жидкости, 9–10 — кристаллизация, а дальше — охлаждение твердого тела.
Итого к тепловым явлениям относятся 7 процессов: сгорание, нагревание, охлаждение, кипение (парообразование), конденсация, плавление, кристаллизация (затвердевание).
Формулы для расчета количества теплоты
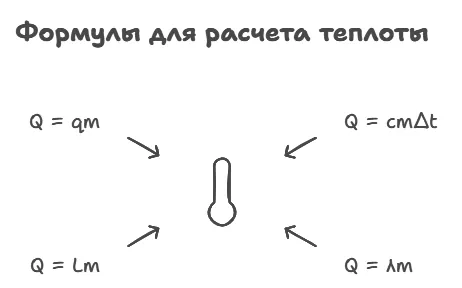
Количество теплоты, которое необходимо для возникновения процесса или выделяется при нем, можно рассчитать по формулам.
Количество теплоты, необходимое для нагревания тела или выделяющееся при охлаждении
Q = cmΔt
Q — количество теплоты [Дж]
c — удельная теплоемкость вещества, из которого состоит тело [Дж/(кг·°C)]
m — масса тела [кг]
Δt — изменение температуры тела [°C]
Отдельно поговорим про с — удельную теплоемкость вещества. Это табличная величина, т. е. ее значение для каждого вещества различается, оно постоянно и его можно найти в конце учебника по физике или в интернете.
Количество теплоты, необходимое для плавления или выделяющееся при кристаллизации
Q = λm
Q — количество теплоты, необходимое для плавления кристаллического тела, находящегося при температуре плавления в нормальном атмосферном давлении [Дж]
m — масса тела [кг]
λ — удельная теплота плавления вещества, из которого состоит тело [Дж/кг]
Количество теплоты, необходимое для кипения или выделяющееся при конденсации
Q = Lm
Q — количество теплоты, необходимое для превращения в пар жидкости (выделяющееся при конденсации пара), находящейся при температуре кипения и нормальном атмосферном давлении [Дж]
m — масса тела [кг]
L — удельная теплота парообразования жидкости [Дж/кг]
Количество теплоты, выделяющееся при полном сгорании топлива
Q = qm
Q — количество теплоты, выделяющееся при полном сгорании топлива [Дж]
q — удельная теплота сгорания топлива [Дж/кг]
m — масса топлива [кг]
Как вы можете заметить, все формулы имеют одну и ту же логику: энергия Q прямо пропорциональна массе тела и удельным величинам. А значит, чем больше масса тела, тем больше энергии потребуется для его нагревания. Чем меньше тело, тем меньше энергии выделится при его остывании, и т. д.
Тепловые явления встроены в нашу жизнь на все сто процентов. Все — от кулинарии до погодных явлений, от медицины до промышленности — в той или иной мере зависит от процессов нагревания, плавления, кипения и других.
Мы можем плавить металлы и изготавливать из них различные предметы, повышать влажность воздуха, кипятить воду и выпекать булочки, изготавливать микросхемы и лекарства. Какой процесс ни возьмете, во всех можно отыскать примеры тепловых явлений.
Тепловые процессы в физике связаны между собой. Порой нагревание одного вещества влечет за собой плавление и даже кипение другого. Заинтригованы? Приходите на онлайн-уроки физики в школу Skysmart — там вы сможете детально разобраться в этом и других поразительных процессах.