Для кого эта статья:
- Читатели, интересующиеся темой статьи
- Специалисты в данной области знаний
- Студенты или школьники, стремящиеся углубить свои знания
Фазовые переходы: изменение агрегатных состояний вещества
Прежде чем говорить о насыщенном паре, нужно освежить знания об агрегатных состояниях и фазовых переходах между ними. Если вы забыли, какие бывают агрегатные состояния, то можете сбегать в нашу статью про них.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества.
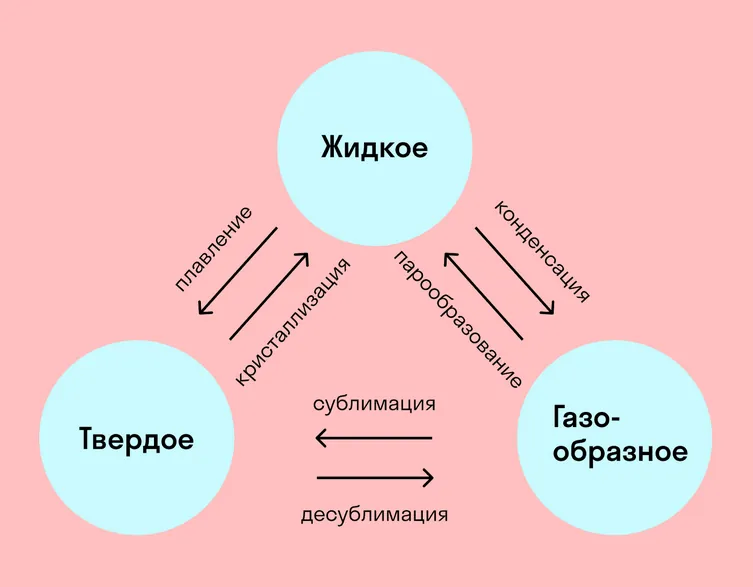
Вот какие бывают фазовые переходы:
Переход из твердого состояния в жидкое — плавление;
Переход из жидкого состояния в твердое — кристаллизация;
Переход из газообразного состояния в жидкое — конденсация;
Переход из жидкого состояния в газообразное — парообразование;
Переход из твердого состояния в газообразное, минуя жидкое — сублимация;
Переход из газообразного состояния в твердое, минуя жидкое — десублимация.
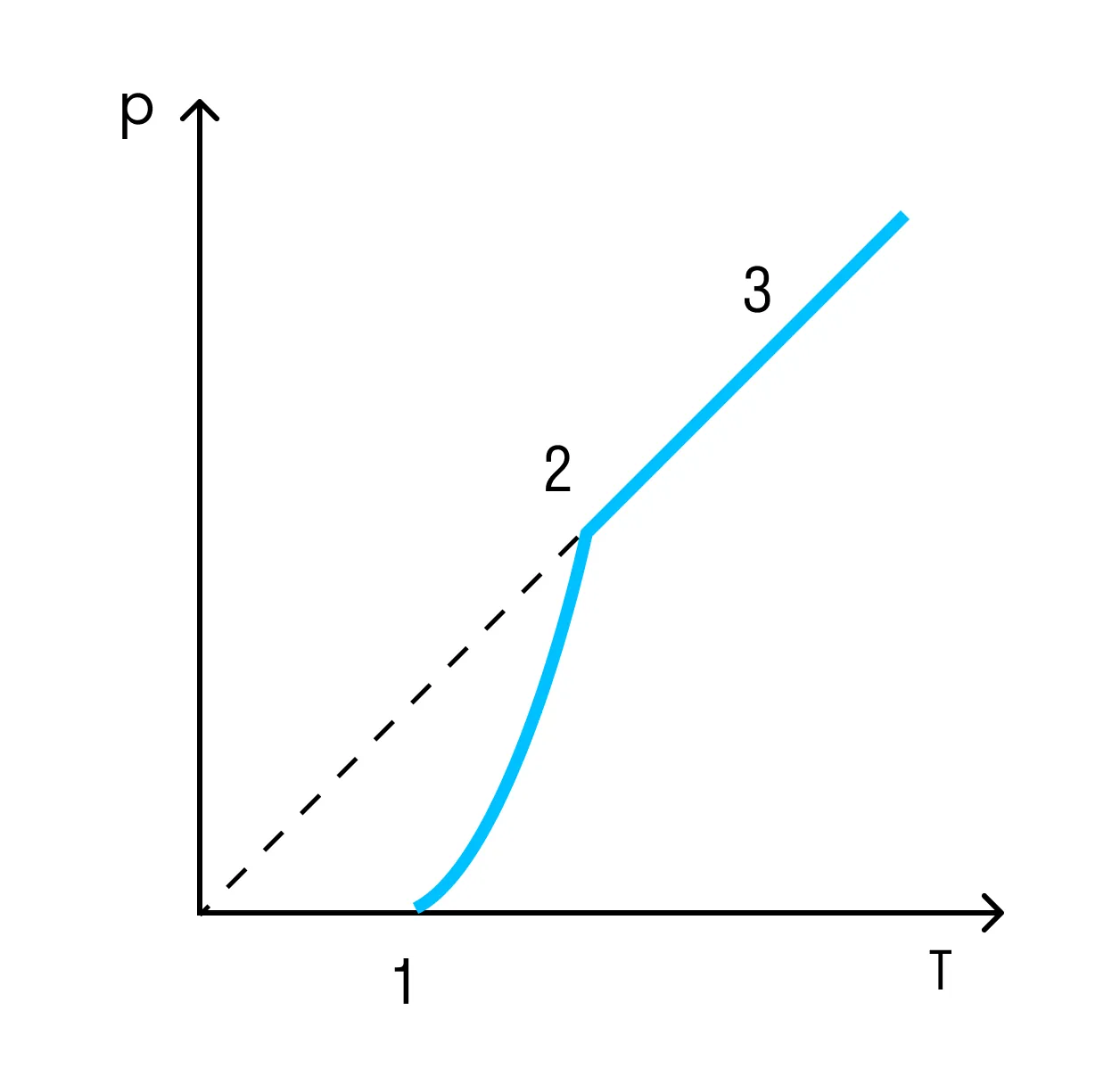
На схеме — названия всех фазовых переходов:
Парообразование
Итак, парообразование — это переход из жидкого состояния в газообразное.
При парообразовании всегда происходит поглощение энергии: к веществу необходимо подводить теплоту, чтобы оно испарялось. Из-за этого внутренняя энергия вещества увеличивается.
У процесса парообразования есть две разновидности: испарение и кипение.
Испарение — это превращение или переход жидкости в газ (пар) со свободной поверхности жидкости. Если поверхность жидкости открыта и с нее начинается переход вещества из жидкого состояния в газообразное, это будет называться испарением.
Кипение — процесс интенсивного парообразования, который происходит в жидкости при определенной температуре.
Например, мы заварили себе горячий чай. Над чашкой мы увидим пар, так как вода только что поучаствовала в процессе кипения.
Подождите-ка, мы ведь только что сказали, что кипение и испарение — разные вещи. 🤔 Это действительно так, но при этом оба процесса могут происходить параллельно.
Испарение может происходить и без кипения, просто тогда оно не будет для нас заметно. Например, вода в озере испаряется, хотя мы этого и не замечаем. Кипение по сути своей — это интенсивное испарение, которое вызвали внешними условиями — доведя вещество до температуры кипения.
Физика объясняет испарение тем, что жидкость обычно несколько холоднее окружающего воздуха, и из-за разницы температур происходит испарение.
Если нет каких-то внешних воздействий, испарение жидкостей происходит крайне медленно. Молекулы покидают жидкость из-за явления диффузии.
|
Направление тепловых потоков при испарении может идти в разной последовательности и комбинациях:
|
Подытожим, чтобы не запутаться, в чем главная разница между испарением и кипением:
Испарение |
Кипение |
|---|---|
|
|
Получи больше пользы от Skysmart:
-
Подтяни оценки на курсах по физике
-
Выбирай из 890+ репетиторов по физике
Записывайся на бесплатные курсы для детей
Температура кипения
При температуре кипения давление насыщенного пара становится равным внешнему давлению на жидкость — чаще всего это атмосферное давление. Значит, чем больше внешнее давление, тем при более высокой температуре начнется кипение.
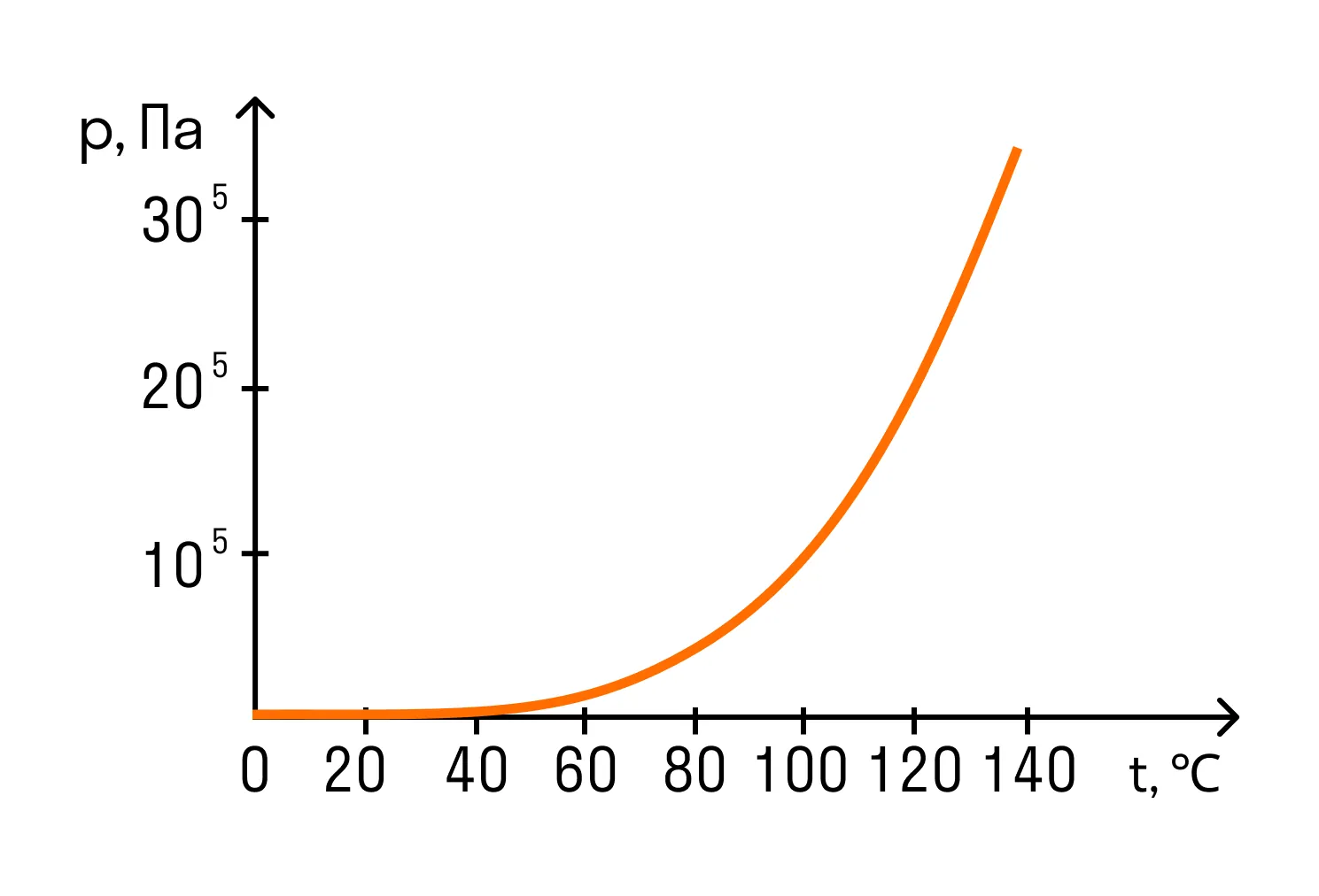
При нормальном атмосферном давлении, которое приблизительно равно 100 кПа, температура кипения воды равна 100°C. Поэтому можно сразу сказать, что давление насыщенного водяного пара при температуре 100 градусов по Цельсию равно 100 кПа. Это значение пригодится при решении задач.
Чем выше мы поднимаемся, тем меньше становится атмосферное давление, потому что масса атмосферы над нами уменьшается. Так, например, на вершине Эльбруса атмосферное давление составляет 5 × 104 Па — в два раза меньше, чем нормальное атмосферное давление. Поэтому и температура кипения на вершине Эльбруса будет ниже, чем на уровне моря. Вода там закипит при температуре 82°C.
Температура кипения при нормальном атмосферном давлении — это строго определенная величина для каждой жидкости.
t, °C |
Вещество |
|---|---|
-253 -183 35 78 100 357 3050 4200 5657 |
водород кислород эфир спирт вода ртуть железо графит вольфрам |
Испарение и конденсация
Молекулы в жидкости непрерывно и хаотично движутся. Это значит, что направление движения отдельно взятых молекул — это случайные направления. При этом жидкость сохраняет свой объем. Также молекулы силами притяжения притягиваются друг к другу, из-за чего не могут покинуть Омск жидкость.
Значения скоростей молекул случайны. Из-за этого среди всех молекул обязательно есть те, что движутся очень быстро. Если такая молекула окажется вблизи поверхности раздела жидкости и окружающей среды, то ее кинетическая энергия может достигнуть большого значения, и молекула покинет жидкость.
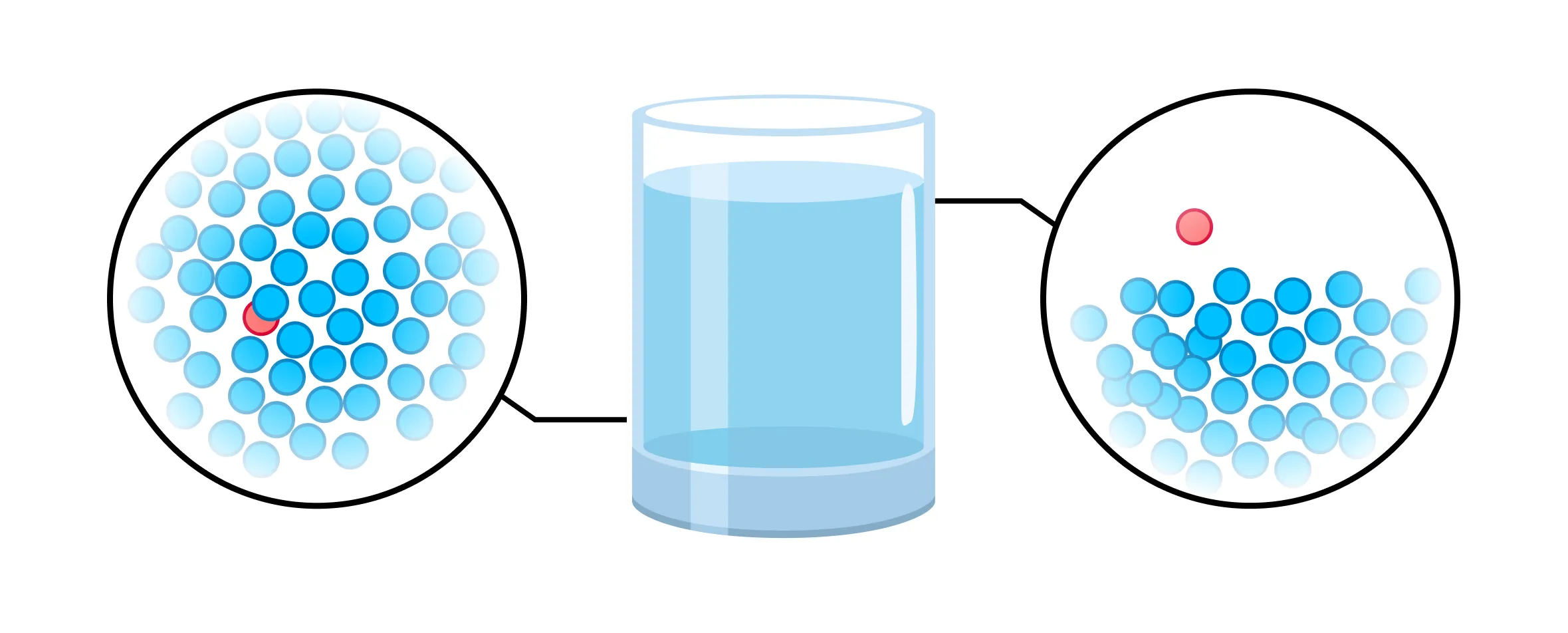
Собственно, именно так происходит процесс испарения (мы говорили о нем выше, когда речь шла о фазовых переходах). Когда испарившихся молекул становится много, образуется пар.
Обратный процесс тоже возможен: вырвавшиеся за пределы жидкости молекулы вернутся в жидкость. Это конденсация, о ней мы тоже говорили.
Если открыть сосуд с жидкостью, то испарившиеся молекулы будут покидать пространство над жидкостью и не возвращаться обратно. Количество жидкости таким образом будет уменьшаться. То есть жидкость испаряется, а пар обратно не конденсируется (потому что молекулы этого пара удаляются от жидкости) — так происходит высыхание.
Испарение может происходить с разной скоростью. Чем больше силы притяжения молекул друг к другу, тем меньшее число молекул в единицу времени окажется в состоянии преодолеть эти силы притяжения и вылететь наружу, и тем меньше скорость испарения.
Быстро испаряются такие жидкости, как эфир, ацетон, спирт. Из-за этого свойства их иногда называют летучими жидкостями. Медленнее — вода. Намного медленнее воды испаряются масло и ртуть.
Курсы подготовки к ОГЭ по физике помогут снять стресс перед экзаменом и получить высокий балл.
Определение насыщенного пара
Оставим стакан воды на столе и будем замерять уровень воды в нем каждый день. Если записать эти измерения и сравнить их, станет очевидно: уровень воды стал меньше, то есть вода испарилась.
Теперь давайте накроем стакан сверху. Молекулы пара уже не смогут покидать пространство над жидкостью, по мере испарения их количество начнет расти, а значит, будет расти и количество молекул, которые конденсируются в единицу времени.
Сначала количество конденсирующихся молекул за единицу времени будет меньше количества испаряющихся молекул. Но по мере роста концентрации пара (то есть увеличении количества молекул в единице объема пара) поток конденсирующихся молекул вырастет. Это приведет к состоянию, которое называется динамическим равновесием.
Пар, находящейся в динамическом равновесии, называют насыщенным.
Представьте себе огромный бизнес-центр с не менее огромными дверями. У сотрудников бизнес-центра разный график работы, поэтому люди одновременно заходят в здание и выходят из него в произвольном количестве. Допустим, в 6 часов вечера 100 человек заходят в здание, чтобы попасть на деловую встречу, а другие 100 человек уже закончили работать и идут домой. Количество заходящих в бизнес-центр и выходящих из него будет одинаковым — это и есть состояние насыщения.
| Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный. |
Свойства насыщенного пара
При постоянной температуре плотность насыщенного пара не зависит от его объема.
Представьте, что объем сосуда с насыщенным паром уменьшили, не изменив температуры.
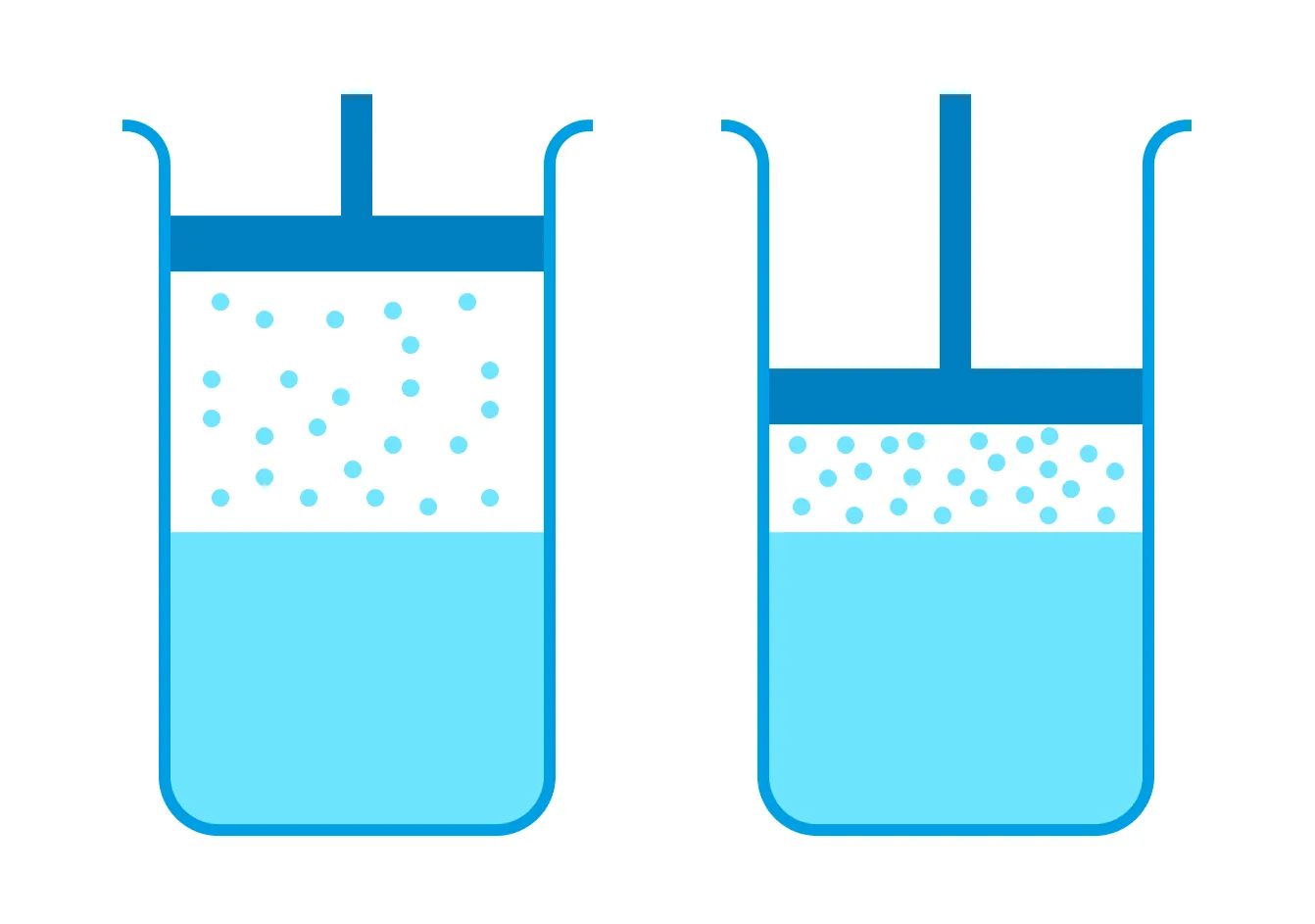
Количество молекул, переходящих от пара к жидкости, превысит количество испаряющихся молекул, но при этом часть пара сконденсируется, а оставшийся пар снова придет в динамическое равновесие. В итоге плотность этого пара будет равна начальной плотности.
Давление насыщенного пара не зависит от его объема.
Это связано с тем, что давление и плотность связаны через уравнение Менделеева-Клапейрона, и следует из первого свойства насыщенного пара.
Кстати, уравнение Менделеева-Клапейрона справедливо для насыщенного пара. При этом нужно быть внимательным с частными случаями. Так, например, закон Бойля-Мариотта для насыщенного пара не выполняется.
Уравнение Менделеева-Клапейрона
pV = νRT
p — давление газа [Па]
V — объем [м3]
ν — количество вещества [моль]
T — температура [К]
R — универсальная газовая постоянная
R = 8,31 м2 × кг × с-2 × К-1 × моль-1
При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры.
В начальный момент испарения динамическое равновесие будет нарушено (некоторая часть жидкости испарится дополнительно). Плотность пара будет расти, пока динамическое равновесие не восстановится.
Давление и температура насыщенного пара растут быстрее, чем по линейному закону, который справедлив для идеального газа.
В случае идеального газа рост давления обусловлен только ростом температуры, а в случае с насыщенном паром имеют значение два фактора: температура и масса пара.
В случае нагревания насыщенного пара молекулы начинают ударяться чаще, так как их в целом стало больше, потому что пара стало больше.
Главное отличие насыщенного пара от идеального газа: пар сам по себе не является замкнутой системой, а находится в постоянном контакте с жидкостью.
Решение задач по теме «Насыщенный пар»
Применим свойства насыщенного пара при решении задач.
Задачка раз
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните.
Решение
Так как пар и вода находятся в контакте длительное время, пар является насыщенным. При уменьшении объема сосуда давление насыщенного пара не меняется. Из уравнения Менделеева-Клапейрона следует, что для того, чтобы давление пара не менялось, его количество вещества (а значит и масса) должно уменьшаться.
pV = νRT
В этом процессе происходит конденсация, часть молекул пара переходят в жидкость, поэтому масса жидкости увеличивается.
Ответ
Масса жидкости увеличивается.
Задачка два
Какова плотность насыщенного пара при температуре 100°С?
Решение
При нормальном давлении (p = 105 Па) 100°С — это температура кипения воды. Значит, давление насыщенного пара при этой температуре равно атмосферному давлению.
Найдем связь между давлением и плотностью через уравнение Менделеева-Клапейрона.

Подставим значение давления в уравнение состояния идеального газа, предварительно переведя температуру в Кельвины: T = 100 + 273 = 373 K